珊瑚树Vibsane型二萜类化合物对人体HepG2细胞增殖的影响及其机制*
张海芳,王 林,刘 洁,周文斌,张刘珍,善亚君,余祖胤,刘 萍,唐红卫,从玉文△
(1.徐州医学院,江苏 徐州221002;2.军事医学科学院放射与辐射医学研究所,北京100850;3.北京武警总医院,北京100390;4.解放军总医院海南分院药剂科,海南三亚572013)
肝细胞癌(hepatocellular carcinoma)是最常见的恶性肿瘤之一,其发病率、致死率高[1]。目前,早期肝癌的主要治疗手段仍是手术切除和肝脏移植。但由于肝癌起病隐匿、缺乏早期症状体征,超过70%的患者在确诊时已失去手术治疗的机会,只能采取非手术的保守疗法[2]。全身化疗是保守疗法的重要手段之一,但现有的化疗药物对肿瘤细胞的特异性不强、引起的毒副反应较大且易发生肿瘤耐药。因此,寻找治疗肝癌的新药是目前亟待解决的问题。
珊瑚树(viburnum odoratissimum)是忍冬科(caprifoliaceae)荚艹迷属植物,始载于《中国高等植物图鉴》,它的枝叶可入药,有通经活络功效,主治风湿痹痛、跌打肿痛、骨折。珊瑚树中主要含有二萜、三萜、黄酮、倍半萜、木脂素及香豆素苷等类化合物[3]。其中vibsanin型二萜类化合物是珊瑚树的特征化合物[4]。该类化合物分为3种亚型结构即十一元环型、七元环型和重排型,主要具有细胞毒、抗菌、鱼毒、抑制植物生长等活性,其中细胞毒活性报道较多。然而,有关此类化合物的抗肿瘤活性报道十分零散不系统,且缺乏相关作用机制的深入研究[5-10]。本实验室从云南珊瑚树(viburnum odoratissimum Ker-Gal.var.sessiliflorum)的叶子中分离提取得到多种十一元环二萜类化合物,研究其中的1#、2#3、8#、10#、12#5种二萜化合物对人肝癌HepG2细胞增殖的影响,并对其作用机制进行初步探讨。
1 材料与方法
1.1 药物与试剂
珊瑚树化合物,化合物储存液用DMSO配制,使用时用培养液稀释;RPMI-1640培养液,美国 Gibico公司;胎牛血,中国杭州四季青公司;RNA酶,美国Sigma公司;噻唑蓝 ,Thermo公司;台盼蓝,美国 Sigma公司;细胞凋亡检测试剂盒,北京宝赛生物技术有限公司;Apo-ONE Homogeneous Caspase-3/7试剂盒,美国Promega公司
1.2 仪器
FACSCalibur流式细胞仪,美国Becton Dickinson;DNM-9602G型酶标仪,北京普朗新技术有限公司;CO2培养箱,日本三洋公司;便携式化学发光检测仪,美国Perkin Elmer公司。
1.3 细胞株与细胞培养
人白血病 K562、人肝癌 HepG2和人食道癌EC109细胞株为本实验室冻存;K562、HepG2和EC109细胞株以 2×105cells/ml的密度种植在 50 mm2的培养瓶中,用含体积分数10%牛血清RPMI 1640培养液在37℃、5%CO2饱和湿度的条件下培养。
1.4 MTT法检测细胞增殖
测5种化合物对HepG2细胞增殖的影响:空白对照组:加入100μl DMSO;对照组:HepG2细胞+含血清的RPMI1640培养液,共100μl;实验组:共设10个浓度组。HepG2细胞+化合物1#、2#3、8#、10#、12#(使其终浓度分别为 0.4、0.8、1.6、3.1、6.25、12.5、25、50、100μmol/l)共 100μl。
测化合物1#对不同肿瘤细胞增殖的影响:空白对照组:加入 100μl DMSO;对照组:HepG2、EC109、K562细胞+含血清的RPMI 1640培养液,共100μl;实验组:共设 10个浓度组。HepG2、EC109、K562细胞+化合物1#(使其终浓度分别为 0.4、0.8、1.6、3.1、6.25、12.5、25、50、100μmol/L)共 100 μl。取对数生长期的细胞,以 1.0×105cells/ml的密度接种于96孔培养板中,将96孔培养板放入37°C、5%CO2培养箱培养24 h,更换培养液,取二萜类化合物储存液,实验组加入二萜类化合物,用RPMI 1640培养液稀释至终浓度。每个浓度设3个复孔,放入细胞培养箱培养48 h。每孔加入20μl MTT溶液,37°C、5%CO2培养箱中继续孵育 4 h后,微量枪汲取上清弃去后,每孔加200μl DMSO溶液,在振荡器轻轻振荡15min,沉淀物溶解,MTT法检测珊瑚树化学成分对三种肿瘤细胞增殖影响,酶标仪上于波长570 nm处读取吸光值,绘制剂量效应曲线,求出珊瑚化合物对肿瘤细胞的半数抑制浓度(IC50)。
1.5 细胞台盼蓝计数法
对照组:HepG2细胞(密度为 0.5×105cells/ml)+含血清的RPMI 1640培养液,共2 ml;实验组:共设5个浓度组。HepG2细胞(密度为0.5×105cells/ml)+ 化合物 1#(终浓度分别为 2.5、5、7.5、10 μmol/L),共 2 ml。取对数生长期的肝癌 HepG2细胞,种于6孔培养板,2 ml每孔细胞悬液,将6孔培养板在37°C、5%CO2培养箱培养 24 h,换培养液,取化合物1#储存液,实验组加入化合物1#,用RPMI 1640培养液稀释至终浓度。在培养箱继续培养12 h,24 h,36 h,48 h,用胰蛋白酶消化离心收集所有的细胞,台盼蓝染色,倒置显微镜下观察和计数,并记录结果。实验重复3次。。
1.6 流式细胞仪检测细胞周期变化
空白对照组;2 ml DMSO溶液;对照组:HepG2细胞(密度为1×105cells/ml)+含血清的RPMI 1640培养液,共2 ml;实验组:共设5个浓度组。HepG2细胞(密度为1×105cells/ml)+不同浓度的化合物1#(终浓度分别为 2.5、5、7.5、10μmol/l),共 2 ml。取对数生长期的肝癌HepG2细胞,种于6孔培养板,2ml每孔细胞悬液。将6孔培养板在37°C、5%CO2培养箱培养24 h,换培养液,取化合物1#储存液,实验组加入化合物1#,用RPMI1640培养液稀释至终浓度。在培养箱继续培养12 h,24 h,,离心收集单细胞悬液(500×g,5 min),体积分数为70%的冰乙醇固定4℃过夜,固定后的细胞离心,弃上清,100 μl(1 mg/ml)RNase A酶,37℃处理 30 min,PI(100 μg/ml)染色后,流式细胞仪上机检测,实验重复 3次。
1.7 AnnexinⅤ/PI双标方法检测细胞凋亡
空白对照组;2 ml DMSO溶液;对照组:HepG2细胞(密度为1×105cells/ml)+含血清的RPMI 1640培养液,共2 ml;实验组:共设5个浓度组。HepG2细胞(密度为1×105cells/ml)+不同浓度的化合物1#(终浓度分别为 5、7.5、10μmol/l),共 2ml。取对数生长期细胞,按1×105cells/ml的细胞密度接种于 6孔板在37°C、5%CO2培养箱培养 24 h,换培养液,取化合物1#储存液,实验组加入化合物1#,用RPMI1640培养液稀释至终浓度。在培养箱继续培养24 h,离心收集单细胞悬液(500×g,5min),用PBS洗涤1次,每个样品中加入100μl膜连蛋白Ⅴ(Annexin-Ⅴ),室温孵育 15min,然后加入 400μl PI(50 μg/ml)流式细胞仪检测,实验重复3次。
1.8 caspase-3/7活性检测
实验分为3组:空白对照组:Caspase 3/7试剂+细胞培养液;阴性对照组 :Caspase-3/7试剂+不经处理的 HepG2细胞(密度为 1×105cells/ml);实验组:Caspase 3/7试剂+化合物#处理的细胞。caspase 3/7活性检测按Apo-ONE Homogeneous Caspase-3/7试剂盒说明书进行。细胞经化合物1#处理后24 h,加入50μl含 Z-DEVD-罗丹明110的 Caspase-3/7缓冲液(Promega)培养板置室温避光反应30 min,用微孔板荧光检测仪测定在激发光波长485 nm,发射光波长535 nm处的荧光值。实验重复3次。
1.9 统计学分析
实验数据采用均值±标准差(¯x±s)表示,统计分析采用 SPSS 16.0软件进行单因素多水平方差分析。
2 结果
2.1 化合物对HepG2细胞增殖的影响
为了测定vibsane型二萜类化合物对人肝癌细胞增殖的影响,HepG2细胞经各化合物处理48 h,MTT检测细胞活性,结果显示HepG2,细胞增殖均受到明显抑制,其中化合物1#对HepG2细胞的增殖抑制作用最显著,IC50值为 5.86±1.85μmol/l;化合物2#3和 8#活性次之,IC50值分别 7.34±2.07 μmol/L、7.54±0.99μmol/L,化合物 10#和 12#抑制HepG2细胞增殖的作用则相对较弱,其IC50值分别为 18.15±2.49μmol/L和 15.94±3.63μmol/L。这五种化合物对HepG2细胞的增殖抑制作用差异有统计学意义(P<0.01,图1)。为了发现此类二萜化合物的结构活性基团,我们以其IC50值为指针,进行初步的构效关系分析。结果显示,化合物C-14位(10#化合物)和 C-15位(12#化合物)分别连接-OH,活性显著降低,而 C-15位连接-OOH(8#化合物)对活性影响较弱。此外,在C-6、C-7位形成环氧基(2#3化合物)也减弱化合物活性。结果提示该类化合物十一元环C11位连接侧链的基团修饰对化合物抑制肿瘤细胞增殖活性影响较大。

Fig.1 The antiproliferative effect of the chemical composition on HepG2 cells
2.2 1#化合物对不同肿瘤系细胞增殖的影响
为了进一步观察不同组织来源的肿瘤细胞对化合物1#的敏感性,将化合物1#分别处理人肝癌HepG2、人白血病K562和人食道癌 EC109细胞,结果表明,化合物1#对上述三种肿瘤细胞系的增殖均有不同程度的抑制作用,其 IC50分别为5.86±1.85μmol/L、8.68±1.29μmol/L、26.94±0.31μmol/L,其中 HepG2细胞对化合物1#最为敏感(P<0.01)。
鉴于上述MTT实验结果,选择化合物1#作为后续的研究对象。
2.3 1#化合物抑制HepG2细胞增殖的剂量效应和时间效应
如表1所示,随着化合物#作用浓度的增加和处理时间的延长,细胞增殖受到明显抑制,较高浓度(7.5μmol/L、10μmol/L)化合物处理后的 HepG2细胞48 h内几乎没有增殖,化合物1#抑制HepG2细胞增殖具有显著的时间(P<0.05)和剂量依赖性(P<0.01)。

Tab.1 Compound 1#inhibited the proliferation of HepG2 cells in a dose and time dependentmanner(%,¯x±s,n=3)
2.4 1#化合物对HepG2细胞周期的影响
流式细胞仪检测细胞周期的结果显示,不同浓度(2.5~7.5μmol/L)的化合物 1#作用于 HepG2细胞12 h后,化合物1#引起HepG2细胞G0/G1期细胞比例剂量依赖性增加,S期细胞比例剂量依赖性减少。2.5μmol/L化合物 1#作用 HepG2细胞 12 h对细胞周期无影响,5、7.5μmol/L 1#化合物作用HepG2细胞12 h,G0/G1期细胞比例明显高于对照组(P<0.05),S期细胞比例明显减少(P<0.05),G2/M期细胞比例则改变不明显。2.5~7.5μmol/L化合物1#作用HepG2细胞24 h,G0/G1期细胞比例明显高于对照组(P<0.05),S期细胞比例明显减少(P<0.05),G2/M期细胞比例则改变不明显。这些结果显示化合物1#诱导HepG2细胞发生显著的G0/G1期周期阻滞(表 2)。

Tab.2 Effect of the compound 1#on HepG2 cells cycle(%,¯x±s,n=3)
2.5 1#化合物诱导 HepG2细胞凋亡
用AnnexinⅤ/PI双标方法分析1#化合物对HepG2细胞凋亡的影响,结果显示1#化合物(5~10 μmol/L)孵育细胞24 h,细胞凋亡率随着1#化合物的浓度增高而增加,与对照组相比,细胞凋亡率有显著性差异(P<0.05,P<0.01)。表明 1#化合物可显著诱导 HepG2肿瘤细胞发生凋亡(图2,表3)。

Fig.2 The compound 1#induced HepG2 cells apoptosis
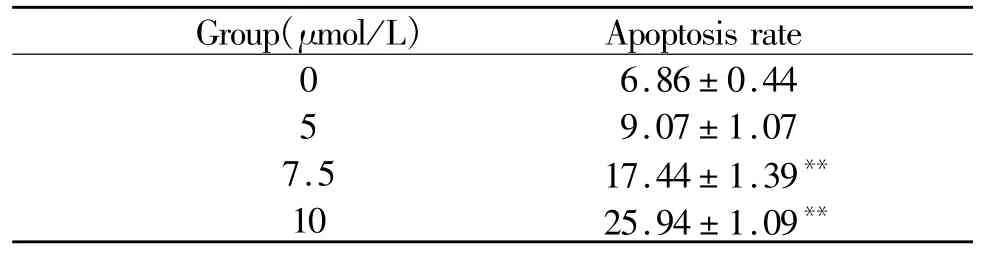
Tab.3 The compound 1#induced HepG2 cells apoptosis(%,¯x±s,n=3)
2.6 1#化合物对HepG2细胞Caspase-3酶活性的影响
Apo-ONE HomogeneousCaspase-3/7试剂盒检测caspase3/7活性变化结果显示:化合物 1#处理HepG2细胞24 h,随着化合物浓度的增高,Caspase-3酶活性逐渐增强,较高浓度(5~10μmpl/L)化合物诱导Caspase-3/7活性明显升高(与对照相比,P<0.05,P<0.01,表 4)。结果表明 1#化合物诱导剂量依赖性Caspase-3/7激活。

Tab.4 Activity assay Caspase 3 activation(%,¯x±s,n=3)
3 讨论
目前,对于不能手术治疗的晚期肝癌,其中全身化疗是其治疗的重要手段之一。但是大多数化疗药都因选择性差,毒副作用大而且容易产生耐药性,因此,寻找高效、低毒、选择性强的天然抗肿瘤药物很有必要。本研究首次报道珊瑚树特有的vibsane型二萜类化合物对人肝癌细胞具有显著的增殖抑制作用,并对其机制进行了初步研究,结果表明化合物1#抑制肿瘤作用最强,且对HepG2细胞最为敏感,因此选择化合物1#为后续的研究对象;化合物1#能通过诱导细胞周期G0/G1期阻滞和细胞凋亡从而抑制肿瘤细胞生长。研究发现多个vibsane型二萜类化合物均有抗肿瘤活性,抑制构效关系分析表明十一元环C11位连接侧链的基团修饰对化合物活性有明显影响。由于筛选的化合物有限,我们对此类化合物发挥抗肿瘤作用的关键基团依然知之甚少,尚需进一步对其结构修饰后评价其构效关系。
细胞凋亡是指为维持内环境的稳定,体内各种细胞自主有序性的死亡。细胞凋亡调控失调导致的细胞凋亡抵抗(resistance to apoptosis)是肿瘤发生的主要原因之一[11,12]。而诱导细胞凋亡是抗肿瘤的主要机制之一,多数抗肿瘤药物具有诱导肿瘤细胞凋亡的作用[13]。因此,诱导肿瘤细胞凋亡已成为寻找抗肿瘤药物的新靶点。本文研究发现较低浓度的1#化合物显著诱导HepG2细胞周期 G0/G1期阻滞,随着药物浓度提高,则细胞凋亡明显增加,表现为磷脂酰丝氨酸外翻以及Caspase3/7激活。Caspase可分为两类:始动Caspases和效应Caspases,前者包括 caspase-2,-8,-9及-10,后者包括 caspase-3,-6及-7[14]。与 Caspase相关的凋亡调节路径主要有两个:一是细胞表面死亡受体途径,另一个是线粒体途径[15]。本研究发现1#化合物显著激活 Caspase3/7,提示其可能激活Caspase通路参与其诱导的细胞凋亡,但化合物激活何种caspase凋亡途径仍未可知,其是否诱导caspase依赖的细胞凋亡也有待进一步研究。我们在上述实验结果的基础上,正深入研究vibsane型二萜类化合物如何影响细胞周期和启动细胞凋亡信号转导机制,及其对细胞周期相关蛋白激酶活性和细胞凋亡相关基因表达的影响。
珊瑚树中的vibsanin型二萜类化合物在自然界植物中分布非常有限,但其结构又是复杂多样的,且活性特点各异、强弱不一,因此对vibsanin型二萜类化合物进行系统的分离纯化、活性筛选及构效关系分析,并对其可能的抗肿瘤作用及其机制进行深入研究,有望为研发新型天然植物类抗肿瘤药物提供实验依据。
[1] Jemal A,Bray F,CenterMM,etal.Global cancer statistics[J].CACancer JClin,2011,61(2):69-90.
[2] Verslype C,Van Cutsem E,Dicato M.et al.Themanagement of hepatocellular carcinoma.Current expert opinion and recommendations derived from the 10th World Congress on Gastrointestinal Cancer,Barcelona,2008[J].Ann Oncol,2009,20(suppl7):viil-vii6.
[3] 刘 洁,周文斌,从玉文,等.珊瑚树化学成分及生物活性研究进展[J].药学学报,2013,48(3):325?332.
[4] KuroyanagiM,Shiotsu M,Ebihara T,etal.Chemical studieson Viburnum awabuki K.Koch[J].Chem Pharm Bull,1986,34(2):4012-4017.
[5] 李学汤,林 晨,李佩茵,等.七种人癌细胞系对冬凌夏草甲素的敏感性比较[J].药学学报,1985,20(4):243-246.
[6] Zhang CL,Wu LJ,Zuo HJ,et al.Cytochrome c release from oridonin-treated apoptotic A375-S2 cells is dependenton p53 and extracellular signal-regulated kinase activation[J].JPharmacol Sci,2004,96(2):155-163.
[7] Ikezoe T,Chen SS,Tong XJ,etal.Oridonin inducesgrowth inhibition and apoptosis of a variety of human cancer cells[J].Int JOncol,2003,23(4):1187-1193.
[8] Chen S,Gao J,Halicka HD,et al.The cytostatic and cytotoxic effects of oridonin(Rubescenin),a diterpenoid from Rabdosia rubescens,on tumor cells of different lineage[J].Int JOncol,2005,26(3):579-588.
[9] Zhen T,Wu CF,Liu P,etal.Targeting of AML1-ETO in t(8;21)leukemia by oridonin generates a tumor suppressorlike protein[J].Sci TranslMed,2012,4(127):127ra38.
[10]Shen YC,Lin CL,Chien SC,et al.Vibsane diterpenoids from the leaves and flowers of viburnum odoratissimum[J].Nat Prod,2004,67(1):74-77.
[11]Traver D,Akashi K,Weissman IL,Lagasse E.Mice defective in two apoptosis pathways in themyeloid lineage develop acutemyeloblastic leukemia[J].Immunity,1998,9(1):47-57.
[12]Green DR,Evan GI.A matter of life and death[J].Cancer Cell,2002,1(1):19-30.
[13]Sun SY,Hail N Jr,Lotan R.Apoptosis as a novel target for cancer chemoprevention[J].J Natl Cancer Inst,2004,96(9):662-672.
[14] Thornberry NA,Lazenbnik Y.Caspases:enemies within[J].Science,1998,281(5381):1312-1316.
[15]Garrido C,Kroemer G.Life’s smile,death’s grin:vital functions of apoptosis-executing proteins[J].Curr Opin Cell Biol,2004,16(6):639-646.

