羽毛中脂质对羽毛角蛋白降解的影响
■王德山 张铁鹰 梁争文 邹林源
(中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京100193)
蛋白质饲料资源严重短缺成为限制我国饲料工业健康发展的主要因素之一。我国既是饲料生产大国,也是畜禽养殖大国。每年产生大量羽毛、猪、牛、羊等的皮毛和蹄角等畜禽屠宰废弃物,这些废弃物蛋白质含量高,氨基酸比例合理,是不可多得的蛋白质饲料资源。但这些废弃物主要为角蛋白,难以被胰蛋白酶等动物内源性蛋白酶水解,不能直接饲喂畜禽。羽毛蛋白质含量高达80%以上,富含甘氨酸、苏氨酸、组氨酸、脯氨酸、半胱氨酸等多种动物所必需的氨基酸,其蛋白质二级结构以β-折叠结构为主。羽毛角蛋白分子在二硫键、氢键、离子键、疏水键等作用下,形成高度交联的角蛋白分子三维稳定构象,使亲水集团在角蛋白内部,疏水基团暴露在外,使角蛋白难以溶解,胰蛋白酶、胃蛋白酶和木瓜蛋白酶等并不能将其水解,畜禽消化系统对角蛋白消化率较低。因此,提高非常规蛋白质饲料的利用对缓解蛋白饲料资源供需矛盾至关重要。
与传统物理化学法理羽毛角蛋白相比,微生物降解或酶解羽毛角蛋白工艺具有能耗低,环境污染小,反应条件温和、氨基酸结构破坏少等优点。利用微生物酶处理角蛋白的关键在于,弄清参与微生物角蛋白降解过程的微生物酶种类与主要功能,探明这些酶在微生物降解过程中的协同关系。这不仅有利于全面了解和发展完善微生物降解角蛋白的机制,也可为羽毛等角蛋白废弃物生物酶解处理提供理论指导。
动物羽毛外层被一层脂质覆盖,毛发中也含有少量的脂类与角蛋白形成共价键。不同羽毛脂类含量不同,鸡鸭羽毛均含有不同量的脂类(主要为动物蜡),并推测这些脂类为C24的酯类[1]。这使角蛋白亲水性降低,进一步增加了角蛋白稳定性和难于被蛋白酶水解的抗性。因此,微生物在角蛋白降解过程中,如何破坏这些脂类物质对充分理解角蛋白的降解也尤为重要。
关于羽毛中脂质对羽毛角蛋白降解速度的研究较少,绝大部分研究主要集中于角蛋白酶的研究。因此探明脂质结构对微生物降解和酶解的影响对提高羽毛角蛋白生物处理效率具有重要意义。本研究以本实验室筛选的角蛋白降解菌地衣芽孢杆菌CP-16(3~4 d即可将羽毛彻底降解,含羽轴部分)[2]为研究对象,通过研究羽毛脱脂处理对CP-16胞外蛋白酶水解角蛋白活性的影响,探明水解羽毛脂质对羽毛角蛋白降解的重要性,为羽毛角蛋白高效生物处理提供指导。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
菌株为地衣芽孢杆菌CP-16(菌株保藏号IASZ⁃TYCP-16),由本实验室从畜禽废弃物中筛选得到。
1.1.2 蛋白酶
4种胞外蛋白酶P-Glu、P-Alk、P-Trx、P-Ker,克隆于地衣芽孢杆菌CP-16,经大肠杆菌表达获得。
1.1.3 羽毛的处理
天然羽毛粉:将白鸡羽毛用洗涤剂揉搓洗涤,自来水冲洗干净后,121℃高压灭菌1 h,去离子水洗净,80℃烘48 h,冷却粉碎,过100目筛备用。
脱脂羽毛粉:经洗净灭菌冷却后的天然羽毛,剪碎用滤纸包装后置于索氏提取器,提取液为60~80℃沸程的石油醚,萃取12 h,结束后用去离子水洗净烘干,粉碎过100目筛备用。
1.1.4 试剂和溶液
脂肪酶(Candida antarctica,sigma,CAS:52583)、氧化型谷胱甘肽(GSSG)、苯甲基磺酰氟(PMSF)、Ell⁃man试剂(DTNB)、酪蛋白、对硝基苯酚乙酸酯、对硝基苯酚购自Sigma公司;其它试剂均为国产分析纯。
氧化型谷胱甘肽(GSSG;50 mM):准确称取0.612 6 g氧化型谷胱甘肽溶于20 ml pH值8.0的磷酸缓冲液中,4℃保存备用。
PMSF溶液(100 mM):称取0.174 g PMSF溶于10 ml异丙醇中即为100 mM的PMSF溶液,2~8℃可以存放数月之久,欲长期保存,可分装冻存于-20℃冰箱中。
Ellman试剂(10 mM):称取0.198 g DTNB,用50 ml pH值7.0的磷酸盐缓冲液溶解,存放于棕色试剂瓶中,4℃储存。
1.1.5 培养基
LB培养基:5%酵母提取物,10%胰蛋白胨,10%NaCl,pH值7.0~7.5。
发酵培养基:羽毛粉 10 g,NaCl 0.5 g,K2HPO40.7 g,KH2PO40.35 g,蒸馏水1 000 ml,pH值7.4~7.6,121℃灭菌20 min。
1.1.6 实验仪器
Cary 100bio紫外/可见分光光度计(美国Varian公司),Neofuge 15R台式告诉冷冻离心机(上海力申科学仪器有限公司),酶标仪,DL-CT-IND-Ⅱ超净工作台(北京东联哈尔仪器制造厂),水浴振荡器(哈尔滨东联电子技术开发有限公司),LS-B35L立式压力蒸汽灭菌器(江苏滨江医疗设备仪器有限公司)。
1.2 实验方法
1.2.1 羽毛粉脱脂处理对蛋白酶水解角蛋白活性的影响
取发酵48 h的CP-16菌发酵液,4℃,12 000 g×15 min,离心分离菌体和上清液。收集到的菌体置于1.5 ml离心管,用pH值9.0的Tris-HCl缓冲液冲洗两次,冰浴,超声破碎5 min(60 W 20 kHz),4 ℃,14 000 r/min 5 min,离心去除细胞碎片,得到胞内液上清。
分别以天然羽毛粉和脱脂羽毛粉为底物,测定CP-16菌发酵液、P-Glu、P-Alk、P-Trx和P-Ker的角蛋白酶活性,比较底物的不同处理对酶活性测定结果的影响。
角蛋白酶活性测定:采用Gradisar[3]所描述的方法为基础,并加以修改。
主要步骤:10 mg羽毛粉与2.0 ml pH值9.0的Tris/HCl(0.05 M)缓冲液混合,加入1.0 ml粗酶液,180 r/min、40℃保温处理1 h,每隔10 min取出用力震荡。反应结束时添加2.0 ml 10%三氯乙酸(TCA)终止反应,静置5 min,10 000 g离心15 min,取出上清液同样条件下二次离心,上清液于280 nm下测定其吸光值,采用保温前添加TCA的反应管作为对照。
酶活定义:pH值9.0、40℃保温60 min条件下,A 280值升高0.01个单位为1 U。
1.2.2 CP-16菌发酵产物脂肪酶活性的测定
分别测定CP-16发酵液上清和胞内液上清的脂肪酶活性,脂肪酶活性测定方法见吴向萍[4],并进行一定修改:采用对硝基苯酚乙酸酯(pNPA)为底物测定脂肪酶活性。底物体系为100 mM pNPA的DMSO溶液。移取100 μl酶液,加入2.87 ml磷酸盐缓冲液,30℃预保温3 min,加入30 μl的底物溶液,使其终浓度为1 mM。在(30±1)℃下孵育15 min后,λ=405 nm下测定对硝基苯酚的吸光度。
酶活定义:每分钟生成1.0 μmol对硝基苯酚所需要的酶量,定义为一个酶活力单位(U)。
1.2.3 添加外源脂肪酶对羽毛角蛋白降解速度的影响
用pH值9.0的Tris/HCl(0.05 M)缓冲液溶解约100 U脂肪酶(Candida antarctica),分别添加到角蛋白底物溶液中,37℃孵育30 min,加入CP-16发酵液上清和P-Ker,以两种羽毛粉为底物测定角蛋白酶活性。
1.2.4 数据处理
结果以平均值±标准差表示,数据处理与分析采用SAS 9.0的GLM程序进行,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 羽毛粉脱脂处理对不同蛋白酶角蛋白酶活性的影响
相同体系下,分别以天然羽毛粉和脱脂羽毛粉为底物,测定地衣芽孢杆菌CP-16发酵液、4种蛋白酶的角蛋白酶活性的结果,见图1。由图1可见,与天然羽毛粉相比,采用脱脂羽毛粉为底物可明显大幅提高蛋白酶水解角蛋白速度。P-Ker具有较强的角蛋白水解能力,其中,CP-16发酵液、P-Alk、P-Ker均提高近1倍,P-Glu和P-Trx提高了约2倍。这说明羽毛脱脂处理,可加快羽毛降解速度。
2.2 CP-16菌发酵产物脂肪酶活性的确定
鉴于脱脂处理可显著提高羽毛角蛋白的水解效率,为进一步探索地衣芽孢杆菌CP-16破坏羽毛脂质的机制,分别对地衣芽孢杆菌CP-16发酵液上清和胞内液的脂肪酶活性进行了测定。结果表明,在发酵液和胞内液均有脂肪酶活性,发酵液活性为6.8 U/ml,胞内液为1.1 U/ml(见表1)。这说明CP-16可通过分泌脂肪酶水解羽毛蜡酯,提高角蛋白降解效率。
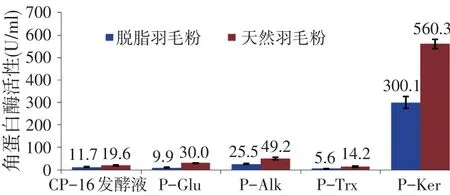
图1 羽毛粉脱脂处理对酶活性的影响

表1 CP-16菌发酵产物的脂肪酶活性
图2 对硝基苯酚标准曲线
2.3 添加外源脂肪酶对羽毛角蛋白降解速度的影响(见表2)

表2 外源脂肪酶对CP-16发酵液和P-Ker羽毛角蛋白降解的影响
由表2可见,以天然羽毛粉为底物时,外源脂肪酶对CP-16发酵液和P-Ker降解羽毛角蛋白的速度有明显的抑制。而以脱脂羽毛粉为底物时,外源脂肪酶对CP-16发酵液和P-Ker降解速度影响无显著作用。
3 讨论
羽毛和羊毛等天然角蛋白表面通常含有一定数量的动物蜡等脂类物质,这些脂质或以油脂和蜡质的形式覆盖在角蛋白表面[5],或与角蛋白形成共价键[6],与角蛋白结合。这种结构使角蛋白疏水性和稳定性增加,难以被蛋白酶水解。在角蛋白降解过程中,如何破坏这些脂类物质对角蛋白的降解也尤为重要。
地衣芽孢杆菌CP-16由齐志国(2012)筛选得到,该菌生长速度快、角蛋白降解效率高,所产角蛋白酶适应性强、水解底物特点突出,具有较好的应用前景。P-Ker为本实验室克隆自地衣芽孢杆菌CP-16角蛋白酶基因,并在大肠杆菌中表达得到,该酶具有较高的角蛋白酶活性。以CP-16菌和产自该菌株的蛋白酶研究羽毛脱脂处理对微生物降解羽毛的影响具有较高的实用价值。
目前关于羽毛结构中脂质的研究较少,主要集中于材料科学领域,脂质对羽毛的润湿性[7]、羊毛的防毡缩性[8]等有一定的影响。在微生物降解角蛋白研究中仅有少数研究认为脂肪酶可能在角蛋白降解中起到作用。Zhang等[9]在角蛋白降解菌弗氏链霉菌发酵液中检测到脂肪酶的活性。Wang等[10]利用角质酶(具有脂肪酶的活性)和两种脂肪酶处理羊毛纤维,使其水解羊毛纤维外层的脂质,再用蛋白酶处理。发现单独利用脂肪酶处理羊毛的湿润性和抗毡缩性菌不如用角质酶处理。任露泉等[11]研究证明羽毛经脱脂后实际接触角下降,空间结构发生变化。El-Sayed等[12]先以脂肪酶处理羊毛,以便去除羊毛纤维表面脂质,再用谷胺甘酞还原酶(GR)/NADPH还原角蛋白内部的二硫键,以便疏松羊毛表面的致密结构,最后用木瓜蛋白酶进行处理,去除羊毛纤维表面的鳞片层。结果表明,经该方法处理后,羊毛防毡缩性较未处理样明显提高。Rahayu等[13]也发现用NaOH溶液预处理羽毛后能显著提高角蛋白酶活性,但NaOH处理不只破坏羽毛表面的脂质,对角蛋白内部结构也有一定的破坏。
本实验中将羽毛经石油醚脱脂处理后发现,各种蛋白酶降解羽毛的速度均有明显提高,最高可提高2倍。这说明脱脂处理可能对羽毛角蛋白表层结构具有破坏作用,利于蛋白酶水解角蛋白。同时,通过对CP-16菌发酵液和胞内液脂肪酶活性的检测,均发现脂肪酶活性,发酵液脂肪酶活性(6 U/ml)高于胞内液(1 U/ml),因此地衣芽孢杆菌CP-16可能存在分泌脂肪酶去水解羽毛中脂质的机制。但添加外源脂肪酶(源自Candida antarctica)能降低CP-16发酵液和P-Ker降解天然羽毛粉的速度,而对降解脱脂羽毛粉速度无影响。这说明不同来源的脂肪酶对羽毛中脂质水解有一定影响,进而影响了CP-16降解羽毛的速度。
4 结语
本实验通过对羽毛进行脱脂处理与天然羽毛对比发现,地衣芽孢杆菌CP-16和该菌产部分蛋白酶降解脱脂羽毛速度明显加快,且在地衣芽孢杆菌CP-16发酵液中发现脂肪酶活性,说明地衣芽孢杆菌CP-16可能存在分泌脂肪酶水解羽毛脂质并促进羽毛降解的机制。

