病毒性心肌炎所致小鼠心力衰竭心肌组织内质网应激相关的凋亡关系的研究*
刘 磊,王洪军,辛 晴,周晓敏,赵亚君,黄 侠,赵 明
(内蒙古民族大学附属医院心内科,通辽028000)
病毒性心肌炎(viral myocarditis,VMC)是由病毒感染引起的心肌实质或间质的局限性或弥漫性病变[1],病毒性心肌炎致使心肌收缩力功能下降引起心力衰竭是病毒性心肌炎患者死亡的重要原因[2]。心力衰竭是指心肌的舒缩功能障碍而导致泵血能力降低,是多种心血管疾病的终末共同通路,死亡率高,是临床上需要解决的问题。以前人们对心力衰竭发病机制的认识停留在心脏疾患引起的心排血量降低,静脉压增高,神经内分泌系统激活及心室重构上。近来研究发现在心脏衰竭心肌组织中存在心肌细胞凋亡,凋亡导致心肌细胞数量减少,从而引起心肌收缩力下降,细胞凋亡可能是心力衰竭发病机制的一个重要环节。细胞凋亡即细胞程序性死亡,这是一种细胞自身基因控制的主动性死亡过程。[3]研究发现细胞凋亡干预是防治心力衰竭的一条的有效途径[4]。凋亡的产生机制复杂,近年发现内质网应激反应(endoplasmic reticulum stress ERS)介导的细胞凋亡是一条新的细胞凋亡信号转导通路[5]。内质网应激反应发生的最重要标志就是内质网应激蛋白的诱导表达,这些蛋白主要包括内质网分子伴侣,如葡萄糖调节蛋白(glucose-regulated protein,GRP)78、GRP94、内质网蛋白 (endoplasmic reticulum protein,ERp29)等,研究病毒性心肌炎小鼠心肌细胞心肌细胞凋亡与内质网应激关系,就要检测病毒性心肌炎小鼠心肌细胞内质网分子伴侣 GRP78、GRP94、ERp29表达与心肌细胞凋亡的关系。本研究通过观察病毒性心肌炎心力衰竭小鼠心肌细胞凋亡状况并与内质网伴侣蛋白GRP78和GRP94表达的关系,明确ERS是否介导了病毒性心肌炎心力衰竭小鼠心肌细胞凋亡。
1 材料与方法
1.1 材料
实验动物:新生 BALB/c小鼠,二级动物,由吉林大学基础医学院实验动物中心提供;CVB3(Nancy株)购自吉林大学农牧学院实验动物中心病毒室,病毒原液效价为10-3TCID50/L;Super M-MLV反转录酶购自 BioTeke,RNA simple Total RNA Kit购自TIANGEN,RNase固相清除剂购自天恩泽,引物由生工生物工程(上海)有限公司合成;In Situ Cell Death Detection Kit购自罗氏,DAB显色液购自Solarbio,Triton X-100购自碧云天。
1.2 病毒性心肌炎BALB/c小鼠模型的制备
选清洁级BALB/c雄性小鼠40只。随机分为病毒性心肌炎组和正常对照组(n=20),病毒性心肌炎组小鼠每只腹腔注射内含100 TCID50 CVB3的MEME agle’s液 0.2 ml。对照组小鼠每只腹腔注射生理盐水0.2 ml。从注射病毒起每日观察小鼠的一般状态,主要观察小鼠的反应,详细记录小鼠饮食、毛色、活动和排泄情况,。
1.3 血流动力学指标的监测
注射病毒第7天,将小鼠用3%戊巴比妥钠15 mg/kg麻醉后仰卧位固定于恒温操作台上,于颈部正中取切口,然后钝性分离右侧颈总动脉,结扎远心端,牵拉阻断近心端,应用30 G注射针头在远心端穿刺动脉,插入右颈总动脉、升主动脉,逆行插入左心室内,通过1.4F微导管经压力换能器连接BL-420多道生理记录仪测量各组小鼠左心室压(left ventricular pressure,LVP)及左心室内压最大变速率(maximal change of ventricular pressure over time,dp/dt)变化,以反映心肌收缩力。
1.4 病理取材及TUNEL检测心肌细胞凋亡
2组分别随机取15只小鼠,进行血流动力学指标的监测后处死,,立即沿腹中线剪开,在无菌状态下将小鼠左肋剪开,暴露心脏,用眼科剪子将心脏取出,取 1/3心脏组织(1)透化:滴加 0.1%Triton X100(0.1%柠檬酸钠盐配置)200μl,室温放置 8 min;(2)PBS漂洗,5 min×3;(3)封闭:滴加 3%H2O2200μl,室温放置 15 min;(4)滴加 TUNEL反应液 50μl;(5)保湿、避光、37℃孵育 60 min;(6)滴加Converter-POD 50μl;(7)保湿、37℃孵育 30 min;(8)DAB显色:加DAB底物50μl,待颜色刚刚变深时迅速置于水中终止反应;(9)苏木素复染:滴加苏木素直至覆盖玻片,浸入1%盐酸乙醇中分化3 s,立即浸入自来水中,流水反蓝20 min。将切片架置于75%、85%、95%的乙醇中,每个停留2 min。依次取出切片,擦干周围液体,胶头滴管滴加半滴中性树胶,盖上盖玻片,室温晾干;(10)显微镜下观察染色效果,×400镜下拍照。
1.5 RT-PCR检测心肌细胞内质网伴侣蛋白GRP78和GRP94的mRNA表达
(1)总RNA提取:利用总RNA提取试剂盒(天根)提取样本总RNA。(2)反转录:将得到的RNA样本进行反转录,具体用量如下:正常对照组样本上样量 2.8μl,病毒性心肌炎组样本上样量 3.4μl;正常对照组 ddH2O使用量 7.7μl,病毒性心肌炎组ddH2O使用量7.1μl。对实验所得的RNA样本进行反转录以得到对应的cDNA。(3)PCR检测:首先将引物稀释至 10μmol/L,引物信息:GRP78-F(5’-3’)CAGCCAACTGTAACAATCAAGRP78-R(5’-3’)CTGTCACTCGGAGAATACCAGRP94-F(5’-3’)TGAAGGCACAAGCATACCAGRP94-R(5’-3’)GACCGAAGTGTTGCCGTTTb-actinF(5’-3’)CTGTGCCC ATCTACGAGGGCTATb-actinR(5’-3’)TTTGATGTCACGCACGATTTCC,在PCR管中加入如下反应体系:cDNA模板1μl,上下游引物各1μl,2×Taq PCR Master-mix 10μl用 ddH2O补足至20μl。扩增条件为:94℃变性5 min后,进行24~32个循环:94℃ 变性1 min,61.5℃复性1 min,72℃延伸1 min;最后72℃延伸10 min结束反应,置于4℃5 min。(4)电泳分析琼脂糖凝胶的配制:PCR产物电泳用1.5%的凝胶,将混合的凝胶液置于微波炉中加热至沸腾,使胶完全融化,放置室温冷却,将凝好的胶及制胶板放入电泳槽中,使电泳缓冲液刚刚浸过胶面,进行点样,然后接通电泳仪电泳,电泳过后利用凝胶成像系统对得到的凝胶进行拍照。
1.6 统计学方法
采用统计软件SPSS 15.0对数据进行检验,两组均数比较用配对 t检验分析。
2 结果
2.1 小鼠的一般情况及病理学改变
正常组小鼠活动正常全部存活,病毒性心肌炎组小鼠在注射CVB3后出现竖毛、蜷缩、不喜进食、活动减少等体征,注射CVB3后3天起,病毒性心肌炎组小鼠开始出现死亡,至5~7 d病死率达到高峰。心脏大体改变:正常组小鼠心脏外观无明显改变。病毒性心肌炎组病变严重,外观心肌呈淡黄色、质地较软、呈松弛扩张状态状态,与正常对照组小鼠相比心脏扩大,心脏表面有白斑或出血斑,心外膜下淤血。光镜观察:HE染色结果:对照组小鼠心肌纤维排列整齐,结构清晰,细胞核呈圆形或椭圆形,位于细胞中央,未见心肌纤维变性坏死等病理性改变。病毒性心肌炎模型组病理改变明显,可见心肌纤维排列紊乱,心肌细胞坏死和间质炎性细胞浸润,间质明显水肿(图1)。

Fig.1 Pathological changes(HE×200)
2.2 BALB/c小鼠病毒性心肌炎心脏血流动力学改变
正常对照组小鼠与病毒性心肌炎模型小鼠心脏的血流动力学参数指标情况见表1,可见反应病毒性心肌炎模型组小鼠心肌收缩力指标LVP和dp/dt与正常对照组相比,差异有显著性。(P<0.05),而正常对照组小鼠与病毒性心肌炎模型小鼠心功能指标组内观察结果无显著差异。
Tab.1 Changes in cardiac hemodynamic parameters in mice(n=15,)
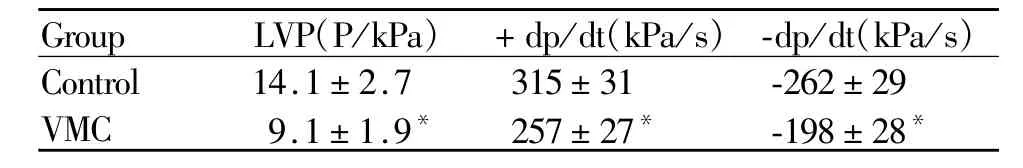
Tab.1 Changes in cardiac hemodynamic parameters in mice(n=15,)
LVP:Left ventricular pressure;dp/dt:Maximal change of ventricular pressure over time*P<0.05 vs control
Group LVP(P/kPa) +dp/dt(kPa/s) -dp/dt(kPa/s )Control 14.1±2.7 315±31 -262±29 VMC 9.1±1.9* 257±27* -198±28*
2.3 TUNEL法原位检测心肌细胞凋亡
用TUNEL法检测病毒性心肌炎组小鼠心肌细胞凋亡,发现凋亡细胞的胞核呈红色颗粒状,多分布在心内膜、心外膜下及炎症灶周围(图2)。凋亡对照组小鼠仅有少量凋亡的细胞(AI=4.47±1.41),病毒性心肌炎组小鼠心肌细胞(AI=35.31±7.15)较正常对照组明显增加(P<0.01)。

Fig.2 Myocardial cell apoptosis
2.4 病毒性心肌炎小鼠心肌细胞内质网伴侣蛋白GRP78和GRP94的mRNA表达
与对照组相比较,病毒性心肌炎小鼠心肌细胞内质网伴侣蛋白GRP78和GRP94的mRNA表达水平均明显高于对照组(P<0.01,图 3,表 2、表 3)。

Fig.3 Endoplasmic reticulum chaperone GRP78 and GRP94 mRNA expression in myocardial cells of mice with viral myocarditis

Tab.2 Endoplasmic reticulum chaperone GRP78 mRNA expres-
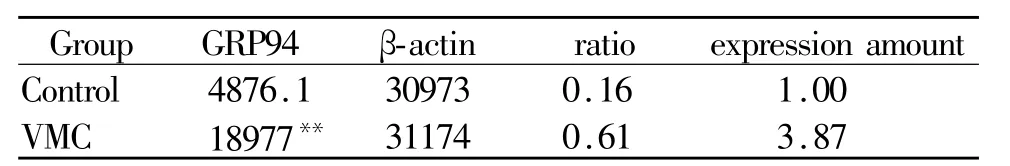
Tab.3 Endoplasmic reticulum chaperone GRP94 mRNA expression in myocardial cells of mice with viral myocarditis
3 讨论
大量证据表明,在多种心脏疾病中,心肌细胞凋亡可以引发心力衰竭。因此了解心肌细胞凋亡过程及凋亡信号途径,并阻断凋亡的信号途径,可以增强细胞抵御凋亡能力,就能够减少心肌细胞凋亡,从而延缓心力衰竭的进程,在心脏疾病中减少心肌细胞凋亡可能是一种心力衰竭新的治疗途径。凋亡的产生机制复杂,近年发现内质网应激反应介导的细胞凋亡是一条新的细胞凋亡信号转导通路.内质网(endoplasmic reticulum,ER)在心肌等肌细胞内称肌浆网,主要参与膜蛋白和分泌蛋白修饰和折叠[6]。沿肌原纤维排列,并通过T管与心肌细胞膜联系。心肌细胞的肌浆网主要由包绕肌丝的网状纵形小管(longitudinal SR,L-SR)、参与形成三联管的终末池(junctional SR,J-SR)和位于肌节Ⅰ带的特化非终末池(specialized nonjunctional,SR)3部分组成[7]。内质网对外界环境变化较敏感,各种应激反应引起的代谢异常、蛋白质糖基化抑制、二硫键形成障碍等原因均可引起蛋白错误折叠以及未折叠蛋白在内质网腔内聚集,破坏内质网稳态,引发内质网应激(ERS)[8]。内质网应激发生后,内质网通过上调分子伴侣蛋白GRP78及GRP94表达、抑制蛋白质合成、加速错误折叠和未折叠蛋白质降解等方式缓解ERS。然而持续或较严重的ERS则触发凋亡信号,诱导CHOP、caspase-12、JNK等促凋亡因子的表达及活化,导致细胞凋亡[9]。研究文献报道:内质网应激反应可能对于诱导病毒性心肌炎的心肌细胞凋亡有一定作用[10]。
本研究发现病毒性心肌炎组小鼠血流动力学指标明显降低;病毒性心肌炎心力衰竭小鼠心肌组织凋亡明显增多;病毒性心肌炎组小鼠内质网伴侣蛋白GRP78和GRP94的mRNA表达水平均明显增高。上述实验结果提示病毒性心肌炎心力衰竭小鼠内质网应激可能介导了心肌细胞凋亡。这为我们研究病毒性心肌炎并发心力衰竭的发生机制提供了新的思路,以及未来对于病毒性心肌炎并发心力衰竭的有效治疗,具有积极的意义。
[1] Bergelson JM,Modlin JF,Wieland-Alter W,et al.Clinical coxsackievirus B isolates differ from laboratory strains in their interaction with two cell surface receptors[J].J Infect Dis,1997,175(3):697-700
[2] 刘玉清,李 佳,张禅那,等.病毒性心肌炎细胞感染模型的建立及实验研究[J].中国分子心脏病学杂志,2002,8(2):25-29.
[3] 王红英,曹雪滨.心力衰竭与心肌细胞凋亡的研究进展[J].医学综述,2008,14(18):2727-2729.
[4] 沈明志,刘佳妮,翟雅莉,等.衣霉素诱导大鼠心肌细胞内质网应激凋亡模型的构建[J].现代生物医学进展,2011,11(5):1079-1083.
[5] 陈 鹏,杨成明,曾春雨,等.心肌梗死后心力衰竭小鼠心肌组织内质网应激相关凋亡途径的研究[J].中国病理生理杂志,2010,26(6):1069-1074.
[6] 刘 蜜.内质网应激与心血管疾病[J].国际病理科学与临床杂志,2011,31(4):305-309.
[7] 刘秀华.心力衰竭的内质网应激机制[J].中国医学前沿杂志,2010,2(1):6-11.
[8] 刘 颖,纪 超,吴伟康.附子多糖保护缺氧/复氧乳鼠心肌细胞及其抗内质网应激机制研究[J].中国病理生理学杂志,2012,28(3):459-463.
[9] 路晓庆,边云飞,李茂莲,等.β受体阻滞剂对乳鼠心肌细胞内质网应激致凋亡途径的影响[J].中国药物与临床,2010,10(6):641-644.
[10]刘唐威,王秋雁,伍伟锋.内质网伴侣蛋白在小鼠病毒性心肌炎心肌细胞的表达及其与细胞凋亡的关系[J].广西医科大学学报,2005,22(2):157-159.

