粪便标本中SFRP1和WIF-1基因启动子甲基化在大肠癌早期筛查中的意义
张 虎,张 平,江 军,李素迎,袁 林,齐 健,朱尤庆
(1武警湖北省总队医院,武汉430060;2武汉大学中南医院;3湖北省肠病医学临床研究中心、湖北省肠病重点实验室)
大肠癌(CRC)是胃肠道常见的恶性肿瘤,早期发现、早期诊断是降低CRC发病率、提高生存率的有效手段。目前常见的CRC筛查方式包括粪便潜血试验、电子结肠镜、仿真结肠镜检查等,这些检查存在敏感性和特异性低、需要严格的肠道准备导致患者依从性差、对早期CRC的检出率低等缺陷。表观遗传调控机制是一种可遗传的基因功能调控方式,DNA异常甲基化的改变是表观遗传修饰的主要方式之一。我们的前期研究显示,SFRP家族基因启动子甲基化在早期CRC组织中具有高频甲基化。
本研究通过检测CRC和大肠良性病变患者粪便标本中SFRP1和WIF-1基因启动子的甲基化状况,探讨二者作为CRC筛选标志物的可行性。
1 资料与方法
1.1 临床资料 选择2012年3月~2013年3月武汉大学中南医院住院患者145例,其中CRC 48例,男24例、女24例,年龄19~86岁、平均61.1岁;大肠腺瘤35例,男23例、女12例,年龄25~74岁、平均56.3岁;大肠增生性息肉32例,男17例、女15例,年龄31~79岁、平均54.4岁。均经术后病理或内镜活检病理证实。入选标准:无家族CRC及大肠息肉病史;收集粪便前5 d内未进行结肠镜检查、灌肠等侵入性操作;CRC患者未行术前放化疗。另选择30例性别、年龄匹配的健康人作为对照组,全结肠镜检查均为阴性。
1.2 方法
1.2.1 粪便样本采集 收集受试者术前或肠镜检查前自然排出的新鲜粪便样本,-80℃保存待测。
1.2.2 DNA提取 称取 200 mg粪便,使用QIAamp粪便DNA提取试剂盒(Qiagen公司,德国)提取DNA。引物序列由上海生工生物工程公司合成。上游引物:5'-TGGTGATGGAGGAGGCTCAGCAAGT-3',下游引物:5'-AGCCAATGGGACCTGCTCCTCCCTTGA-3',扩增产物长度 133 bp。25 μL PCR反应体系:上下游引物各 1 μmol/L、模板 2 μL、PCR Mix 12 μL、双蒸水 9 μL。PCR 反应条件:94 ℃ 3 min,94℃、62℃、72℃各30 s,35个循环;72 ℃延伸7 min。取5 μL PCR产物行3%琼脂糖凝胶电泳,凝胶成像系统观察并保存结果。
1.2.3 甲基化特异性PCR DNA的亚硫酸氢钠修饰及纯化回收主要根据文献[1]方法,并加以改进。修饰后DNA分别用各基因的甲基化、非甲基化引物扩增。引物序列由上海生工生物工程公司合成。SFRP1甲基化引物:上游引物:5'-TGTAGTTTTCGGAGTTAGTGTCGCGC-3',下 游 引 物:5'-CCTACGATCGAAAACGACGCGAACG-3',扩增产物长度126 bp;SFRP1非甲基化引物:上游引物:5'-GTTTTGTAGTTTTTGGAGTTAGTGTTGTGT-3',下游引物:5'-CTCAACCTACAATCAAAAACAACACAAACA-3',扩增产物长度135 bp。WIF-1甲基化引物:上游引物:5'-GGGCGTTTTATTGGGCGTAT-3',下游引物:5'-AAACCAACAATCAACGAAC-3',扩增产物长度197 bp;WIF-1非甲基化引物:上游引物:5'-GGGTGTTTTATTGGGTGTAT-3',下游引物:5'-AAACCAACAATCAACAAAAC-3',扩增产物长度198 bp。PCR反应体系 25 μL:模板 DNA 2 μL、5 μmol/L 上下游引物各 1 μL、Mg2+1.5 mmol/L、10 mmol/L、dNTPs 2 μL、Taq酶1 U。PCR反应条件:95℃ 5 min,95℃、各基因的退火温度、72℃各45 s,38个循环;72℃延伸8 min。反应产物于3%琼脂糖凝胶电泳,溴化乙锭染色检测产物,凝胶成像系统照相并分析。
1.2.4 统计学方法 采用SPSS17.0统计软件,数据的比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组粪便中SFRP1和WIF-1基因启动子甲基化状态 见表1。SFRP1和WIF-1联合检测CRC和大肠腺瘤的敏感性分别为77.1%和65.7%,特异性为93.3%。SFRP1和WIF-1基因启动子甲基化在CRC组和腺瘤组间无统计学差异(P>0.05),而在CRC组和增生性息肉组、CRC组和对照组、腺瘤组和增生性息肉组、腺瘤组和对照组比较均有统计学差异(P均 <0.05)。增生性息肉组和对照组SFRP1基因甲基化有统计学差异(P<0.05),WIF-1基因甲基化无统计学意义(P>0.05)。
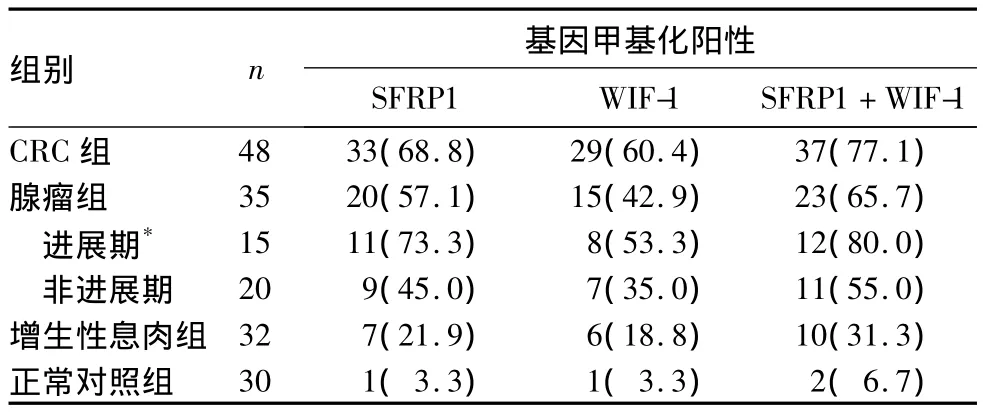
表1 各组SFRP1和WIF-1基因甲基化阳性率[例(%)]
2.2 联合检测SFRP1和WIF-1基因甲基化对大肠腺瘤的诊断 腺瘤组粪便中SFRP1和WIF-1基因甲基化阳性率分别为57.1%和42.9%,进展期腺瘤明显高于非进展期腺瘤。SFRP1和WIF-1基因启动子甲基化在进展期腺瘤和增生性息肉间有统计学差异(P<0.01);而非进展期腺瘤和增生性息肉间无统计学差异(P>0.05)。联合两种基因对CRC和进展期腺瘤的检测率分别为77.1%和80.0%。
2.3 CRC粪便中SFRP1和WIF-1基因甲基化状态与临床病理特征的关系 CRC粪便DNA中SFRP1和WIF-1基因启动子甲基化与患者的性别、年龄、肿瘤部位、Duke分期、淋巴转移及远处转移均无相关性(P均>0.05)。见表2。

表2 粪便SFRP1和WIF1基因甲基化与CRC临床病理特征的关系
3 讨论
CRC的发生、发展是一个多因素、多阶段、多步骤渐进演化的过程,涉及遗传性改变和表观遗传的异常[2]。肿瘤抑制基因的表观沉默是肿瘤发生的一个重要机制。正常情况下,大肠上皮细胞会持续释放到肠腔内,并随粪便排出体外,整个肠黏膜4 d内更新1次[3]。大肠恶性瘤细胞脱落速度是正常细胞的4~5倍[4],由于肿瘤细胞更新速度快,黏附力差,很容易在粪便中检测到与CRC相关的分子标志物。因此粪便异常基因甲基化在大肠肿瘤早期筛查诊断中具有重要的临床价值。
Wnt途径在细胞的增殖和分化等生理过程中起重要作用,同时参与肿瘤形成的异常调控途径。Wnt途径异常激活促进瘤细胞增殖,抑制凋亡[5],与多种人类肿瘤相关,如头颈部肿瘤、乳腺癌、膀胱癌、白血病等,大肠肿瘤尤其常见[6~10]。SFRP 家族、WIF-1是Wnt途径Ⅰ类胞外拮抗物,能通过不同的机制直接与Wnt反应,或与Frizzled受体形成无作用的复合体,抑制 Wnt途径[11]。正常情况下,Wnt拮抗基因的表达能有效地抑制Wnt途径的激活。
本研究显示,增生性息肉、腺瘤和CRC患者,粪便SFRP1基因启动子甲基化的阳性率分别为21.9%、57.1%和 68.8%,而 WIF-1 基因甲基化的阳性率分别为18.8%、42.9%和60.4%。SFRP1和WIF-1基因甲基化在增生性息肉、腺瘤和CRC的发生频率逐渐增高,提示它们可能是正常大肠黏膜发生恶性转化的基础。我们前期的研究也显示,SFRP家族、WIF-1基因在大肠肿瘤早期存在高频率甲基化[9]。
据统计,仅6%的腺瘤会转变为腺癌。本研究显示,粪便中SFRP1和WIF-1基因甲基化对于进展期腺瘤的检测率明显高于非进展期腺瘤,进展期腺瘤中联合SFRP1和WIF-1基因的甲基化频率为80.0%,明显高于非进展期腺瘤的55.0%,说明进展期腺瘤组织有恶变趋势。表明SFRP1和WIF-1基因甲基化是CRC的一个频繁的早期事件,且在CRC演变过程中通过腺瘤致癌的转化而增加,二者联合对进展期腺瘤的检测率达73.3%。经典的腺瘤—腺癌途径大概需要5~10年的时间,因此在CRC的早期筛查中有充分的时间可以检测并去除这些高危病变,对可疑病例行结肠镜检查并治疗,从而降低CRC的发生率。
本研究中,对照组SFRP1和WIF-1基因异常甲基化各出现1例,此结果可能是由于SFRP1和WIF-1异常甲基化频繁出现在癌前隐窝病灶,且病变较小,而内镜下未能发现。因此,粪便中 SFRP1和WIF-1基因异常甲基化的患者属于CRC的危险人群,需要长期跟踪随访。本研究尚未发现粪便中基因甲基化状态的改变与大肠肿瘤的临床病理特征有相关性,表明这些标记物在近端、远端大肠肿瘤的检测中具有同等的检测效率。近年来,右半结肠肿瘤的发生率逐年增加[12],粪便SFRP1和WIF-1甲基化在早期筛查右半结肠癌方面具有重要作用。
综上所述,粪便SFRP1和WIF-1基因启动子甲基化有可能成为大肠肿瘤早期诊断的生物学标志,有望成为CRC早期无创诊断或高风险人群筛选的一种新型途径。
[1]Herman JG,Graff JR,Myohanen S,et al.Methylation-specific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci U S A,1996,93(18):9821-9826.
[2]D'Alessio AC,Szyf M.Epigenetic tete-a-tete:the bilateral relationship between chromatin modifications and DNA methylation[J].Biochem Cell Biol,2006,84(4):463-476.
[3]Itzkowitz S,Brand R,Jandorf L,et al.A simplified,noninvasive stool DNA test for colorectal cancer detection[J].Am J Gastroenterol,2008,103(11):2862-2870.
[4]Davies RJ,Miller R,Coleman N.Colorectal cancer screening:prospects for molecular stool analysis[J].Nat Rev Cancer,2005,5(3):199-209.
[5]Fodde R,Smits R,Clevers H.APC,signal transduction and genetic instability in colorectal cancer[J].Nat Rev Cancer,2001,1(1):55-67.
[6]Fendri A,Khabir A,Hadri-Guiga B,et al.Epigenetic alteration of the Wnt inhibitory factor-1 promoter is common and occurs in advanced stage of Tunisian nasopharyngeal carcinoma[J].Cancer Invest,2010,28(9):896-903.
[7]Wissmann C,Wild PJ,Kaiser S,et al.WIF1,a component of the Wnt pathway,is down-regulated in prostate,breast,lung,and bladder cancer[J].J Pathol,2003,201(2):204-212.
[8]Voorham QJ,Janssen J,Tijssen M,et al.Promoter methylation of Wnt-antagonists in polypoid and nonpolypoid colorectal adenomas[J].BMC Cancer,2013,13:603.
[9]Qi J,Zhu YQ,Luo J,et al.Hypermethylation and expression regulation of secreted frizzled-related protein genes in colorectal tumor[J].World J Gastroenterol,2006,12(44):7113-7117.
[10]裴磊,叶丽平.Wnt抑制因子SFRP基因甲基化与白血病的关系[J].山东医药,2011,51(33):109-111.
[11]Kawano Y,Kypta R.Secreted antagonists of the Wnt signalling pathway[J].J Cell Sci,2003,116(Pt 13):2627-2634.
[12]Ahlquist DA,Zou H,Domanico M,et al.Next-generation stool DNA test accurately detects colorectal cancer and large adenomas[J].Gastroenterology,2012,142(2):248-256,e25-e26.

