瑞士乳杆菌MB2-1胞外多糖发酵条件优化
纪 鹃,李 伟,陈晓红,姜 梅,芮 昕,董明盛*
(南京农业大学食品科技学院,江苏 南京 210095)
瑞士乳杆菌MB2-1胞外多糖发酵条件优化
纪 鹃,李 伟,陈晓红,姜 梅,芮 昕,董明盛*
(南京农业大学食品科技学院,江苏 南京 210095)
对1株分离自新疆赛里木酸奶中的瑞士乳杆菌(Lactobacillus helveticus MB2-1)胞外多糖(exopolysaccharide,EPS)的发酵条件进行优化。利用单因素试验确定发酵温度、乳糖添加量、氮源种类及添加量、无机盐种类及添加量对其EPS产量的影响。采用Box-Behnken法对其中的三因素三水平进行响应面分析以确定其最优工艺条件。结果表明:L. helveticus MB2-1 EPS提取的最佳条件为发酵温度37 ℃、Mg2+添加量为质量浓度0.2 g/100 mL、大豆蛋白胨添加量为质量浓度2 g/100 mL,在此工艺条件下,L. helveticus MB2-1 EPS的产量达到801.2 mg/L。
瑞士乳杆菌;胞外多糖;发酵;响应面法
乳酸菌胞外多糖(exopolysaccharides,EPS)是指链球菌属、乳杆菌属、乳球菌属、双歧杆菌属、明串珠菌属等乳酸菌在生长代谢过程中分泌到细胞壁外的黏液或荚膜多糖的总 称[1-2]。据报道,EPS具有多种功能特性,例如在物理化学特性方面,EPS可以作为食品添加剂的替代品,具有改善食品的质构、稳定性、流变性及口感等功效;在酸奶的应用中,EPS可以改变酸奶的外观和口感,并可以控制酸奶的收缩脱水现象,防止酸奶中乳清的析出[3];在生理功能特性方面,EPS具有免疫调节、抗氧化、降血糖、抗肿瘤、降胆固醇以及改善人体胃肠道等功能[4],使其在制药领域有着广阔的应用前景。
EPS的产量受诸多因素影响,除与菌种的遗传特性(控制多糖基因产生的酶系种类和活性)有关[5],菌株培养基的营养成分和环境条件也会影响乳酸菌EPS的合成,且在不同营养条件和培养条件下合成的EPS的种类也不同[6]。研究表明,培养基成分主要包括碳源、氮源、碳氮比、金属离子及无机盐等,环境条件包括培养基初始pH值、接种量、发酵温度和时间等,通过优化这些发酵条件均能显著提高EPS的产量[7-9]。目前,已有研究发现瑞士乳杆菌(Lactobacillus helveticus)MB2-1在发酵乳制品中具有高产黏和酸化的特性[10],且分泌产生的荚膜多糖具有较好的抗氧化能力[11]。为了提高瑞士乳杆菌MB2-1 EPS的产量,本实验利用单因素试验筛选了4种因素,即发酵温度、乳糖添加量、氮源和无机盐,采用Box-Behnken设计对发酵温度、Mg2+添加量和大豆蛋白胨添加量的组合进行优化,进一步确定促进瑞士乳杆菌MB2-1 EPS产量的最优条件,为以后更加深入研究EPS的特性以及生理功能等方面提供良好的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
高产黏瑞士乳杆菌MB2-1从新疆拜城县传统赛里木酸奶中分离得到,由南京农业大学食品微生物实验室提供。
低蛋白乳清粉培养基(乳糖质量浓度为64 g/L):质量浓度为120 g/L和80 g/L的乳清培养基,108 ℃灭菌15 min。
1.1.2 试剂
低蛋白乳清粉 荷兰DV营养公司;葡萄糖、乳糖、MnCl2·4H2O、MgSO4·7H2O、CaCl2·4H2O、KCl、大豆蛋白胨、酪蛋白胨、胰蛋白胨、蛋白胨、三氯乙酸、乙醇(95%)、浓硫酸和苯酚(6%)均为国产分析纯试剂;MD34透析袋(截留分子质量8 000~14 000 D) 北京索莱宝科技有限公司。
1.2 仪器与设备
AUY120岛津分析天平、UV-2450型紫外分光光度计 日本Shimadzu公司;SL-N电子天平 上海民桥精密科学仪器有限公司;手提式压力蒸汽灭菌锅 上海三申医疗器械有限公司;Air Tech超净工作台 苏净集团安泰公司;LRH系列生化培养箱 上海一恒科技有限公司;Avanti J-E冷冻离心机 美国Beckman Coulter公司;722可见分光光度计 上海精密科学仪器有限公司;AIPHAPPHOT-2 YS2光学显微镜 日本Nikon公司;Hei-VAP Advantage(HL)旋转蒸发仪 德国Heidolph公司。
1.3 方法
1.3.1 菌种活化及发酵液制备
菌种活化:活化时采用质量浓度为120 g/L的乳清培养基,从甘油管中接种瑞士乳杆菌MB2-1进行活化,接种量为体积分数4%,活化两次,37 ℃条件下恒温培养12 h。
发酵液制备:发酵时采用质量浓度为80 g/L的乳清培养基,接种量为体积分数4%,培养24 h得到发酵液。
1.3.2 瑞士乳杆菌MB2-1 EPS的提取
将发酵液离心(15 min、12 000×g、4 ℃),除去菌体和杂质;上清液添加质量浓度为80 g/100 mL的三氯乙酸至终质量浓度4 g/100 mL,静置4~8 h,离心(15 min、12 000 r/min、4 ℃)除去沉淀蛋白;上清液中加入无水乙醇至终体积分数75%,4 ℃静置12 h,离心去沉淀,去离子水溶解,离心去沉淀;上清液去离子水透析3 d,每8~10 h换水一次,收集透析液。
1.3.3 EPS产量的测定
以葡萄糖为标准品,采用硫酸-苯酚法[12]测定EPS的含量。
葡萄糖标准曲线的制作:将0.1 mg/mL的标准葡萄糖溶液0、50、100、150、200、250、300 μL分别置于8个同等规格的玻璃试管中,加水补足至500 μL。然后分别加入500 μL的蒸馏水、质量分数6%的苯酚500 μL和浓硫酸2.5 mL,振荡摇匀,室温放置20 min后,采用紫外-可见分光光度计于490 nm波长处测定吸光度。以葡萄糖标准品的质量浓度作横坐标,吸光度作纵坐标绘制标准曲线,并得出回归方程。取0.5 mL多糖溶液(质量浓度为1 mg/mL)于试管中,替代标准品溶液,后续操作一样,平行3次,测定每个样品吸光度,并取平均值。葡萄糖标准曲线回归方程为y =12.996x+0.005 5(R2= 0.998 4),在葡萄糖质量浓度0~0.06 mg/mL范围内线性关系良好。
EPS产量的测定:收集透析液测定终体积,然后全部定容至20 mL,混合均匀并计算稀释度;取其中500 μL,加入500 μL的蒸馏水、6%的苯酚500 μL和浓硫酸2.5 mL,振荡摇匀,室温放置20 min后测定吸光度A490nm值;最后换算至原透析液中EPS的浓度。
1.3.4 瑞士乳杆菌MB2-1 EPS单因素试验设计
测定不同发酵温度、乳糖添加量、氮源种类及添加量、无机盐种类及添加量对菌种EPS产量的影响。
1.3.4.1 发酵温度对EPS产量的影响
以发酵反应时间为24 h,设计发酵温度分别为31、34、37、40、43 ℃,按1.3.2节进行操作,以发酵完成后离心透析得到的EPS含量作为指标,研究发酵温度对EPS产量的影响。
1.3.4.2 乳糖添加量对EPS产量的影响
以低蛋白乳清粉培养基(乳糖质量浓度为64 g/L)为基础培养基,分别添加质量浓度为16、32、48、64 g/L的乳糖,接入4%活化2代的瑞士乳杆菌MB2-1培养液,37 ℃条件下恒温培养24 h,测定发酵液中EPS的含量,研究乳糖添加量对EPS产量的影响。
1.3.4.3 氮源种类与添加量对EPS产量的影响
以低蛋白乳清粉培养基为基础培养基,分别添加质量浓度1 g/100 mL的大豆蛋白胨、酪蛋白、胰蛋白和蛋白胨,接入4%活化2代的瑞士乳杆菌MB2-1培养液,37 ℃条件下恒温培养24 h,测定发酵液中EPS的含量,研究氮源种类对EPS产量的影响。
在上述实验结果的基础上,以低蛋白乳清粉为基础培养基,分别添加质量浓度0.3、0.6、1、2、3 g/100 mL的大豆蛋白胨,接入4%活化2代的瑞士乳杆菌MB2-1培养液,37 ℃条件下恒温培养24 h,测定发酵液中EPS的含量,研究大豆蛋白胨添加量对EPS产量的影响。
1.3.4.4 无机盐种类及添加量对EPS产量的影响
以低蛋白乳清粉培养基为基础培养基,分别添加质量浓度0.3 g/100 mL的MnCl2·4H2O、MgSO4·7H2O、CaCl2·4H2O和KCl,接入4%活化2代的瑞士乳杆菌MB2-1培养液,37 ℃条件下培养24 h,测定发酵液中EPS的含量,研究无机盐种类对EPS产量的影响。
在上述实验结果的基础上,以低蛋白乳清粉为基础培养基,分别添加质量浓度0.1、0.2、0.3、0.4、0.5 g/100 mL的MgSO4·7H2O,接入4%活化2代的瑞士乳杆菌MB2-1培养液,37 ℃条件下培养24 h,测定发酵液中EPS的含量,研究Mg2+添加量对EPS产量的影响。
1.3.5 瑞士乳杆菌MB2-1 EPS响应面优化试验
在单因素试验的基础上,根据Box-Behnken设计原理,进行三因素三水平的响应面分析试验,以发酵温度、Mg2+添加量和大豆蛋白胨添加量为自变量,EPS产量为响应值,确定各因素对EPS产量的显著性影响及各反应条件的最佳组合。
1.4 统计方法
单因素试验设计中每项因素试验重复3次,数据结果使用SPSS 13.0软件对其进行方差分析(One-Way ANOVA),并使用Excel软件进行图表绘制。
响应面优化试验使用Design Expert(Version 8.0.6)软件进行试验设计、数据分析和模型建立。决定系数R2值的大小用来评估回归模型的拟合度,该值越靠近1表明回归方程的拟合度越好;回归系数和回归模型的显著性均由F值来检测,P值选取0.05和0.01两个不同的显著水平。
2 结果与分析
2.1 菌体形态

图1 瑞士乳杆菌MB2-1菌体形态(10×100)Fig.1 Morphology of L. helveticus MB2-1 (10 × 100)
由图1可知,菌体呈链状,革兰氏阳性,菌落直径在MRS琼脂培养基培养48 h达2~3 mm,白色不透明,边缘不整齐,呈扁平状;菌株在乳清培养基中发酵24 h能观察到明显的拉丝现象,且培养基有着极高的黏度。
2.2 发酵温度对EPS产量的影响
培养温度是影响EPS生成的一个重要因素。不同温度下EPS的产量如图2所示,当温度在31~37 ℃范围内,EPS产量随着温度的升高而增大;温度为37 ℃时,EPS产量达到最高(0.339 g/L);当温度在37~43 ℃范围内时,EPS产量随温度的升高而降低。且瑞士乳杆菌最适生长温度为40 ℃左右,此结果与前人报道一致,即微生物EPS产生的最适温度一般低于细菌生长的最适温度。Gassem等[13]认为,微生物EPS属于菌体的次级代谢产物,一般于对数生长的末期和稳定期生成,因此低温将导致菌体生长缓慢,延长其生长对数期和稳定期,从而有利于EPS产量的提高。Kojic等[14]认为,低温下菌体生长速度慢,细胞壁的合成也相应缓慢,从而使更多的磷酸异戊二烯用于EPS的产生。

图2 培养温度对EPS产量的影响Fig.2 Effect of culture temperature on the yield of EPS
2.3 乳糖添加量对EPS产量的影响
一般来说,碳源对于乳酸菌EPS的产量有很大的影响,是细胞生长最重要的能量和营养来源[15-16]。本研究采用的基础培养基为低蛋白乳清粉培养基,乳糖作为培养基中唯一的碳源,其含量为64 g/L。在不添加其余碳源种类的情况下,研究增加乳糖量对EPS产量的影响,结果如图3所示。当乳糖添加量在0~16 g/L时,EPS产量随着乳糖的添加而增大,且在16 g/L时达到最高值(0.459 g/L);但再随着乳糖量的增加,EPS产量反而降低,在质量浓度为32 g/L时EPS产量减至最小并逐渐趋于平稳,表明高质量浓度的乳糖对EPS产量的影响不大。
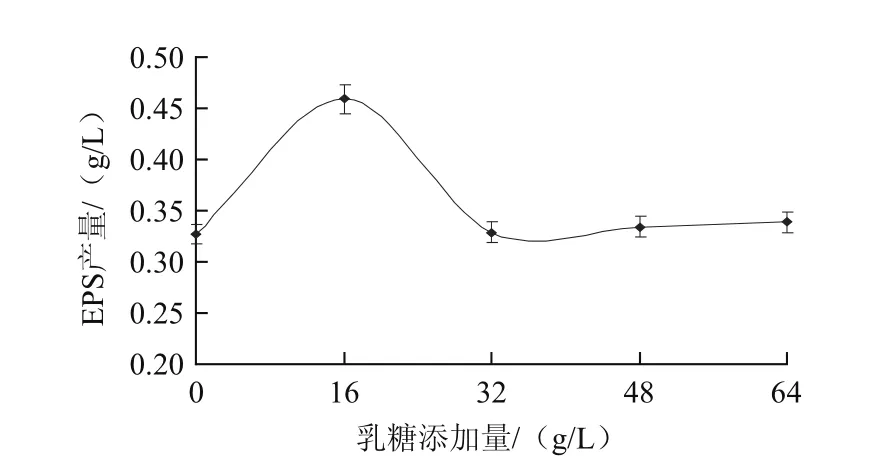
图3 乳糖添加量对EPS产量的影响Fig.3 Effect of lactose concentration on the yield of EPS
2.4 氮源与添加量对EPS产量的影响
氮源是乳酸菌合成EPS所必需的养分,不同的氮源和适量的添加量对菌体分泌EPS均有一定的影响[17-18]。有机氮源含有丰富的蛋白质、氨基酸和维生素等,本研究选择的有机态氮源有大豆蛋白胨、酪蛋白、胰蛋白和蛋白胨,添加量均为质量浓度1 g/100 mL,比较各成分对EPS产量的影响,结果如图4所示。

图4 氮源对EPS产量的影响Fig.4 Effect of nitrogen source on the yield of EPS
由图4可知,大豆蛋白胨对EPS的合成最有利,产量达到0.533 g/L,较无添加的提高58.63%,故选择大豆蛋白胨作为氮源。另外,酪蛋白的添加不仅未提高EPS的产量,反而降低了产量,说明酪蛋白对瑞士乳杆菌MB2-1分泌EPS有一定的抑制作用。
在确定培养基中乳糖的添加量为16 g/L,氮源为大豆蛋白胨的情况下,为获得更高的EPS产量,需调节培养基中乳糖与大豆蛋白胨添加的比例,故研究大豆蛋白胨的添加量,结果如图5所示。
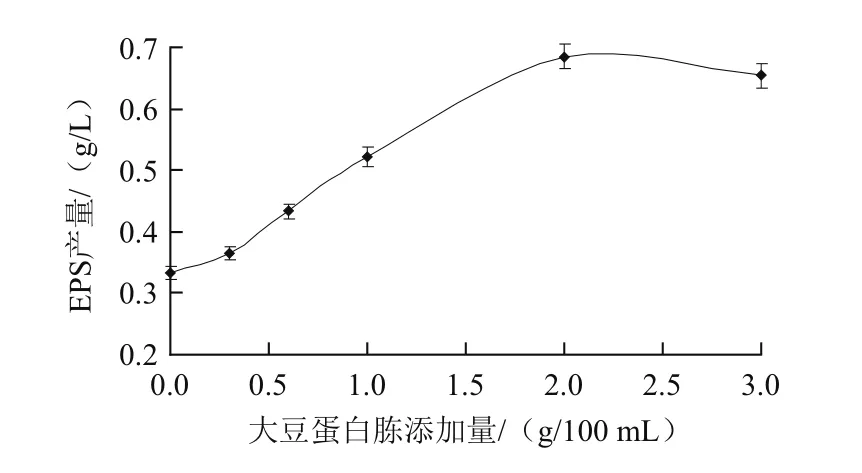
图5 大豆蛋白胨添加量对EPS产量的影响Fig.5 Effect of soybean peptone concentration on the yield of EPS
由图5可知,在质量浓度为0~2 g/100 mL范围内,随着大豆蛋白胨添加量的增加,菌株合成EPS的量也随着增加,当大豆蛋白胨的添加量为2 g/100 mL时,其产量达到最高(0.685 g/L);当继续增加大豆蛋白胨的量(2~3 g/100 mL范围内),EPS的产量反而随着减小,因此最终选择质量浓度2 g/100 mL为最适大豆蛋白胨的添加量。
2.5 无机盐对EPS产量的影响
根据文献报道,选取4种盐类添加到培养基中,由图6可知,添加Mg2+可以提高EPS产量,达到0.479 g/L,相比未添加的提高了48.3%。
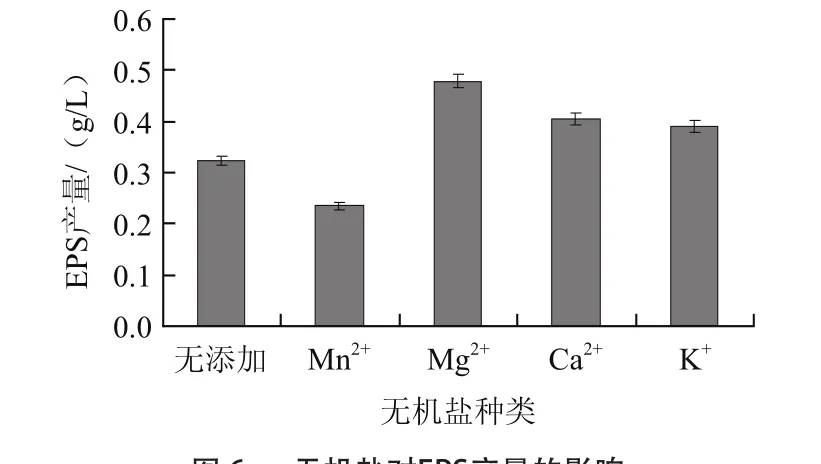
图6 无机盐对EPS产量的影响Fig.6 Effect of mineral source on the yield of EPS
无机盐离子对乳酸菌EPS的合成有着重要影响,与菌体内EPS合成酶系转录和翻译的调节有关,或是能够激活某些酶类。研究表明,影响EPS合成的酶一般为糖原水解酶类,该酶类含有2个组分,分别为α-葡萄糖苷酶和β-葡萄糖醛酸糖苷酶;α-葡萄糖苷酶在Na+、K+、Ca2+、Mg2+作用下活性有所提高,而Mn2+则会抑制α-葡萄糖苷酶和β-葡萄糖醛酸糖苷酶的活性[19]。Mg2+可以促进瑞士乳杆菌MB2-1 EPS的产量,而Mn2+的添加会减低EPS产量。
在上述结果的基础上,还需将无机盐离子的质量浓度控制在一定的范围内,以保证乳酸菌处于最适合成EPS的环境中。如图7所示,当Mg2+的添加量在0~0.2 g/100 mL范围内时,随着添加量的增加EPS产量也相应提高,且在质量浓度0.2 g/100 mL时菌株EPS的产量达到最高(0.477 g/L);但随着Mg2+添加量的逐渐增加,EPS的产量反而降低,因此最终选择质量浓度0.2 g/100 mL为最适Mg2+的添加量。

图 7 MMgg22++添加量对EPS产量的影响Fig.7 Effect of Mg2+concentration on the yield of EPS
2.6 响应面法优化EPS产量
2.6.1 因素水平的选择
综合上述单因素试验结果,可以看出添加大豆蛋白胨后EPS的产量增加最为显著,其次为Mg2+的添加,发酵温度和乳糖添加量的改变对EPS产量增加的效果相一致,但考虑到原料成本问题,最终选取了发酵温度、Mg2+添加量和大豆蛋白胨添加量3个因素进行响应面分析。
根据Box-Behnken试验设计原理[20],对影响EPS产量的3个因素(发酵温度、Mg2+添加量、大豆蛋白胨添加量)进行三因素三水平的响应面分析试验,以EPS产量为响应值,试验方案及结果见表1。
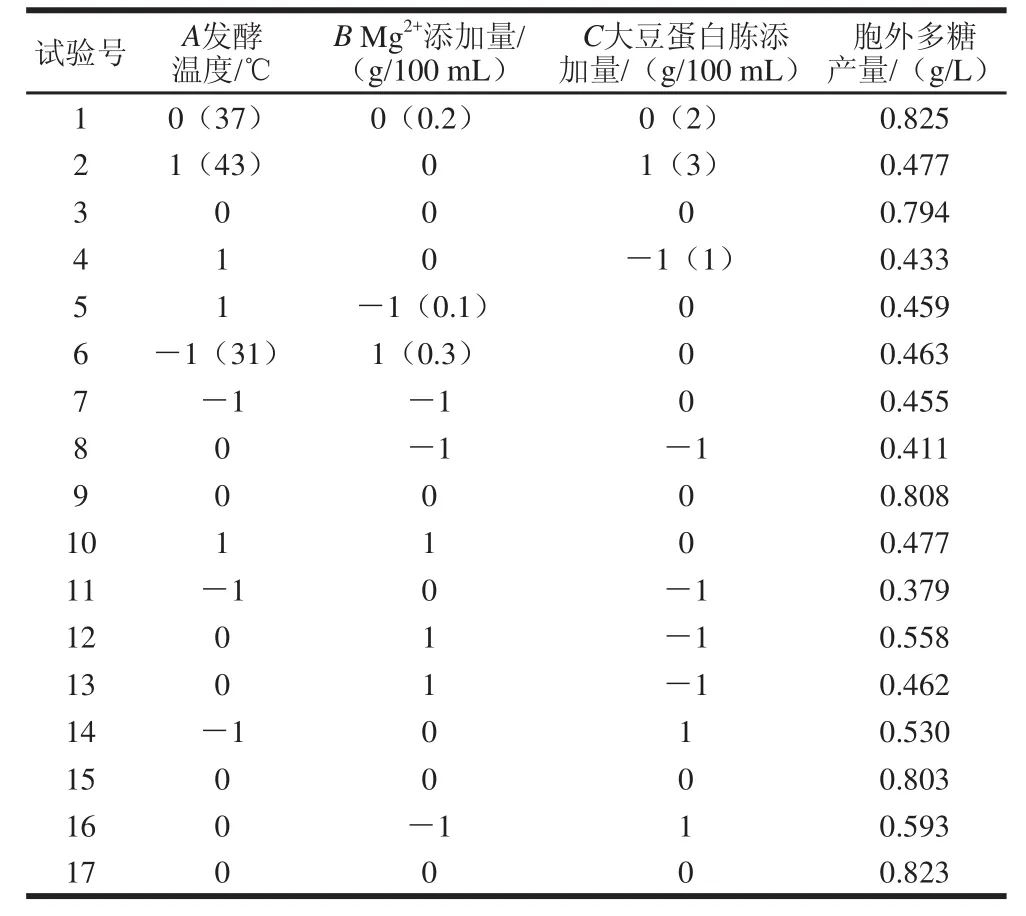
表1 响应面分析试验设计组合和响应值Table 1 Experimental design and results for response surface analysis
2.6.2 回归模型的建立与显著性分析
利用Design Expert(Version 8.0.6)软件对表2试验数据进行二次回归拟合分析,得到瑞士乳杆菌MB2-1 EPS产量(Y)对发酵温度(A)、Mg2+添加量(B)和大豆蛋白胨添加量(C)3个因素的二次多项式回归模型为:Y=-8.510 46+0.417 89A+6.245 33B+0.893 78C+4.166 67AB-4.458 33AC-5.532 64A2-14.792 5B2-0.156 68C2。

表2 拟合二次多项式模型的方差分析Table 2 Analysis of variance (ANOVA) for the fitted quadratic polynomial mooddeell
由表2可知,模型的P值小于0.000 1,表示该模型是极显著的,其中各因子的变化对EPS产量的影响不是简单的线性关系,与实际试验的拟合度较好。试验中回归方程的线性相关系数R2= 0.996 3,拟合度良好,说明试验各因素对EPS产量的影响很大,即因变量与3个自变量之间的线性关系显著。模型的校正系数R2Adj= 0.991 6,说明该模型能够解释0.991 6的响应值变化。失拟项的F值为1.73,P值为0.298 5>0.05,即失拟不显著,说明该方程对试验拟合较好,模型能准确地模拟各因素对EPS产量的影响。
对回归方程各项进行方差分析,结合A、B、C各因素的F值大小,可以得出3个因素对EPS产量的影响次序为:大豆蛋白胨添加量>Mg2+添加量>发酵温度。其中,C、A2、B2、C2以及交互项AC对EPS产量的影响极显著,BC对其影响显著,而A、B及交互项AB对其影响不显著。
2.6.3 响应面分析
响应面图形是响应值对各实验因素构成的三维空间曲面图,其表示的是最佳参数和各参数之间的相互作用[21]。利用Design Expert(Version 8.0.6)软件对表1进行处理,可得到回归方程的响应面及其等高线图,如图8所示。
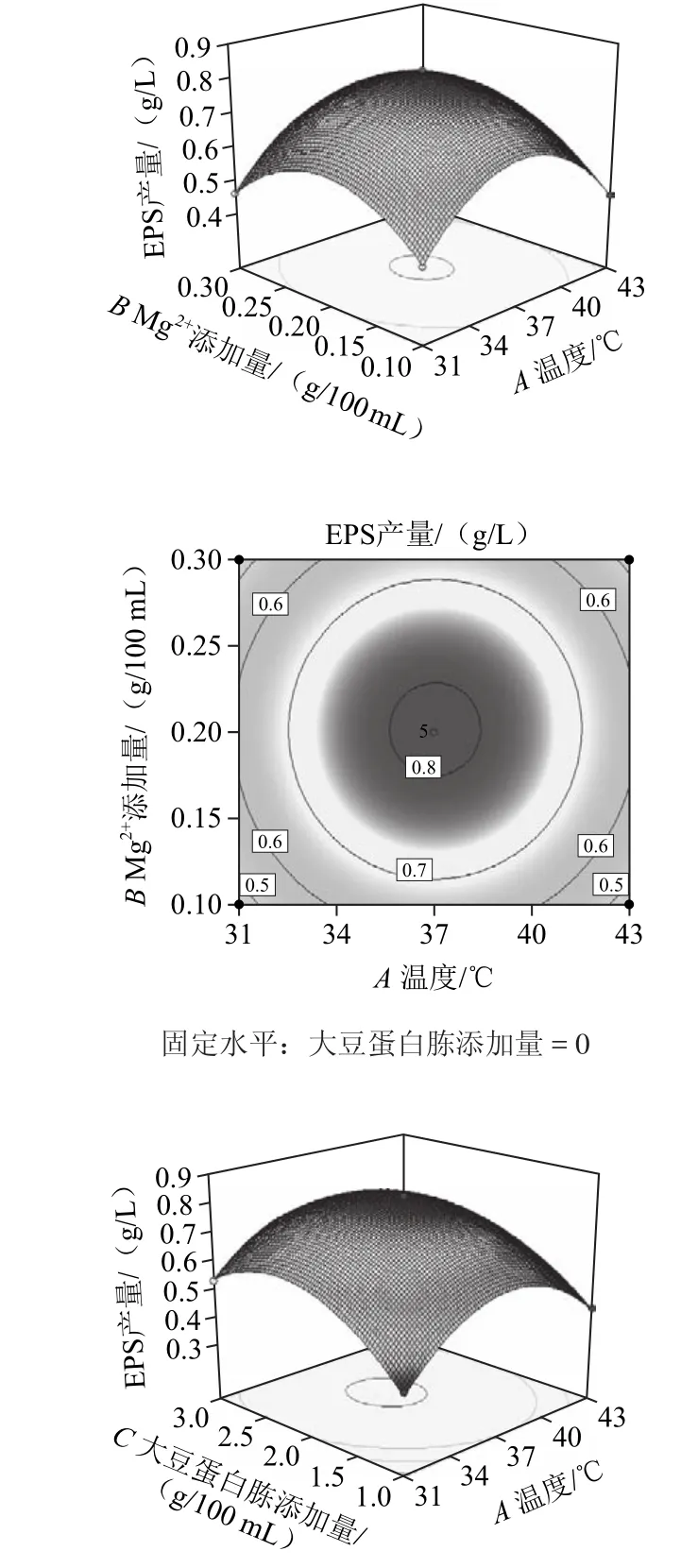
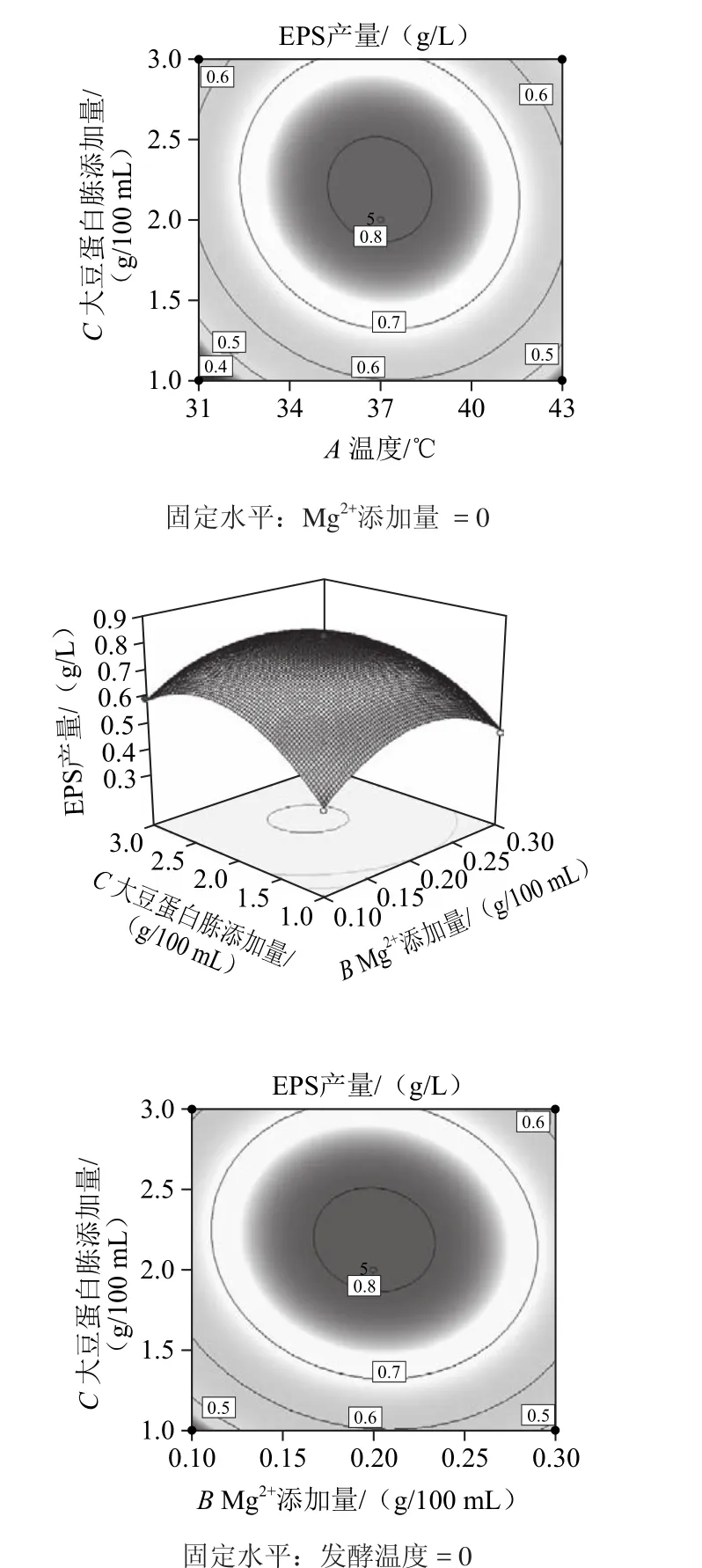
图8 发酵温度、Mg2+添加量与大豆蛋白胨添加量对EPS产量影响的响应面及等高线图Fig.8 Response surface and contour plots for the effects of culture temperature, Mg2+concentration and soybean peptone concentration on the yield of EPS
一般而言,等高线图形的性状可直观地表现出各因素之间的交互作用是否具有显著性:圆形曲线表明两因素间交互作用不显著,椭圆形曲线则表示具有显著的交互作用。从图8可知,发酵温度和Mg2+添加量的交互作用不显著,而发酵温度和大豆蛋白胨添加量,以及Mg2+添加量和大豆蛋白胨添加量的交互作用是显著的。比较各图结果可知,大豆蛋白胨添加量对EPS产量的影响最为显著,表现为曲面最陡,Mg2+添加量对EPS产量的影响其次,而发酵温度的影响最小,表现为曲线较为平滑,且随着数值的变化,响应值没有显著的变化。
2.6.4 发酵条件的优化组合及验证
从上述结果可知,回归模型存在最大值,通过软件分析得到瑞士乳杆菌MB2-1 EPS产量的最佳条件为:发酵温度36.96 ℃、Mg2+添加量为0.2 g/100 mL、大豆蛋白胨添加量为2.19 g/100 mL,在此条件下理论预测最大的EPS产量为816.2 mg/L。
为方便实际操作,调整各参数值为:发酵温度37 ℃、Mg2+添加量为0.2 g/100 mL和大豆蛋白胨添加量为2.19 g/100 mL,根据此条件得到的实际EPS产量为801.2 mg/L,比理论值降低了1.83%左右,表明该模型能够较好的预测实验结果。
3 结 论
本实验通过单因素试验分析了高产黏瑞士乳杆菌
MB2-1 EPS产量的最佳发酵条件,并结合Box-Behnken的中心组合设计及响应面分析,建立了瑞士乳杆菌MB2-1 EPS发酵条件的二次多项式模型,并经显著性检验证明了该模型具有可靠性。利用模型的响应面分析,得到的最佳发酵条件为:发酵温度37 ℃、Mg2+添加量为
0.2 g/100 mL和大豆蛋白胨添加量为2.19 g/100 mL,此条件下获得的实际EPS产量为801.2 mg/L。这为今后更深入的研究瑞士乳杆菌MB2-1 EPS结构和抗氧化、抗肿瘤等生理功能以及其机理的阐明奠定了基础,同时也为EPS在食品和医药中的应用提供了参考价值。
[1] YANG Zhennai, LI Shengyu, ZHANG Xue, et al. Capsular and slime-polysaccharide production by Lactobacillus rhamnosus JAAS8 isolated from Chinese sauerkraut: potential application in fermented milk products[J]. Journal of Bioscience and Bioengineering, 2010, 110 (1): 53-57.
[2] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999.
[3] LAURE J, SEBASTIEN J F V, PHILIPPE D, et al. Exploiting exopolysaccharides from lactic acid bacteria[J]. Antonie van Leeuwenhoek, 2002, 82(1/4): 367-374.
[4] 包怡红, 梁雪, 李锐达, 等. 产胞外多糖酵母菌株的筛选鉴定及发酵产糖[J]. 微生物学报, 2010, 50(2): 278-283.
[5] RUAS M P, HUGENHOLTZ J, ZOON P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal, 2002, 12(2/3): 163-167.
[6] WELMAN A D, MADDOX I S. Exopolysaccharides from lactic acid bacteria: perspectives and challenges[J]. Trends in Biotechnology, 2003, 21(6): 269-274.
[7] PAN Daodong, MEI Xiuming. Antioxidant activity of an exopolysaccharide purified from Lactococcus lactis subsp. lactis 12[J]. Carbohydrate Polymers, 2010, 80(3): 908-914.
[8] VINDEROLA C G, REINHEIMER J A. Culture media for the enumeration of Bifi dobacterium bixdum and Lactobacillus acidophilus in the presence of yoghurt bacteria[J]. International Dairy Journal, 1999, 9(8): 497-505.
[9] 刘俊. 多黏类芽孢杆菌胞外多糖的发酵条件、结构、化学修饰及其抗氧化活性的研究[D]. 南京: 南京农业大学, 2010.
[10] LI Wei, MAHINUR M, CHEN Xiaohong, et al. Isolation and identification of high viscosity-producing lactic acid bacteria from traditional fermented milk in Xinjiang and its role in fermentation process[J]. European Food Research Technology, 2012, 235(3): 497-505.
[11] 李伟, 纪鹃, 徐希研, 等. 源自新疆赛里木酸奶的瑞士乳杆菌MB2-1荚膜多糖提取及其抗氧化活性[J]. 食品科学, 2012, 33(21): 34-38.
[12] KANMANI P, SATISH K R, YUVARAJ N, et al. Production and purification of a novel exoploysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J]. Bioresource Technology, 2011, 102(7): 4827-4833.
[13] GASSEM M A, SCHMIDT K A, FRANK J F. Exopolysaccharide production from whey lactose by fermentation with Lactobacillus delbrueckii ssp. bulgaricus[J]. Journal of Food Science, 1997, 62(1): 171-173.
[14] KOJIC M, VUJCIC M, BANINA A, et al. Analysis of exopolysaccharide production by Lactobacillus casei CG11, isolated from cheese[J]. Applied and Environmental Microbiology, 1992, 58(12): 4086-4088.
[15] MOZZI F, ROLLAN G, SAVOY G, DIORI D, et al. Effect of galactose and glucose on the exopolysaccharide production and the activities of biosynthetic enzymes in Lactobacillus casei CRL 87[J]. Journal of Applied Microbiology, 2001, 91(1): 160-167.
[16] XIANG Xiaoli, YANG Liyi, HUA Shuang, et al. Determination of oligosaccharide contents in 19 cultivars of chickpea (Cicer arietinum L.) seeda by high performance liquid chromatography[J]. Food Chemistry, 2008, 111(1): 215-219.
[17] 冯美琴, 邱远, 张琦, 等. 响应曲面法优化植物乳杆菌胞外多糖的醇沉工艺[J]. 食品科学, 2011, 32(19): 188-192.
[18] RODRIGO V S, GUILHERME L S, PHILIP A J G, et al. Structural characterization of an acidic exoheteropolysaccharide produced by the nitrogen-fixing bacterium Burkholderia tropica[J]. Carbohydrate Polymers, 2008, 73(4): 564-572.
[19] 杨冀艳, 胡磊, 许杨. Plackett-Burman设计和响应面法优化荷叶总黄酮的提取工艺[J]. 食品科学, 2009, 30(6): 29-33.
[20] 吴有炜. 试验设计与数据处理[M]. 苏州: 苏州大学出版社, 2002.
[21] 李清春, 张景强, 贺稚非. 乳酸菌胞外多糖的研究[J]. 电子科技大学学报, 2003, 32(6): 764-769.
Optimization of Fermentation Conditions for the Production of Exopolysaccharides by Lactobacillus helveticus MB2-1
JI Juan, LI Wei, CHEN Xiao-hong, JIANG Mei, RUI Xin, DONG Ming-sheng*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The fermentation conditions for the production of exopolysaccharides (EPS) by Lactobacillus helveticus MB2-1 isolated from Sayram traditional yogurt in Xinjiang were optimized. The effects of culture temperature, lactose concentration, nitrogen source and concentration, and mineral source and concentration on EPS yield were studied through single factor analysis. Response surface analysis (RSM) involving three independent variables at three different levels was carried out to determine the optimal process conditions by using Box-Behnken method. Results showed that the optimum extraction conditions were 37 ℃, 0.2 g/100 mL and 2 g/100 mL for culture temperature, Mg2+concentration and soybean peptone concentration, respectively. Under these conditions, the yield of EPS by L. helveticus MB2-1 was as high as 801.2 mg/L.
Lactobacillus helveticus MB2-1; exopolysaccharides (EPS); fermentation; response surface methodology (RSM)
TS201.3
A
1002-6630(2014)07-0095-07
10.7506/spkx1002-6630-201407020
2013-04-12
国家自然科学基金青年科学基金项目(31201422);国家高技术研究发展计划(863计划)项目(2011AA100903;2013BAD18B01-4);江苏省自然科学基金项目(BK2011651);教育部博士点基金项目(新教师类)(20110097120028);国家农业科技成果转化资金项目(2012GB23600639);江苏高校优势学科建设工程资助项目(PAPD)
纪鹃(1989—),女,硕士研究生,研究方向为食品微生物。E-mail:2011108011@njau.edu.cn
*通信作者:董明盛(1961—),男,教授,博士,研究方向为食品微生物与生物技术。E-mail:dongms@njau.edu.cn

