游离态叶黄素和玉米黄素体外单线态氧淬灭率的比较研究
翟艳丽,惠伯棣*,宫 平,杨博媛
(北京联合大学应用文理学院食品科学系,北京 100191)
游离态叶黄素和玉米黄素体外单线态氧淬灭率的比较研究
翟艳丽,惠伯棣*,宫 平,杨博媛
(北京联合大学应用文理学院食品科学系,北京 100191)
为比较玉米黄素和叶黄素单体的体外淬灭单线态氧能力,本实验分别萃取万寿菊与枸杞中的叶黄素与玉米黄素酯,经皂化和纯化后得到游离的叶黄素与玉米黄素组分。使用C30-HPLC-PDA 分别对制备组分进行定性和定量分析。用次氯酸钠-双氧水反应产生单线态氧,使用微弱发光测量仪测定制备组分对单线态氧的淬灭率。结果显示:游离叶黄素和玉米黄素均能减少次氯酸钠-双氧水反应体系产生的单线态氧数量,导致最大光子计数值下降。二者淬灭单线态氧的能力相似,最小作用剂量均为0.005~0.05 g/L。
玉米黄素;叶黄素;微弱发光分析;单线态氧;自由基;淬灭
叶黄素(lutein)和玉米黄素(又名玉米黄质,zeaxanthin)是含羟基的类胡萝卜素的同分异构体,分子式为C40H56O2,相对分子质量为568,二者分子结构见图1[1-2]。大部分存在于自然界中的叶黄素和玉米黄素为全反式异构体,且以双酯(如双棕榈酸酯)的形式存在。
食品中使用的叶黄素主要来源于万寿菊(marigold,Tagetes erecta L.)的花。万寿菊花中含有丰富的类胡萝卜素化合物,主要为叶黄素双酯[3]。食品中使用的玉米黄素主要来源于枸杞(wolfberry,Lycium chinense Mill.)的果实中。枸杞果实中存在着数量丰富的玉米黄素二棕榈酸酯[4]。本实验以万寿菊花和枸杞果实作为原料,萃取叶黄素和玉米黄素双酯,经皂化制成高纯度的游离态叶黄素和玉米黄素。

图1 叶黄素(a)与玉米黄素(b)分子结构式Fig.1 Molecular structures of lutein (a) and zeaxanthin (b)
许多临床实验的结果证明:叶黄素和玉米黄素具有对人体视网膜及黄斑的保护和调节人体免疫功能等作用[1]。因此,二者均被应用于保健食品、食品着色剂和饲料中。叶黄素与玉米黄素的分子结构中都包含多个共轭双烯结构,因此具有显著的抗氧化性质。二者的抗氧化性质最终决定了它们的上述健康功能。由于二者的结构相似,比较进而发现它们在性质(尤其是在食品中的抗氧化能力)上的区别成为人们关注的问题。这也关系到二者在食品中应用的定位。
自由基是能独立存在的含有一个或一个以上不配对电子的原子或原子团,具有较活泼的化学性质[5]。单线态氧(1O2)是一种活性氧自由基,处于激发态,经常作为链式氧化反应的诱导物。单线态氧在许多生命活动中都起着重要的作用,例如,与生物膜损伤、细胞衰老和癌症等疾病有密切关系[6-7]。在向低能态跃迁时,1O2可向外界辐射光子[8-9]。1963年,Khan等[10]建立了用NaClO和H2O2反应体系产生单线态氧,并可释放光子,二者数量相关,见式(1)。因此,对反应体系的光子计数可测定体系产生单线态氧的数量。
NaClO+H2O2→NaCl+H2O+1O2+hv (1)
1 材料与方法
1.1 材料与试剂
甲醇、乙醇、正己烷、四氢呋喃、30%过氧化氢、氢氧化钾和次氯酸钠均为分析纯试剂 北京化工厂;乙腈、乙酸乙酯均为色谱纯试剂 迪马公司;柱层析用硅胶(60~100目) 青岛海洋化工厂。
1.2 仪器与设备
高效液相色谱设备由Waters 1525溶剂输送系统和Waters 2996检测器组成;C30YMCTMCarotenoid(4.5 mm×250 mm,5 μm)色谱柱 日本YMC公司;MultiSpec-1501型紫外-可见分光光度计 日本Shimadzu公司;BPCL-2-JZSH型(双反应池)微弱发光分析仪中国科学院生物物理研究所。
1.3 方法
1.3.1 叶黄素和玉米黄素酯与单体的制备
取5 g万寿菊干花颗粒于研钵中,加入4倍体积的正己烷进行反复研磨,用滴管收集上清液,反复萃取3遍,合并收集上清液。在真空旋转干燥仪上旋蒸浓缩萃取液至20 mL,条件:45 ℃、-0.08 MPa、60 r/min。将浓缩物置于100 mL三角瓶中,加入等体积的10%氢氧化钾-乙醇溶液,加导气管后,避光在磁力搅拌器上搅拌过夜皂化[17]。皂化完全后,将反应物转移至250 mL分液漏斗中,加入50 mL乙醚和50 mL 2%的氯化钠水溶液。缓慢摇动后,静止。待分层后,收集上相。用氮气将乙醚吹干,得到游离态叶黄素组分。
在依照前文中的标准完成种子的选择之后,可以通过科学的种子处理来增加种子的抗逆性和出苗率。具体措施为先使用15℃的凉水将种子浸湿,随后放入54℃的温水中浸泡15分钟,等水温冷却至20℃的时候再浸泡12小时左右完成浸种。在浸种完成中,需要进行催芽处理。将浸好的种子捞出洗净之后,用湿布包裹完好,放置于27℃左右的恒温中催芽3天。需要注意的是,在催芽的过程中每天需要翻动几次包裹,并采用清水进行淘洗。通过上述操作,可以大幅度增加种子的出芽速度和出苗率。
取200 g枸杞果实于3 000 mL烧杯中,加水2 000 mL。小火煮沸2 h后捞出,放在表面皿中,在70 ℃真空烘箱烘至恒质量,得到76 g干燥物。在研钵中,将干燥物碾碎,筛出籽,收集破碎的果肉和果皮。取10 g干燥的果肉和果皮于研钵中,萃取、皂化方法同叶黄素的制备,得到游离态玉米黄素组分。
1.3.2 制备物中总类胡萝卜素含量的UV-Vis测定
分别定量称取游离叶黄素和玉米黄素制备物,用无水乙醇定容。用紫外-可见光分光光度计测量溶液在449 nm波长处的吸光度,并根据公式(2)分别计算两个制备组分中总类胡萝卜素的含量[2,18]。

式中:x为样品中总类胡萝卜素的含量/g;y样品溶液的体积/mL;A为样品的吸光度;A1%1cm为吸光系数,在此,叶黄素采用值为2 200,玉米黄素采用值为2 480。
1.3.3 制备物中类胡萝卜素组成的C30-HPLC分析
分别称取适量游离叶黄素与玉米黄素制备物,使用丙酮溶解,过0.45 nm滤膜后,用于HPLC分析。H P L C条件:色谱柱为C30Y M CTMC a r o t e n o i d(4.5 mm×250 mm,5 μm);流动相A为乙腈-甲醇(3∶1,V/V);流动相B为甲基叔丁基醚(methyl tretbutyl ether,MTBE)。线性梯度洗脱:B在15 min内从0%升至40%,之后在15 min到25 min内从40%升至100%,流速为1 mL/min,检测波长为450 nm,进样量为20 μL[19]。根据HPLC色谱行为、光谱特征及与已有的文献记载对比,对各组分进行鉴定。按峰面积归一法,根据式(3)分别计算制备物中游离叶黄素和玉米黄素组分在总类胡萝卜素中所占的比例。

1.3.4 制备物中游离叶黄素和玉米黄素的含量计算
按式(4)、(5)计算制备物中游离叶黄素和玉米黄素的含量。

1.3.5 体外单线态氧淬灭率的比较
分别称取一定量的游离叶黄素与玉米黄素组分溶于四氢呋喃中,配制成3种质量浓度分别为0.5、0.05、0.005 g/L的溶液。
在进行单线态淬灭率测量时,首先用14C源校正微弱发光测量仪至30 000光子计数值。测量条件及测量方法为:双样品数据采集间隔为0.1 s,收集时间为30 s。在样品测量杯中顺次加入0.15 mL次氯酸钠和0.15 mL样品,混匀后将测量杯放入样品池中,关闭检测室门,启动接收光子计数信号,待基线稳定后,注入0.15 mL双氧水,同时开始计时记录光子计数信号。在参比样品测量杯中的操作同上,样品溶液换为四氢呋喃。记录每个样品的反应时间—光子计数图。由于该反应受到多种环境因素的影响,为确保实验结果的准确性,每个样品重复6次,按式(6)计算淬灭率[1,3]。实验结果以淬灭率的表示。采用SPSS 13.0软件处理数据,对相同质量浓度下叶黄素与玉米黄素的单线态氧淬灭率进行T检验。

2 结果与分析
2.1 游离叶黄素和玉米黄素组分的类胡萝卜素组成

图2 叶黄素(a)和玉米黄素(b)制备物色谱图Fig.2 C30-HPLC profiles of lutein (a) and zeaxanthin (b) fractions


图3 组分Ⅰ(a)和Ⅱ(b)的电子吸收光谱图Fig.3 Electronic absorption spectra of fraction Ⅰ(a) and Ⅱ (b)
在万寿菊花和枸杞果实中,叶黄素和玉米黄素均主要以酯的形式存在,经过强碱条件下的皂化后水解为游离态分子。用图2、3给出的信息与参考文献[19]上报道的结果比较,可以得出结论如下:制备组分Ⅰ和Ⅱ可定性为游离叶黄素和玉米黄素;按峰面积归一法(式(3))计算,制备组分中游离叶黄素和玉米黄素分别占总类胡萝卜素的97.3%和98.8%,即:两个制备物的类胡萝卜素组成相当单一。
2.2 制备物中游离态叶黄素与玉米黄素的含量
经分光光度法测定,叶黄素制备物中总类胡萝卜素的含量为76.6%。按式(4)、(5),其中游离叶黄素含量达到74.5%。玉米黄素制备物中总类胡萝卜素的含量为71.0%,其中玉米黄素含量达到70.1%。
2.3 游离态叶黄素和玉米黄素制备组分的单线态氧淬灭率
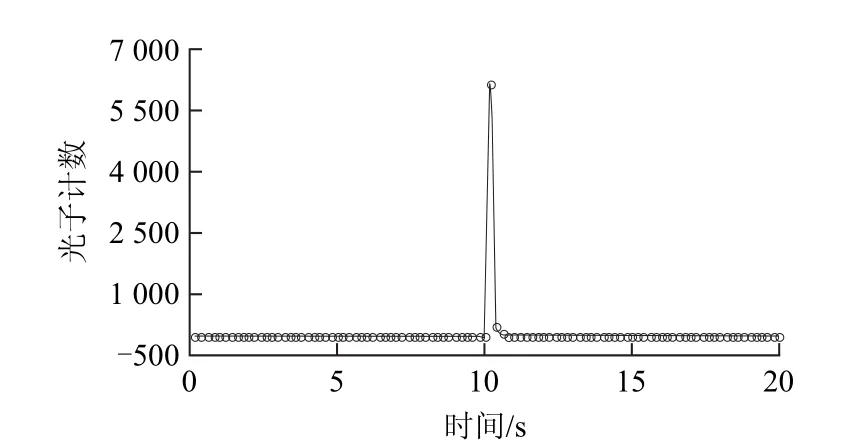
图4 次氯酸钠-双氧水反应体系的时间-光子计数图Fig.4 Time-photon count profile for NaClO/H2O2reaction
图4 为游离玉米黄素0.005 g/L质量浓度的次氯酸钠-双氧水反应体系的时间-光子计数图。其他5个样品的光子计数图类同。此外,BPCL-2-JZSH 型微弱发光分析仪具有双反应池,可同时进行样品和参比样品的测量。这在很大程度上减小了实验结果的误差。在实际操作中,由于采用的是双反应池设备,样品与参比样品同时检测,淬灭率可在数据处理时同步给出。
表1 叶黄素与玉米黄素在不同质量浓度下的单线态氧淬灭率Table 1 Effect of different concentrations of free lutein and zeaxanthin on singlet oxygen quenching rate

表1 叶黄素与玉米黄素在不同质量浓度下的单线态氧淬灭率Table 1 Effect of different concentrations of free lutein and zeaxanthin on singlet oxygen quenching rate
%组别质量浓度/(g/L)0.50.050.005游离态叶黄素游离态玉米黄素81.25±4.04 75.32±6.41 75.96±6.16 68.06±9.07 44.19±3.24 34.32±10.32
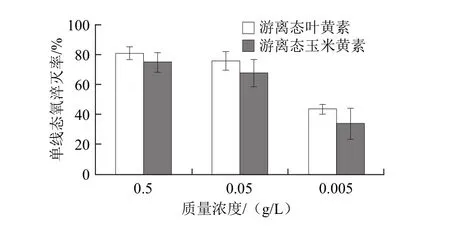
图5 游离态叶黄素与玉米黄素质量浓度变化对其单线态氧淬灭率的影响Fig.5 Effects of different concentrations of free lutein and zeaxanthin on singlet oxygen quenching rate
图5 显示了游离态叶黄素和玉米黄素质量浓度变化对它们单线态氧淬灭率的影响。鉴于次氯酸钠-双氧水反应受环境因素的影响较明显,因此个别组数据的离散程度较大。对相同质量浓度下叶黄素与玉米黄素的单线态氧淬灭率进行T检验,0.5、0.05、0.005 g/L不同质量浓度下双尾检测P值依次为0.084、0.108、0.067,均大于0.05,统计结果不具有显著性差异。
综上所述可知,当反应体系中加入游离态叶黄素或玉米黄素制备物后,反应体系的最大光子计数值均降低,即:淬灭率均为正值;相同质量浓度的游离态叶黄素和玉米黄素对单线态氧的淬灭能力相同;增加反应体系中游离态叶黄素或玉米黄素的量,能够提高对单线态氧的淬灭能力。当二者的质量浓度达到0.05 g/L时,其淬灭率均超过50%。这一结果可以作为这两种化合物在体内 发挥淬灭自由基作用时的量效关系依据。
3 讨 论
在实验制备的游离态叶黄素和玉米黄素样品的纯度分别为74.5%和70.1%。显然,在样品中除了类胡萝卜素外,还有其他非皂化物组分。在样品淬灭单线态氧时,这部分非皂化物很可能参与了反应。这部分非皂化物组分与淬灭率的量效关系给本项研究的结果可能带来不确定因素。然而,70%左右的样品纯度是目前我国食品行业中大部分工业中间体产品的纯度水平。因此,实验结果还是具有一定的实践参考价值。本研究结果表明:叶黄素和玉米黄素在量效关系上具有基本相近的体外淬灭单线态氧的能力。当二者的质量浓度达到0.05 g/L时,其淬灭率均超过50%。这可能是由于二者分子中央共轭多烯链中的双键数量相同。端基六元环上的结构变化对二者淬灭单线态氧能力的影响可能不明显。但是,端基六元环上的结构变化还是可能造成了两种分子淬灭单线态氧能力的细微差别。二者的分子结构在端基芳香环上电子云偏移的空间取向有所差别。这一差别可导致分子中央共轭体系电子云的偏移程度不同,最终可能影响到二者淬灭单线态氧的能力。
游离态叶黄素与玉米黄素制备物淬灭单线态氧能力的相似性对可以对评估二者在体内的生物学功能具有一定的参考价值。例如,在人体中,视网膜黄斑是二者共同的靶器官之一。在量效关系上,二者淬灭单线态氧能力的一致性与靶器官的一致性之间的相关性可成为今后需要探讨的研究领域。如果这种相关性存在,游离态叶黄素与玉米黄素在视网膜黄斑中发挥了淬灭自由基功能这一结论就可能得到佐证。
[1] 廖萍泰, 惠伯棣, 裴凌鹏, 等. 叶黄素的体外抗氧化功能[J]. 食品与发酵工业, 2005, 31(4): 46-49.
[2] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005: 258.
[3] 惠伯棣, 裴凌鹏, 李京, 等. 万寿菊花中叶黄素及其酯体外淬灭单线态氧能力的比较[J]. 中国药学杂志, 2006, 41(18): 1385-1387.
[4] 蔡靳, 赵婷, 惠伯棣, 等. 酸浆宿萼中β-隐黄质体外淬灭单线态氧能力评价[J]. 食品科学, 2010, 31(17): 158-161.
[5] 陈瑗, 周玫. 自由基医学基础与病理生理[M]. 北京: 人民卫生出版社, 2002: 7.
[6] PACKER L, TABER M G, XIN W. Proceeding of international symposium on natural antioxidants molecular mechanisms and health effects[M]. Illinois: AOCS Press Champaign, 1995: 44-47.
[7] 薛洪福. 生物系统超微弱发光领域的研究现状[J]. 大学物理实验, 1996, 9(4): 72-81.
[8] 裴凌鹏, 张帅, 李文卅, 等. 葛根黄酮的提取和抗氧化研究[J]. 北京联合大学学报, 2003(9): 78-82.
[9] 徐向荣, 王文华, 李华斌. 化学发光法测定Fenton反应中的羟自由基的建立[J]. 基础医学与临床, 1998, 18(6): 68-71.
[10] KANOFSKY J R. Singlet oxygen production by lactoperoxidase[J]. The Journal of Biological Chemistry, 1983, 258(10): 5991- 5993.
[11] 陈秀武, 胡天喜. 测定羟自由基产生与清除的化学发光体系[J]. 生物化学与生物物理进展, 1992, 19(2): 136-139.
[12] 赵文恩. 类胡萝卜素抗氧化性质的研究[J]. 郑州大学学报, 2003, 24(1): 38-46.
[13] 陈瑗, 周玫. 自由基医学基础与病理生理[M]. 北京: 人民卫生出版社, 2002: 53.
[14] 张仲伦. 微弱发光分析技术原理及应用实例(一) [J]. 生物化学与生物物理进展, 1999, 26(4): 405-407.
[15] 张仲纶, 郑雁珍, 苏震, 等. 单片微机化微弱发光测量仪及其在肿瘤研究中的初步应用[J]. 生物医学工程学杂志, 1994, 11(1): 24-30.
[16] 李京, 惠伯棣. 几何异构化对番茄红素淬灭单线态氧功能的影响[J].食品科学, 2007, 28(8): 104-107.
[17] PANG Z J, ZHOU M, CHEN A. Research method of free-radical medicine[M]. Beijing: Peoplecs Medical Publishing House, 2002: 3-91.
[18] 惠伯棣, 裴凌鹏, 李京, 等. 万寿菊花中叶黄素及其酯体外淬灭单线态氧能力的比较[J]. 中国药学杂志, 2006, 41(18): 1385- 1387.
[19] 惠伯棣, 李京, 裴凌鹏. 应用C30-HPLC-PDA分离与鉴定食品中全反式叶黄素和玉米黄素[J]. 食品科学, 2006, 27(9): 151-154.
[20] 张艳. 叶黄素在大鼠体内代谢及对视网膜光损伤影响的初探[D]. 北京: 首都师范大学, 2008: 1-66.
Comparative Study of Singlet-Oxygen Quenching Capacity between Free Lutein and Zeaxanthin in vitro
ZHAI Yan-li, HUI Bo-di*, GONG Ping, YANG Bo-yuan
(Department of Food Science, College of Applied Arts and Science, Beijing Union University, Beijing 100191, China)
This study aimed to compare the abilities of free zeaxanthin and lutein to quench singlet oxygen in vitro. Lutein and zeaxanthin esters were extracted from marigold flowers and wolfberry fruits, respectively. After being saponified and purified, free lutein and zeaxanthin fractions were obtained from the two extracts, respectively. The fractions were identified and quantified on C30-HPLC-PDA. A reaction between NaClO and H2O2was then performed to produce singlet oxygen. The singlet oxygen quenching rates of free lutein and zeaxanthin fractions were determined, respectively, on an ultra-weak luminescience analyzer. Data from ultra-weak luminescience analysis suggested that both lutein and zeaxanthin fractions were capable of reducing the amount of singlet oxygen produced and the maximum number of photons generated from the reaction. A minimum amount of 0.005-0.05 g/L that resulted in more than 50% reduction of maximum photon number was observed with both fractions and their abilities to quench singlet oxygen were similar.
zeaxanthin; lutein; ultra-weak luminescience analysis; singlet oxygen; free radical; quenching
R965
A
1002-6630(2014)07-0077-04
10.7506/spkx1002-6630-201407016
2013-05-17
翟艳丽(1988—),女,硕士研究生,研究方向为类胡萝卜素及生物化学。E-mail:219zyl@163.com
*通信作者:惠伯棣(1959—),男,教授,博士,研究方向为类胡萝卜素及生物化学。E-mail:bodi_hui@ygi.edu.cn

