门静脉高压大鼠肠黏膜通透性改变时D-乳酸和内毒素的表达及复合膳食纤维的保护作用
乔小东 武 华
1.山西医科大学,山西太原 030001;2.山西医科大学第一临床医学院普外科,山西太原 030001
门静脉高压症(portal hypertension,PHT)是临床一种常见病、多发病,为各种原因所致门静脉血循环障碍而导致的一系列临床综合征,病死率较高,影响患者的生命质量,并对家庭和社会造成严重的负担。其中门静脉高压性肠病[1]是其与肠道密切相关的临床表现之一。 然而胃肠道又是体内最大的细菌储存器官[2],肠屏蔽功能受损后引发的肠道菌群易位是其继发感染及脓毒症的主要原因[3]。 因此如何进行肠屏蔽功能的检测和保护将成为研究的重点。 有研究证明,复合膳食纤维在保持肠道形态结构、改善肠道黏膜功能方面发挥积极作用[4]。 本研究利用门静脉高压大鼠模型,通过对模型大鼠血浆D-乳酸和内毒素表达的测定,探寻复合膳食纤维对门静脉高压大鼠肠黏膜屏障功能的保护作用,为其临床应用提供依据。
1 材料与方法
1.1 材料
健康雌性Wistar 大鼠65 只,体重180~200 g,由山西医科大学动物中心提供。 能全素(整蛋白型肠内营养粉剂,产品批号:121004)购自纽迪希亚制药(无锡)有限公司。复合膳食纤维(可溶与不可溶性膳食纤维)购自无锡华瑞制药有限公司。 D-乳酸试剂盒购自BioAssay Systems 公司。 鲎试剂盒(Ⅱ)购自上海伊华临床医学科技公司。
1.2 方法
1.2.1 模型建立 健康雌性Wistar 大鼠65 只经0.35 g/L苯巴比妥溶液诱导1 周后,随机抽取5 只大鼠设为对照组,其余60 只大鼠为实验组。实验组大鼠采用50%的CCl4橄榄油复合法建立门静脉高压模型:以0.4 mL/100 g 的剂量经背部皮下注射50%的CCl4橄榄油溶液,每周2 次,持续4 周;之后按0.5 mL/100 g 剂量同法注射,每周2 次,持续4 周,共8 周。第10 周随机抽取2 只大鼠行门静脉压力测定及肝组织活检。建模成功并存活的大鼠共40 只。 对照组大鼠以同法注射生理盐水。
1.2.2 动物分组 将40 只门静脉高压大鼠模型随机分成A、B、C、D 4 组,每组各10 只,各组按125 mL/(kg·d)剂量分四次(8 h 1 次)给予不同的肠内营养制剂。 A组给予生理盐水;B 组给予不含膳食纤维的能全素;C组给予能全素+复合膳食纤维20 g/L (可溶与不可溶之比为1∶2);D 组给予能全素+复合膳食纤维20 g/L(可溶与不可溶之比为2∶1)。对照组行正常饲养,各组大鼠饲养期间自由饮水。
1.3 检测指标
实验组4 组大鼠分别于饲养的第1、3、7 天中相同的时间点随机抽取3、3、4 只大鼠行麻醉后开腹,使用采血针穿刺门静脉取全血2 mL 置于肝素抗凝管内,低温离心后,吸取上清液,于-20℃保存;门静脉取血后,行腹主动脉穿刺,用加有肝素的试管留取血4~5 mL,低温离心后,吸取上清液1 mL,于-20℃保存;在距盲肠10~12 cm 处剪取2 cm 末端回肠组织,在10%的中性甲醛溶液中固定48 h,石蜡包埋留作标本。对照组大鼠于饲养的第7 天以同法取血及组织标本。 取材后采用颈椎脱臼法处死相应大鼠。
1.3.1 病理形态学观察 每只大鼠的石蜡标本,以4 μm厚度垂直切片,经HE 染色后在光镜下观察回肠黏膜上皮细胞结构。
1.3.2 D-乳酸含量测定 采用改良的酶学分光光度法测定血浆中D-乳酸活性[5]。
1.3.3 血浆内毒素测定 采用鲎试剂偶氮显色法测定内毒素浓度,过程严格按照试剂盒使用说明书进行操作。
1.4 统计学方法
采用统计软件SPSS 13.0 对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,多组间比较采用重复测量的方差分析,组间两两比较采用LSD-t检验。 以P < 0.05 为差异有统计学意义。
2 结果
2.1 各组形态学观察
实验组大鼠各时相回肠黏膜均出现明显的黏膜萎缩,绒毛萎缩变短,黏膜固有层水肿,腺体排列稀疏,中性粒细胞和淋巴细胞浸润,部分黏膜上皮细胞变性、坏死、脱落,黏膜下层充血水肿及出血显著。 对照组回肠黏膜上皮结构完整。实验组中各时相B、C、D组均较A 组肠黏膜的损伤轻,其中B 组在7 d 时较同时相的A 组回肠黏膜的损伤有所改善,C、D 组在3 d和7 d 较同时相的B 组回肠黏膜的损伤有所改善但未能完全恢复至对照组水平。
2.2 各组血浆D-乳酸表达及含量
实验组四组大鼠血浆D-乳酸表达在建模后各时相与对照组[(2.13±0.39)mg/L]比较,差异均有统计学意义(P < 0.05),各组随时间变化的曲线方向基本一致。 建模后1 d 四组组间比较,差异均无统计学意义(P > 0.05);3、7 d 四组组间比较,差异均有高度统计学意义(P < 0.01),且3、7 d 各时相B、C、D 组大鼠血浆D-乳酸表达分别与A 组比较,差异均有统计学意义(P<0.05),3、7 d 各时相C、D 组分别与B 组比较,差异均有统计学意义(P < 0.05),各时相D 组与C 组比较,差异有统计学意义(P < 0.05)。 见表1。
表1 各组大鼠血浆D-乳酸测定结果(mg/L,±s)
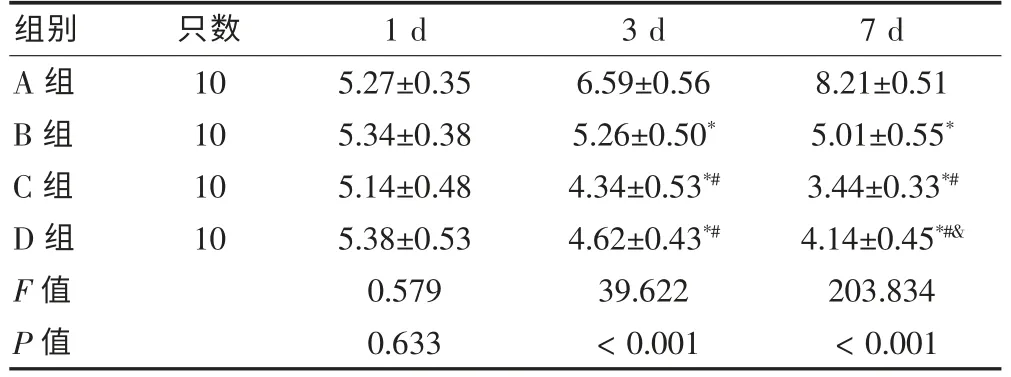
表1 各组大鼠血浆D-乳酸测定结果(mg/L,±s)
注:与A 组比较,*P < 0.05;与B 组比较,#P < 0.05;与C 组比较,&P <0.05
?
2.3 各组血浆内毒素表达及含量
实验组四组大鼠血浆内毒素表达在建模后各时相与对照组[(0.21±0.02)EU/mL]比较,差异均有统计学意义(P < 0.05)。 建模后1 d 四组组间比较,差异均无统计学意义(P > 0.05);3、7 d 四组组间比较,差异均有高度统计学意义(P < 0.01),且3、7 d 各时相B、C、D 组大鼠血浆内毒素表达分别于A 组比较,差异均有统计学意义(P<0.05),3、7 d 各时相C、D 组分别于B 组比较,差异均有统计学意义(P < 0.05),各时相D组与C 组比较,差异有统计学意义(P<0.05)。 见表2。
表2 各组大鼠血浆内毒素测定结果(EU/mL,±s)
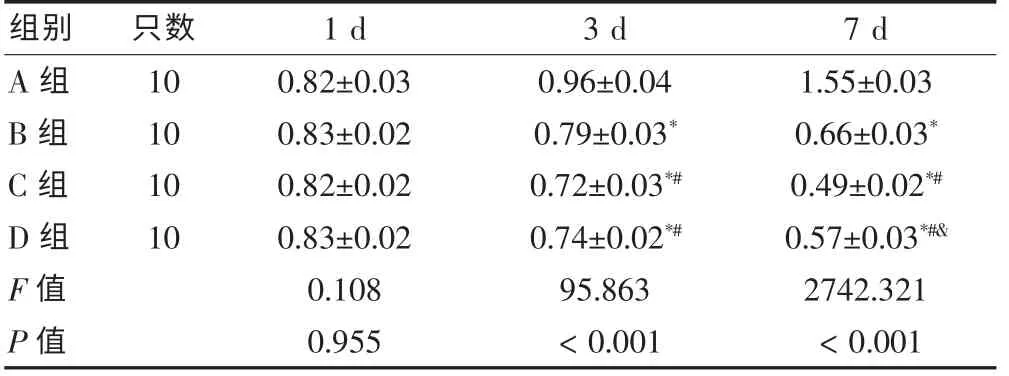
表2 各组大鼠血浆内毒素测定结果(EU/mL,±s)
注:与A 组比较,*P < 0.05;与B 组比较,#P < 0.05;与C 组比较,&P <0.05
?
3 讨论
肠黏膜屏障主要由机械屏障、生物屏障、化学屏障及免疫屏障组成[6-8]。通过大量的动物实验和临床试验研究证实,在肠黏膜缺血、再灌注损伤、营养不良及应激性损伤等原因下,均可引起肠黏膜损伤、萎缩、通透性增加、 菌群失调等表现的肠黏膜屏障功能障碍。肠屏障功能障碍可导致细菌和(或)内毒素易位,并可诱发和(或)加重全身炎性反应和多器官功能障碍[9]。
本研究通过对门静脉高压大鼠模型的回肠黏膜组织进行形态学观察并对血浆D-乳酸和内毒素指标的表达进行检测,结果表明:①实验组门静脉高压大鼠模型的回肠黏膜有明显的萎缩,绒毛萎缩变短,黏膜固有层水肿,中性粒细胞和淋巴细胞浸润,部分黏膜上皮细胞变性、坏死、脱落,黏膜下层充血水肿及出血显著。 而对照组回肠黏膜上皮结构完整。 提示肠黏膜屏障功能受损。②实验组门静脉高压大鼠模型的血浆D-乳酸和内毒素的表达均明显高于对照组,提示通过建立门静脉高压模型后大鼠肠黏膜明显受损,肠黏膜屏障功能障碍。当肠道发生急性缺血等损伤致肠黏膜绒毛顶端上皮脱落,肠黏膜通透性增加时,肠道中细菌产生大量D-乳酸通过受损黏膜入血,使血浆D-乳酸水平升高,故检测血浆D-乳酸水平可及时反映肠黏膜损害程度和通透性变化[10]。 正常情况下机体肠腔内含有大量细菌和内毒素,当肠屏障功能障碍时,内毒素通过肠黏膜,进入血循环,形成内毒素血症,因此监控外周血中的内毒素水平,成为了解肠屏障功能的重要手段[11]。
肠内营养在防止肠黏膜萎缩、维护肠黏膜机械及免疫屏障、防止细菌易位的发生其重要作用[12]。 膳食纤维是植物中的可食用部分或类似的碳水化合物,虽然不能在小肠内被降解, 但可以在结肠内被细菌酵解[13]。 膳食纤维又可分为可溶性和不可溶性两类。 不可溶性膳食纤维作为植物细胞壁的纤维成分,在肠道内可吸收水分、有害菌群和毒素,还可以增加肠道的蠕动[14]。 可溶性膳食纤维在进入结肠后能被盲肠和结肠内的厌氧菌分解成为短链脂肪酸,能直接供给结肠黏膜细胞75%以上的能量[15]。 本研究中加复合膳食纤维的C、D 组较未加复合膳食纤维的A、B 组肠黏膜损伤明显有所改善,血浆D-乳酸和内毒素的表达呈显著下降趋势。 结果显示,复合膳食纤维对门静脉高压大鼠的肠黏膜屏障功能有保护作用。
[1] De Palma GD, Rega M, Masone S, et al. Mucosal abnormalities of the small bowel in patients with cirrhosis and portal hypertension: acapsule endoscopy study [J]. Gastrointest Endosc,2005,62:529-534.
[2] 黎鳌.黎鳌烧伤学[M].上海:上海科技出版社,2001:11.
[3] 黎介寿.肠衰竭-概念、营养支持与肠黏膜屏障维护[J].肠外与肠内营养,2004,11(2):65-67.
[4] 陈德国,武华.复合膳食纤维对溃疡性结肠炎患者肠黏膜屏障功能的影响[J].临床研究,2013,10(4):34-38.
[5] Brandt RB, Siegel SA, Waters MG, et al. Spectrophotom etric assay for D(-)-lactate in plasma [J]. Anal Biochem,1980,102:39-46.
[6] Baumagart DC, Dignass AU. Intestinal barrier function [J].Curr opin clin Nutr Metab Care,2002,5(6):685-694.
[7] Macfie J. Enteral versus parenteral nutrition: the signigicance of bacterial translocation and gut barrier function [J].Nutrition,2002,16:606-611.
[8] 牛海静,王邦茂.肠粘膜屏障与功能[J].解剖与临床,2007,(2):138-140.
[9] Ding LA, Li JS, Li YS, et al. Intestinal barrier damage caused by trauma and lipopolysaccharide [J]. World Gastroenterol,2010,10(16):2373-2378.
[10] 李石玖,马恩陵,廉东波,等.实时定量PCR 检测外科发热患者静脉血中人肠杆菌DNA 的方法[J].中国临床营养杂志,2006,14(2):70-76.
[11] 朱敏,周冰.肠粘膜屏障功能障碍的研究现状[J].健康大视野,2012,20(7):28-30.
[12] Uchida K, Kado S, Onoue M, et al. Relationship between the nature of mucus and crypt multiplicity in aberrant crypt foci in the rat colon [J]. Jpn J Cancer Res,1997,88(9):807-814.
[13] 谢洁,周剑新.膳食纤维及其发展前景[J].食品安全与健康,2008,(7):136-137.
[14] 蔡炯,许进.肠道菌群与膳食纤维[J].肠外与肠内营养,2002,9(1):52.
[15] Nakao M, Ogura Y, Satake S, et al. Usefulness of soluble dietary fiber for the treatment of diarrhea during enteral nutrition in elderly patients [J]. Nutrition,2002,18(1):35-39.

