原花青素对2型糖尿病局灶性脑缺血大鼠脑组织信号转导及转录激活因子1的影响
宋程光 杨 鑫 闵连秋 刘长喜
1.中国医科大学本溪中心医院神经内科,辽宁本溪 117000;2.辽宁医学院附属第一医院神经内科,辽宁锦州 121001
糖尿病是缺血性脑血管病的独立危险因素,其发生脑梗死的危险性是普通人的2~3 倍[1]。 脑梗死是2型糖尿病最常见的大血管并发症,也是2 型糖尿病患者最常见的死亡原因,其发病后的症状重、预后差、病死率高。 本研究通过检测神经行为学评分,神经细胞数以及STAT1 的表达情况来探讨原花青素(PC)对2型糖尿病局灶性脑缺血的保护作用。
Janus 激酶/信号转导及转录激活因子(JAK/STAT)途径是众多细胞因子信号转导的重要途径,一直是学者们研究的热点。 细胞因子与其受体结合后激活JAK,进一步激活STAT,再诱导其下游的目的基因表达。近来研究表明,JAK/STAT 途径是人体内生理和病理反应的共同传导通路之一,该途径与多种疾病发病及防治密切相关[2-4]。脑缺血时能释放大量细胞因子和生长因子,这些因子能够激活JAK/STAT 信号通路,现已证实脑缺血可以诱导STAT1 蛋白表达增加[5],使JAK/STAT 信号通路激活。STAT1 能抑制细胞生长,介导细胞凋亡过程中的信号传导,并能负性调节cMyc 启动子的表达,参与细胞凋亡的诱导[6]。
本实验研究PC 对2 型糖尿病局灶性脑缺血大鼠脑组织中STAT1 表达的影响,来探讨原花青素对2型糖尿病大鼠局灶性脑缺血的保护作用及其机制,为其临床应用提供理论依据。
1 材料与方法
1.1 材料
SD 大鼠由辽宁医学院动物实验中心提供;PC 由天津尖峰天然产物研究开发有限公司提供(批号:6050804)。 Rabbit Anti-STAT1 蛋白试剂盒、生物素化二抗、DAB 浓缩显色液、DAB 稀释液均由武汉博士德生物试剂公司提供。 胆酸钠、胆固醇由郑州利伟生物实业有限公司提供,链脲佐菌素(STZ)由厦门星隆达化学试剂有限公司提供。
1.2 实验方法
1.2.1 动物分组
SD 大鼠75 只,雌雄各半,随机分为假手术组,2型糖尿病合并脑缺血组,PC 低、中、高剂量组,每组各15 只。 PC 组在建立2 型糖尿病模型后给予灌胃,1 次/24 h,连续1 周,于大脑中动脉缺血(middle cerebral arteryocclusion,MCAO)术前1 h 再灌胃1 次。PC 低、中、高剂量组分别以PC 粉剂50、100、200 mg/(kg·次),蒸馏水配制成悬浮液灌胃。
1.2.2 模型制作
各组均先喂以高脂高糖饲料(10%炼猪油,2.5%胆固醇,20%蔗糖,2%胆酸钠,65.5%普通饲料[7])4 周,诱发出胰岛素抵抗,然后以链脲佐菌素(STZ)小剂量(25 mg/kg)腹腔注射1 次,稳定3 d 后,测定大鼠尾尖血血糖,空腹血糖>16.7 mmol/L 的大鼠判定为2 型糖尿病大鼠。
以线栓法制作MCAO 模型[8-9],大鼠用10%的水合氯醛(0.3 mL/100 mg)腹腔注射麻醉后,暴露并钝性游离左侧颈总动脉(CCA),结扎同侧CCA 近心端和颈外动脉(ECA)分叉部,距CCA 末端约5 mm 处剪口,选用头端烧成光滑杵状的国产尼龙线(直径0.235 mm,长6 cm)插入,以颈总动脉分叉处计算进线深度为(18.0±0.5) mm,至大脑中动脉起始部以完全阻断血供。 模型成功的标志是大鼠即刻出现左侧Horner 征。 排除有蛛网膜下腔出血者。 假手术组除不插入线栓外,其他操作步骤同上。手术过程中,用加热垫和灯泡保持肛温在37.0~37.5℃。
1.2.3 检测指标
1.2.3.1 神经功能缺损评分 MCAO 术后24 h 采用Bederson[10]6 级5 分评分标准进行神经行为学评估,5级0 分:正常(无功能障碍);4 级1 分:对侧上肢不能完全伸展;3 级2 分:向对侧推时抵抗力下降;2 级3 分:提尾时向对侧转圈;1 级4 分:自动转圈;0 级5 分:无自发性活动伴意识障碍。
1.2.3.2 HE 染色 MCAO 术后24 h,大鼠以10%水合氯醛(0.3 mL/100 mg)腹腔注射麻醉,打开颈部,暴露颈右总动脉,插管,先输注生理盐水约50 mL,然后输注4%多聚甲醛约50 mL,断头取脑。 甲醛固定,冠状脑片制备,选择梗死中心(即最大层面),常规酒精脱水,石蜡包埋,制成4~6 μm 厚的切片,附片,行苏木精-伊红(HE)染色:60℃烤箱过夜,二甲苯脱蜡后逐级酒精浸水,苏木精浸染,1%盐酸酒精分色,自来水漂洗,蒸馏水返蓝30 min,镜检使细胞核呈蓝紫色,其余结构基本无色。 伊红染液浸染后蒸馏水洗,逐级酒精脱水,二甲苯透明,中性树胶封片。观察并计数海马区神经细胞。
1.2.3.3 免疫组化法 采用免疫组化法检测缺血侧大脑皮质STAT1 的表达,MCAO 术后24 h,大鼠取脑步骤同HE 染色,取双侧大脑冠状位距嗅球尖端6~11 mm的脑组织块,放入4%多聚甲醛固定液中继续固定24 h,常规梯度脱水、透明、石蜡包埋。 从冠状面中1/3层面开始留取切片,厚度5 μm,连续切片,切片贴附于经APES 处理的载玻片上,备用。 用免疫组化法测定,严格按试剂盒说明书进行操作。
1.3 统计学方法
采用SPSS 11.5 统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 各组神经行为学评分情况
与假手术组比较,2 型糖尿病合并脑缺血组的神经行为学评分明显增高,PC 各剂量组均能改善2 型糖尿病局灶性脑缺血大鼠的神经行为学评分,其中PC 中、高剂量组效果比低剂量组更明显,但PC 中、高剂量组比较,差异无统计学意义(P > 0.05)。 见表1。
表1 各组神经行为学评分情况(分,±s)

表1 各组神经行为学评分情况(分,±s)
注:与假手术组比较,▲P < 0.01;与2 型糖尿病脑缺血组比较,■P <0.05,*P < 0.01;与PC 低剂量组比较,#P < 0.05;PC:原花青素
?
2.2 各组大鼠缺血侧海马区神经细胞计数
PC 各组大鼠缺血侧海马区神经细胞数均明显增多,其中PC 中、高剂量组效果比低剂量组更明显,但PC 中、高剂量组比较,差异无统计学意义(P > 0.05)。见表2。
表2 原花青素对各组大鼠缺血侧海马区神经细胞计数的影响(个/HP,±s)
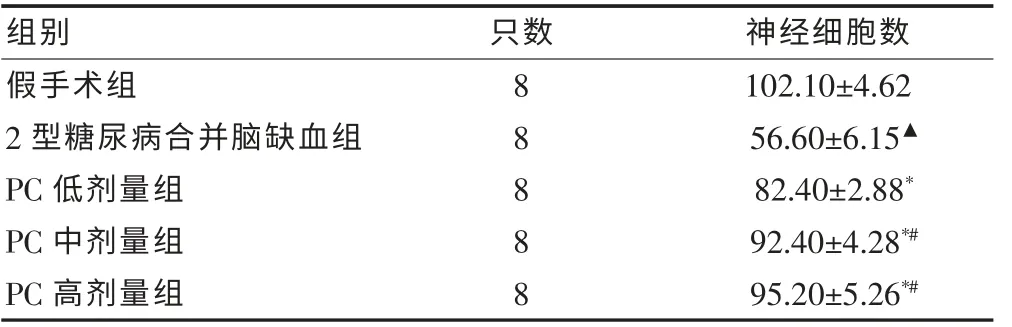
表2 原花青素对各组大鼠缺血侧海马区神经细胞计数的影响(个/HP,±s)
注:与假手术组比较,▲P < 0.01;与2 型糖尿病脑缺血组比较,*P <0.01;与PC 低剂量组比较,#P < 0.01;PC:原花青素
?
2.3 不同剂量PC 对2 型糖尿病局灶性脑缺血大鼠大脑皮质STAT1 阳性细胞表达率的影响
PC 各组均能减少2 型糖尿病局灶性脑缺血大鼠脑组织中STAT1 的含量,其中PC 中、高剂量组效果比低剂量组更明显,但PC 中、高剂量组比较,差异无统计学意义(P > 0.05)。 见表3、图1。
表3 原花青素对各组大鼠缺血侧大脑皮质信号转导及转录激活因子1 阳性细胞表达率的影响(个/HP,±s)

表3 原花青素对各组大鼠缺血侧大脑皮质信号转导及转录激活因子1 阳性细胞表达率的影响(个/HP,±s)
?
注:与假手术组比较,▲P<0.01;与2 型糖尿病脑缺血组比较,*P<0.01;与PC 低剂量组比较,#P < 0.01;PC:原花青素;STAT1:信号转导及转录激活因子1

图1 原花青素各组大鼠缺血侧大脑皮质信号转导及转录激活因子1 阳性细胞表达(SABC×400)
3 讨论
糖尿病对中枢神经系统的影响随着此类患者的增多越来越受到人们的重视。糖尿病除了引起周围神经病变外,还表现出脑血管病发病率升高,糖尿病患者可能会合并其他并发症,如高血压、高脂血症、自主神经病、动脉粥样硬化的加速、血小板黏附和聚集能力升高、红细胞变形能力降低、纤溶活性受损、血黏度高、脑实质内增殖性小血管病等,而且糖尿病缺血性卒中时可以有应激性高血糖的产生,以上因素都加重缺血性脑损伤。
JAK/STAT 通路是一条重要的信号转导途径,它的一个十分重要的作用就是转导细胞因子信号。该途径是一种比较简单的转录化转录调控机制,不需要第二信使,其通过穿膜受体将细胞外多肽信号信息直接传送到核内的靶基因启动子,进而发挥基因转录活化子蛋白与信号转导子的作用[11-13]。
PC 具有降低毛细血管通透性、抗氧化的药理作用[14-15],其含有大量的活性酚羟基,这种化学结构使其具有很强的清除各种活性氧自由基及抗氧化的能力。已有研究证实原花青素可通过清除缺血局部血管内皮细胞的氧自由基和抗氧化作用而应用于治疗和预防心肌缺血-再灌注损伤[16],从药理机制和脑血管病发病机制上看,PC 对缺血性脑血管病应有较好的作用。
近来有研究认为STAT1 有促进凋亡的作用[17-19]。Takagi 等[17]将小鼠STAT1 基因敲除,制备STAT1 基因缺陷小鼠,发现这种小鼠有抗缺血能力,表现为脑梗死面积明显小于野生型小鼠, 并且TUNEL 阳性细胞显著减少,神经功能缺损也明显减轻。为了探索STAT1基因缺陷小鼠抗缺血损伤的具体机制,笔者发现再灌注2 h 后Akt 丝氨酸473 位点磷酸化较野生型小鼠明显,而缺血诱导的c-Jun 氨基末端激酶(JNK)、P38 丝裂原活化蛋白激酶(MAPK)、信号转导及转录激活因子3(STAT3)、细胞外信号调节激酶(ERK)磷酸化在两型小鼠之间的差异并不明显,提示STAT1 可能具有调节Akt 活化的作用。 此外,STAT1 基因缺陷小鼠半光氨酸蛋白酶-3(Caspase-3)的活化明显低于野生型小鼠。 Stephanou 等[20]报道STAT1 可以降低Bcl-2和Bcl-x 的表达,而Bcl-2 和Bcl-x 是脑缺血再灌注损伤中很重要的抗凋亡基因,提示了在脑缺血损害过程中STATl 的促凋亡作用。脑缺血能诱导磷酸化STAT1蛋白活化及核转位,它们通过调节与凋亡和细胞死亡相关蛋白Caspase-3 的转录与磷酸化参与了缺血性脑损伤的过程。
在本研究中,2 型糖尿病局灶性脑缺血组大鼠缺血侧大脑皮质STAT1 表达较假手术组明显增多(P <0.01),说明STAT1 可能在2 型糖尿病合并脑缺血时起到重要作用,推测其机制可能为2 型糖尿病合并脑缺血时能引起大量细胞因子和生长因子的释放,诱导磷酸化STAT1 蛋白活化及核转位,激活JAK/STAT1 信号通路,它们能通过调节与凋亡和细胞死亡相关蛋白Caspase-3 的转录与磷酸化和其他途径参与了缺血性脑损伤的过程,发挥了其促凋亡作用[21]。 PC 各组均能使2 型糖尿病局灶性脑缺血大鼠缺血侧大脑皮质STAT1 表达下调,其中PC 中、高剂量组效果更明显。推测PC 可能通过抑制STAT1 的表达而起到抑制JAK/STAT1 通路,最终抑制了其促凋亡作用,从而起到了对2 型糖尿病局灶性脑缺血大鼠的保护作用。
由于动物和人体有巨大的差异且缺血机制复杂,可能阻断单一环节的药物都不一定奏效[22]。因此对PC的进一步研究,将为治疗糖尿病合并脑梗死提供更为可靠的理论依据。
[1] Capes SE,Hunt D,Malmberg K,et al. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients:a systematic overview [J]. Stroke,2001,32(10):2426-2432.
[2] Klampfer L. Signal transducers and activators of transcription(STATs):Novel targets ofchemopreventive and chemotherapeutic drugs [J]. Curr Cancer Drug Targets,2006,6(2):107-121.
[3] Shouda T,Hiraoka K,Komiya S,et al.Suppression of IL-6 production and proliferation by blocking STAT3 activation in malignant soft tissue tumor cells[J]. Cancer Lett,2006,231(2):176-184.
[4] FolchPuy E,Granell S,Dagom JC,et al. Pancreatitis-associated protein I suppresses NF -kappa B activation through a JAK/STAT-mediated mechanism in epithelial cells [J]. J Immunol,2006,176(6):3774-3779.
[5] 曹贵方,杨期东,袁存国,等.局灶性脑缺血再灌注信号转导与转录激活子1 的表达与磷酸化[J].中国临床康复,2006,10(18):76-78.
[6] Amana CV,Grammatikakis N,Chernov M,et al. Regulation of c-myc expression by IFN-through Stat1 dependent and-independent pathways [J]. EMBO J,2000,19(2):263-272.
[7] 郭啸华,刘志红,李恒,等.高脂高糖诱导的2 型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-294.
[8] 贾玉洁,闵连秋,季占胜,等.原花青素对脑缺血后抑凋亡基因蛋白Bcl-2 和促凋亡基因蛋白Bax 的影响[J].中国临床康复,2006,10(23):65-72.
[9] 李冬果,韩松,刘翠英,等.低氧预适应和大脑中动脉阻塞小鼠脑内差异microRNAs 鉴定[J].北京生物医学工程,2013,32(5):456-462.
[10] Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination [J]. Stroke,1986,17(3):472-476.
[11] Klampfer L.Signal transducers and activators of transcription (STATs):Novel targets of chemopreventive and chemotherapeutic drugs[J].Curr Cancer Drug Targets,2006,6(2):107-121.
[12] Shouda T,Hiraoka K,Komiya S,et al.Suppression of IL-6 production and proliferation by blocking STAT3 activation in malignant soft tissue tumor cells [J]. Cancer Lett,2006,231(2):176-184.
[13] FolchPuy E,Granell S,Dagom JC,et al. Pancreatitis-associated protein I suppresses NF-kappa B activation through a JAK/STAT-mediated mechanism in epithelial cells [J]. J Immunol,2006,176(6):3774-3779.
[14] Yamaguchi F,Yoshimura Y,Nakazawa H,et al. Free radical scavenging activity of grape seed extract and antioxidants by electron spin resonance spectrometry in an H(2)O(2)/NaOH/DMSO system [J]. J Agric Food Chem,1999,47(7):2544-2548.
[15] Sinatra ST,DeMarco J.Free radicals,oxidative stress,oxidized low density lipoprotein (LDL),and the heart:antioxidants and strategies to limit cardiovascular damage [J].Conn Med,1995,59(10):579-588.
[16] Facino RM,Carini M,Aldini G,et al. Diet enriched with procyanidins enhances antioxidants activity and reduces myocardial post-ischaemic damage in rats [J]. Life Sci,1999,64(8):627-642.
[17] Takagi Y,Harada J,Chiarugi A,et al. STAT1 is activated in neurons after ischemia and contributes to ischemic brain injury [J]. J Cereb Blood Flow Metab,2002,22(11):1311-1318.
[18] Chin YE,Kitagawa M,Kuida K,et al.Activation of the STAT signaling pathway can cause expression of caspase 1 and apoptosis [J]. Mol Cell Biol,1997,17(9):5328-5337.
[19] Stephanou A,Scarabelli TM,Brar BK,et al. Induction of apoptosis and Fas receptor/Fas ligand expression by ischemia/reperfusion in cardiac myocytes requires serine 727 of the STAT-1 transcription factor but not tyrosine 701 [J]. J Biol Chem,2001,276(30):28340-28347.
[20] Stephanou A,Brar BK,Knight RA,et al. Opposing actions of STAT-1 and STAT-3 on the Bcl-2 and Bcl-x promoters [J]. Cell Death Differ,2000,7(3):329-330.
[21] 刘冬云,侯云生,王天轶,等.JAK/STAT 信号通路在大鼠缺血再灌注心肌损伤中的表达[J].临床误诊误治,2012,25(5):87-89.
[22] 王拥军.从缺血损害的分子机制到未来神经保护剂的发展方向[J].中华老年心脑血管病杂志,2001,3(4):219-220.

