晚期十二指肠癌化疗的方案和疗效比较
刘俊宝 崔成旭 王金万 张育荣 王 楠 刘 伟 高春会史书萍 汤海舰 邵竹筠 杨婷婷
原发十二指肠肿瘤(primary duodenal carcinoma,PDC)指原发于十二指肠各段的肿瘤,包括腺癌、小细胞癌、鳞癌、腺棘癌、肉瘤、类癌及恶性间质瘤[1]等。其中以腺癌多见,其发病率为0.37/10万[2],占胃肠道恶性肿瘤的0.3%~1.0%,占小肠恶性肿瘤的25%~35%[3-6]。由于发病率低,病例少,迄今为止,晚期PDC姑息化疗无随机对照研究,无标准化疗方案,国外以个案报道较多。Hadano等[7]报道伊立替康联合替吉奥治疗1例复发的PDC患者有效。Okada等[8]应用多西他赛治疗1例肝转移及大量腹水的PDC,2个周期后肝转移及腹水明显好转。Yasui等[9]应用FOLFOX方案治疗1例PDC肺转移患者,获得PR疗效。样本较大的研究来自小肠癌的文献,Overman等[10]的回顾性研究证实铂类联合氟尿嘧啶类方案对转移性小肠癌有效,Koo等[11]研究提示化疗改善转移性小肠癌生存,其中包括十二指肠癌病例。为探讨姑息化疗的效果,本研究对就诊于本院的转移性PDC患者行回顾性分析,现报告如下。
1 材料与方法
1.1 一般资料
选取2002年1月至2012年12月本院收治晚期原发十二指肠癌患者56例,所有患者均经病理证实。化疗病例有可评价的靶病灶,且完成6周以上治疗。收集包括患者的一般特征、肿瘤特征、肿瘤对治疗的反应及生存数据。肿瘤分期采用AJCC标准,组织学分级采用WHO标准:低分化、中分化、高分化及未分化,有两种组织学类型按分化低的计算。
1.2 方法
1.2.1 治疗方法 所有患者化疗前行心电图、生化、血常规及CT检查,6周后行CT检查评价疗效。有效及稳定的病例4周后确认疗效。药物的剂量强度:奥沙利铂85 mg/m2/2w,130 mg/m2/3w;伊立替康180 mg/m2/2w,100 mg/m2d1,8/3w;多西他赛60 mg/m2/3w;吉西他滨1.0 g/m2d1,8/3w;氟尿嘧啶400 mg/m2d1,d2,600 mg/m2d1,d2泵入/2w;卡培他滨1 000 mg/m2每日2次 d1~14/3w;替吉奥80 mg/m2d1~14/3 w;培美曲塞500 mg/m2/3w;贝伐单抗5 mg/kg/2w,7.5mg/kg/3w。
1.2.2 疗效评价 疗效按RECIST实体瘤评价标准,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)及进展(progression disease,PD)。
1.3 统计学方法
将所有数据建立数据库,描述人口统计学特征,对年龄、性别、组织学分级、原发部位、分期、转移部位、原发灶切除、氟尿嘧啶类、铂类为基础的化疗等因素进行单变量及多变量分析,用Kaplan-Meier法进行生存估计及用Log-rank法比较生存曲线;用Cox风险比例模型评估多变量对OS及PFS的影响,采用向后剔除变量法分析;用Fisher确切概率比较化疗方案有效率间的差异,用SAS软件进行分析。检验水准为α=0.05。以P<0.05为差异有统计学意义。
2 结果
2.1 一般特征
入选的患者56例,中位年龄54.5(31~78)岁。男性36例(64.29%),女性20例(35.71%)。 32例行原发灶切除,旁路手术15例,9例未手术病例经胃镜活检确诊(表1)。
原发在十二指肠的肿瘤中,球部4例,降部35例,水平部及升部2例,不明确者15例。肿瘤分级为:高分化6例,中分化31例,低分化10例,分化不详9例。有10例(17.86%)患者病理检测到黏液腺癌组织。
25例为Ⅳ期患者,占44.64%;确诊为Ⅱ~Ⅲ期的31例,占55.36%,后发生进展。其转移部位以淋巴结转移最多见,共39例,占69.64%;其次为肝转移24例,占42.86%;腹膜转移14例,占25%;肺转移及骨转移各10例,各占17.86%。部分患者进行CEA及CA199检测,其中有30.23%患者CEA>10 ng/L,50%患者CA199>80 U/mL 。
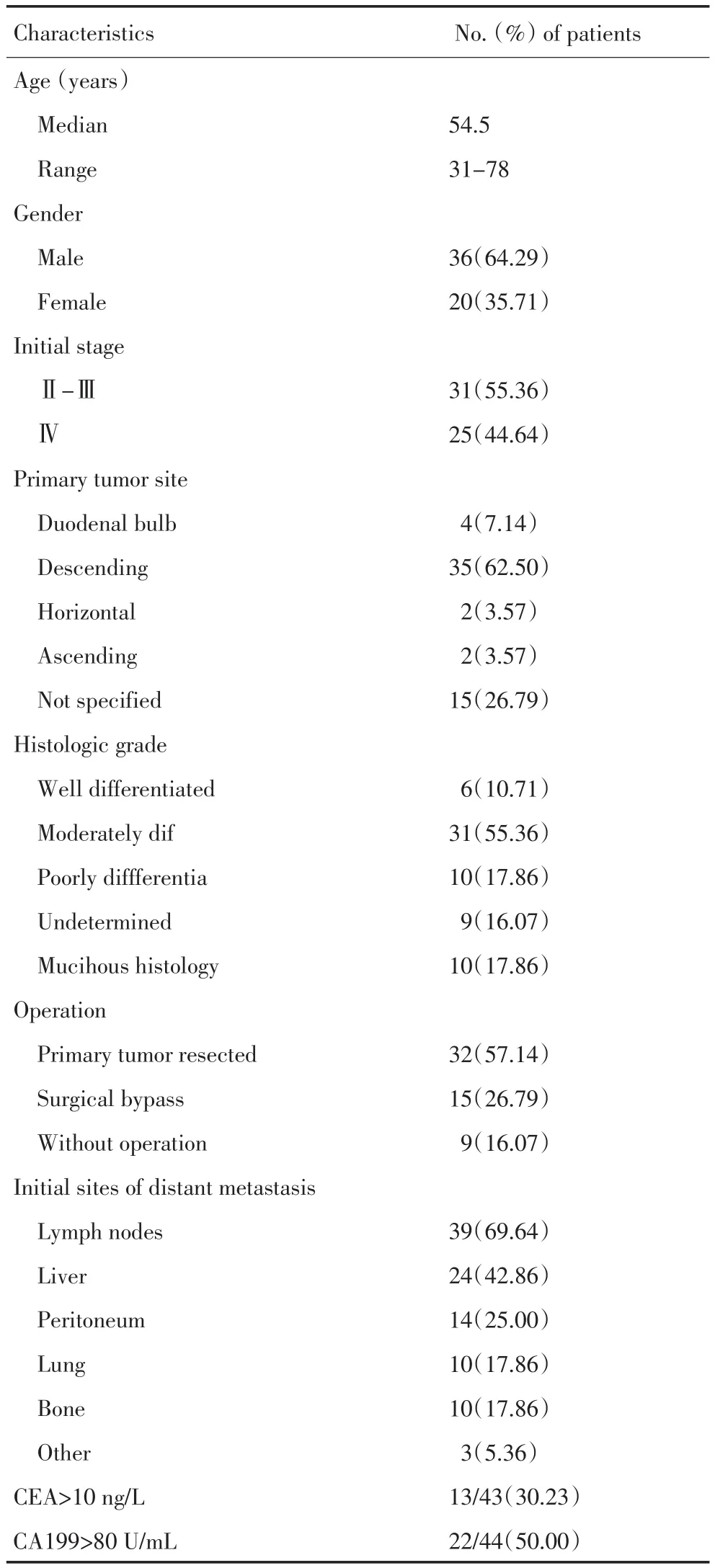
表1 56例晚期原发十二指肠癌患者临床资料及病理特征Table 1 Clinical and pathologic characteristics in 56 patients with advanced primary duodenal cancer
2.2 一线治疗有效率
56例患者中,由于疗效不明确,没有标准方案,有14例患者未接受化疗,42例进行了化疗。化疗患者中8例接受了氟尿嘧啶类为基础而不含铂类方案化疗,其中3例联合吉西他滨,2例联合伊立替康及贝伐珠单抗,1例联合多西他赛,1例联合拓扑替康,1例为氟尿嘧啶类单药。30例接受了含铂类联合氟尿嘧啶类方案化疗,其中顺铂联合氟尿嘧啶3例;奥沙利铂联合氟尿嘧啶(FOLFOX)17例;奥沙利铂联合卡培他滨7例,奥沙利铂联合替吉奥3例。3例接受铂类而无氟尿嘧啶方案化疗,其中2例吉西他滨联合奥沙利铂,1例培美曲塞联合奥沙利铂。1例接受非尿嘧啶非铂类方案,即贝伐珠单抗联合伊立替康方案(表2)。
42例化疗病例总有效率19.04%,无CR病例,8例PR,22例SD,12例PD,疾病控制率71.42%。8例有效的病例中,6例为奥沙利铂联合氟尿嘧啶(FOLFOX)方案,有效率为35.29%,高于其他方案7.69%(P=0.011)。其中1例经手术证明为右心房转移的患者,经FOLFOX方案化疗,疗效PR,行Whipple术,总生存达44个月。
2.3 化疗的远期疗效
入组的56例晚期十二指肠癌患者中,中位生存(OS)11.32个月。接受化疗者中位生存13.35个月,未接受化疗中位生存5.65个月,化疗组中位生存长于未化疗组。化疗组(HR=0.20,95%CI:0.083~0.497,P=0.000 5)。
化疗组无进展生存(PFS)5.0个月,氟尿嘧啶类为基础化疗方案的无进展生存长于其他化疗方案(5.08个月 vs.1.08个月,HR=0.004,95%CI:0.000~0.315,P=0.013 2),而 OS无 差 异(14.13个月 vs.11.17个月,HR=1.051,95%CI:0.45~2.45,P=0.908,表3,图1,2)。
多变量分析影响OS的因素中,有淋巴结转移的患者生存期短于无淋巴结转移的患者(8.42个月vs.10.42个月,HR=3.76,95%CI:1.35~10.42,P=0.01)。病理中含黏液组织(7.25个月vs.12.43个月,HR=3.158,95%CI:1.052~9.481,P=0.04)生存期较短。年龄、性别、发病时分期、分级、原发部位、不同转移部位及进展前是否手术等因素和生存无关(P>0.05)。
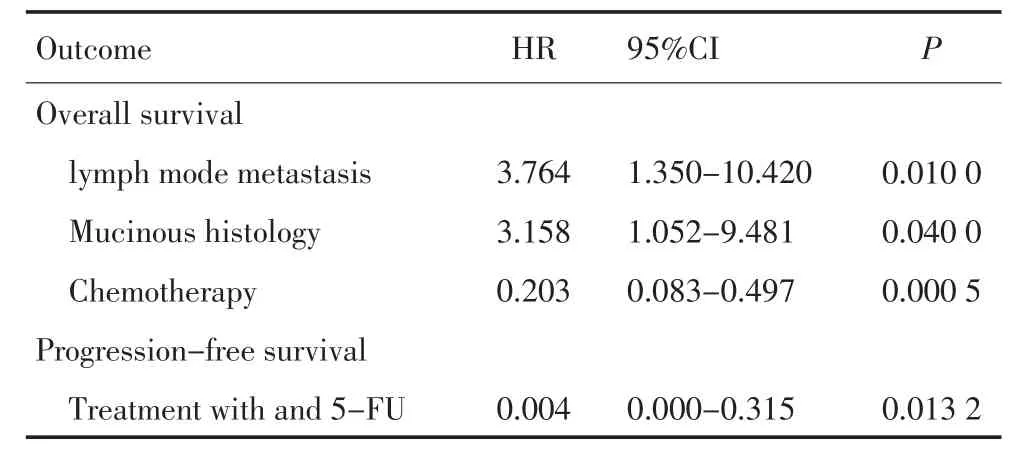
表3 Cox比例风险模型分析生存影响因素Table 3 Cox proportional hazard for survival

图1 56例晚期原发十二指肠癌总生存曲线Figure 1 Kaplan-Meier survival analysis of OS
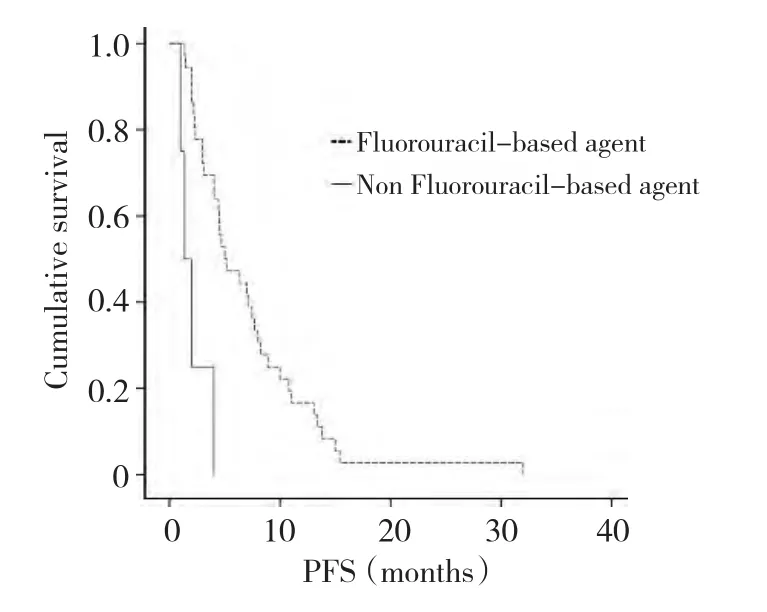
图2 56例晚期原发十二指肠癌无进展生存曲线Figure 2 Kaplan-Meier survival analysis of PFS
2.4 二、三线化疗
本组有17例进行了二、三线化疗,其中有11例应用伊立替康为基础的化疗,其中9例联合氟尿嘧啶类,1例联合吉西他滨,1例联合培美曲塞;5例以紫杉类为基础联合方案,联合顺铂3例,联合吉西他滨1例,联合替吉奥1例;1例为吉西他滨联合顺铂方案。其中PR 1例,SD 6例,PD 10例,有效率5.8%,有效病例接受了伊立替康联合卡培他滨方案化疗。
3 讨论
十二指肠癌是小肠癌中最常见的,其发病率低,临床上少见,迄今为止,无大样本、多中心、随机对照临床试验,化疗的作用不明确,没有标准化疗方案。各国学者积极探索姑息性化疗的作用,筛选有效的化疗方案。Overman等[10]研究发现,氟尿嘧啶类联合铂类方案化疗可延长小肠癌患者的无进展生存期。本研究发现,同未化疗者相比,化疗显著改善晚期原发十二指肠癌患者的生存(13.35个月vs.5.65个月),延长生存期7.7个月。Koo等[11]研究亦发现化疗延长小肠癌患者生存期(11.8个月vs.5.7个月),其中十二指肠癌占78%,与本研究结果一致,表明化疗改善晚期十二指肠癌患者的预后。
由于十二指肠组织来源同胃、结肠相似,十二指肠癌化疗多借鉴结肠癌及胃癌的方案。本研究化疗有效率19.04%,而疾病控制率71.43%,有70%的患者从化疗中获益。其中有30例患者应用铂类联合氟尿嘧啶类化疗,占69.7%,其中氟尿嘧啶联合奥沙利铂方案(FOLFOX)一线治疗转移性十二指肠癌有效率高于其他方案(RR:35.29%vs.3.84%,P=0.01),但PFS(7.61个月 vs.5.95个月,P=0.393)及OS(11.98个月 vs.11.70个月,P=0.306)无优势。Zaanan等[12]研究证实FOLFOX方案有效率34.2%,也有研究同样证实FOLFOX方案有效率超过30%[13-14],与本研究相似。本组研究发现应用氟尿嘧啶为基础的方案同其他比较延长PFS(5.08个月vs.1.08个月),但未改善OS。可能为样本量相对较少,检验效能低,宜扩大样本量进一步研究。
多因素分析显示,淋巴结转移及病理检测存在黏液腺癌组织是十二指肠癌的独立预后因素。本研究中淋巴结转移的患者39例,占69.64%,其中位生存期8.4个月,短于无淋巴结转移的10.42个月(HR=3.76,95%CI:1.35~10.42,P=0.01),同Koo等[11]结果一致,表明有淋巴结转移的患者预后不良。病理检测存在黏液腺癌组织是胃肠道肿瘤的预后不佳因素,研究发现具有较强黏液分泌功能的黏液腺癌侵袭能力强,淋巴结转移及远处转移率高[15-16],且化疗有效率低、生存期短[17]。本研究中病理检测具有黏液腺癌组织的患者10例,OS 7.25个月,明显低于无黏液腺癌组织者12.43个月,表明病理检测含有黏液腺癌组织是原发性十二指肠癌预后不良因素,可能与黏液腺癌组织的侵袭力强,转移率高及对化疗反应率低等因素有关。而年龄、性别、发病时分期、分级、原发部位、不同转移部位及进展前是否手术等因素和生存无关。
贝伐珠单抗联合化疗可延长结肠癌的生存期[18]。本研究有7例患者应用贝伐珠单抗联合化疗,其中1例联合FOLFOX方案,疗效PR,其余联合伊立替康或FOLFIRI方案均为稳定(SD),未延长生存期(11.33个月vs.11.32个月),可能因为十二指肠癌中VEGF表达较少,亦可能为样本量小,宜扩大样本量继续研究。
原发在十二指肠降部的肿瘤最多,占62.50%。肿瘤的分化程度以中分化为主,占55.36%。十二指肠癌转移以淋巴结转移为主,转移率69.64%,其次为肝转移,转移率42.86%,单因素及多因素分析显示原发部位及转移部位和预后无关。
转移性十二指肠癌二、三线化疗以往报道的资料较少,Overman等[10]报道的小肠癌二线、三线有效率11%,有效的药物有伊立替康、铂类及吉西他滨,Zaanan等[19]研究显示含铂类化疗方案一线治疗失败后FOLFIRI二线化疗的有效率20%。本组有17例患者进行了二、三线化疗,多数是伊立替康为基础的联合化疗方案,有1例伊立替康联合卡培他滨有效,有效率5.88%,低于上述研究结果,宜进一步临床研究。本研究的样本量较大,但设计为回顾性研究,患者的选择为单中心,病例的选择及相关结果可能存在一定的偏倚,需进一步深入探索。
由此可见,姑息性化疗可能提高晚期原发十二指肠癌患者的总生存;氟尿嘧啶类为基础的化疗方案可能延长无进展生存;FOLFOX方案是晚期十二指肠癌化疗的较优选择;淋巴结转移及病理含有黏液腺癌组织可能是晚期原发十二指肠癌的独立预后因素。
1 Chang JC,Liu Y,Wang RX.Pathology of primary duodenal cancer and its related clinical problems[J].Chinese Journal of Clinical Oncology,1999,26(8):574-576[.常家聪,刘 戈,王瑞祥.原发性十二指肠癌病理观察与临床相关问题的探索[J]中国肿瘤临床,1999,26(8):574-576.]
2 Qubaiah O,Devesa SS,Platz CE,et al.Small intestial cancer:a population-based study of incidence and survival patterns in the united states,1992 to 2006[J].Cancer epidemiol Biomarkers Prev,2010,19(8):1908-1918.
3 Sohn TA,Lillemoe KD,Cameron JL,et al.Adenocarcinoma of the duodenum:factors influencing long-term survival[J].J Gastrointest Surg,1998,2(1):79-87.
4 Bucher P,Gervaz P,Morel P.Long-term results of radical resection for locally advanced duodenal adenocarcinoma[J].Hepatogastroenterology,2005,52(66):1727-1729.
5 Rose DM,Hochwald SN,Klimsra DS,et al.Primary duodenal adenocarcinoma:a ten-year experience with 79 patients[J].J Am Coll Surg,1996,183(2):89-96.
6 Bakaeen FG,Murr MM,Sarr MG,et al.What prognostic factors are important in duodenal adenocarcinoma[J]?Arch Surg,2000,135(6):635-641.
7 Hadano N,Imamura Y,Nakamitsu A,et al.A case report of primary duodenal adenocarcinoma responding to chemotherapy with S-1 and irinotecan[J].Gan To Kagaku Ryoho,2011,38(4):667-671.
8 Okada A,Hata M,Taeda Y,et al.A case of liver metastasis of primary duodenal cancer effectively treated with docetaxel therapy[J].Gan To Kagaku Ryoho,2013,40(11):1541-1544.
9 Yasui T,Mukubo H,Nakanuma S,et al.A case of recurrent duodenal carcinoma successfully controlled with FOLFOX treatment[J].Gan To Kagaku Ryoho,2013,40(12):1726-1728.
10 Overman MJ,Kopetz S,Wen S,et al.Chemotherapy with 5-Fluorouracil and a platinum compound improves outcomes in metastatic small bowel adenocarcinoma[J].Cancer,2008,113(8):2038-2045.
11 Koo DH,Yun SC,Hong YS,et al.Systemic chemotherapy for treatment of advanced small bowel adenocarcinoma with prognostic factor analysis:retrospective study[J].BMC Cancer,2011,11:205-210.
12 Zaanan A,Costes L,Gauthier M,et al.Chemotherapy of advanced small-bowel adenocarcinoma:a multicenter AEGO study[J].Ann Oncol,2010,21(9):1786-1793.
13 Xiang XJ,Liu YW,Zhang L,et al.A phaseⅡstudy of modified FOLFOX as first-line chemotherapy in advanced small bowel adenocarcinoma[J].Anticancer Drugs,2012,23(5):561-566.
14 Zhang L,Wang LY,Deng YM,et al.Efficacy of the FOLFOX/CAPOX regimen for advanced small bowel adenocarcinoma:a three-center study from China[J].J BUON,2011,16(4):689-696.
15 Yamamoto S,Mochizuki H,Hase K,et al.Assessment of clinicopathologic features of colorectal mucinous adenocarcinoma[J].Am J Surg,1993,166:257-261.
16 Suma KS,Nirmala V.Mucinous component in colorectal carcinoma-prognostic significance:A study in a south Indian population[J].J Surg Oncol,1992,51(1):60-64.
17 Catalano V,Loupakis F,Graziano F,et al.Mucinous histology predicts for poor response rate and overall survival of patients with colorectal cancer and treated with first-line oxaliplatin-and/or irinotecan-based chemotherapy[J].Br J Cancer,2009,100(6):881-877.
18 Hurwitz H,Fehrenbacher L,Novotny W,et al.Bevacizumab plus irinotecan,fluorouracil,and leucovorin for metastatic colorectal cancer[J].N Engl J Med,2004,350(23):2335-2342.
19 Zaanan A,Gauthier M,Malka D,et al.Second-line chemothearpy with fluorouracil,leucovorin,and irinotecan(FOLFIFI regimen)in patients with advanced small bowel adenocarcinoma after failure of first-line platinum-based chemotherapy a milticenter AGEO study[J].Cancer,2011,117(7):1422-1428.

