STAT4基因缺失增强髓系抑制性细胞动员促进小鼠炎症相关肠癌的发生
邹渭洪,付成效,秦旭平
(1.南华大学附属第一医院药剂科,湖南 衡阳 421001;2.南华大学药物药理研究所)
结直肠癌是全球最常见的恶性肿瘤之一,其发病率和死亡率均位于全部肿瘤的第三位,国内结直肠癌的发病率和死亡率分别位于全国城市肿瘤的第二位和第四位。遗传因素、膳食结构的变化、肥胖人群的显著增多、恶劣的环境条件以及人口的老龄化等是结直肠癌发病相关的多种危险因素。炎症和免疫细胞在消化道肿瘤的发生、发展中发挥着重要的作用,但是作用机制仍不清楚[1-2]。文献报道内源性组胺缺失促进小鼠骨髓和脾脏内CD11b+Gr-1+不成熟髓系细胞的增殖和动员,促进小鼠结肠癌的发生[3]。但是,组胺调控不成熟髓系细胞增殖、动员和分化,参与肠癌发生的机制是否与信号转导与转录激活因子4(transducer and activator of transcription 4,STAT4)有关,尚缺乏证据。因此,本研究建立STAT4基因敲除(STAT4-/-)小鼠肠癌模型,探索STAT4信号通路在髓系细胞增殖、动员和炎症相关肠癌中的作用,为肿瘤发病机制和防治提供新思路。
1 材料与方法
1.1 实验动物
雄性STAT4-/-小鼠和野生型(WT)BaL b/c小鼠每组各20只,8~10周龄,购于南京大学模式动物研究所。
1.2 主要仪器与试剂
氧化偶氮甲烷(Azoxymethane,AOM,Sigma公司);硫酸葡聚糖(Dextran Sulfate Sodium,DSS,分子量为36KD~50KD,MP,Biomedicals,CAT.160110)。荧光显微镜(日本Olympus公司);FACScan流式细胞仪(美国Becton Dickinson公司)。
1.3 方法
1.3.1 小鼠结肠癌模型的建立 氧化偶氮甲烷(Azoxymethane,AOM)是一种特异的引起肠道上皮细胞基因突变的化学试剂,硫酸葡聚糖(DSS)可以引起小鼠的急性溃疡性结肠炎[4]。8~10周龄的雄性STAT4-/-小鼠和WT小鼠,每组各20只。实验组STAT4-/-和WT小鼠(各10只)首先腹腔注射一次AOM(12 mg/kg体重),在AOM注射后一周,给予含3%DSS的饮用水,7天后更换为正常饮用水。对照组STAT4-/-和WT小鼠(各10只)给予一次200 μL PBS腹腔注射,饮用水为消毒纯净水。然后,分别在AOM+DSS处理后早期(10周)和晚期(20~24周)检测小鼠肠道中肿瘤的数目和大小(肿瘤直径≥3 mm为大肿瘤,<3 mm为小肿瘤)。肠癌病变组织HE染色后的进行病理分析,包括结肠肿瘤的病理分型和炎性细胞浸润评分。
1.3.2 流式细胞术(FACS)分析免疫细胞亚群 麻醉处死小鼠,收集外周抗凝血、脾脏和骨髓细胞。方法简述如下:抽取外周血约800 μL,抗凝处理,采用红细胞裂解液(RBC Lysis Buffer,BD)裂解红细胞备用;脾脏组织剪取小块(黄豆大小),在存在BD的40 μm滤网上研磨后,PBS冲洗收集;随后分离股骨,采用含2%胎牛血清的PBS冲洗骨髓腔,经40 μm滤网过滤收集洗脱液。细胞计数后(1×106cell/100 μL),分别加入CD11b、Gr-1、Ly6C、Ly6G等荧光标记抗体(BD Bioscience公司)。FACS检测骨髓、脾脏和外周血CD11b+Gr-1+MDSCs、单核系(CD11b+Ly6C+)的百分比变化,进行固有免疫细胞动员分析。
1.4 统计学分析
实验数据用均数±标准差表示,每组样本数(n)为5,统计分析采用应用SPSS 13.0软件进行t检验,以P<0.05为差异具有显著性。
2 结 果
2.1 小鼠结肠癌模型的建立和STAT4基因缺失对肠癌发生的影响
STAT4-/-和WT组小鼠在早期和晚期的肠道病变如图1所示,在AOM和DSS共同处理10周(早期),STAT4-/-小鼠可以在结肠的中下段和肛门处发现直径在1~2 mm的肠瘤样病变(或肠上皮异常增生),而对照的WT小鼠只能发现在结肠的中下段和肛门处有炎性病变和上皮组织增生。在20周(晚期),STAT4-/-小鼠可以在结肠的中下段和肛门处发现直径在3~5 mm的大型肠瘤样病变,较对照组WT小鼠的肿瘤数量和大小均明显增多。对肿瘤组织的病理分析显示(图2),STAT4-/-小鼠的肠瘤的上皮组织分化程度较低,肠道上皮特有的杯状细胞(goblet cell)较WT小鼠的肠瘤组织明显减少。实验结果显示,STAT4基因缺失,可以显著增强STAT4-/-小鼠对AOM和DSS诱导肠癌发生的敏感性和促进肿瘤生长。
2.2 STAT4基因缺失增强损伤组织的炎症反应
为了研究STAT4信号通路在DSS引起的溃疡性肠炎中的作用,我们检测了小鼠引用DSS水7天后肠道的早期炎症反应。小鼠出现体重减轻、腹泻、血便等急性肠炎的表现。如图3病理学切片HE染色发现所示,STAT4-/-小鼠的结肠中下段上皮水肿,小鼠病变结肠上皮组织腺体结构紊乱,黏膜和黏膜下有大量单核细胞和中性粒细胞浸润。这提示STAT4缺失不仅促进固有免疫细胞的动员和分化,而且可以促进免疫细胞对肠道损伤组织的浸润,加重炎症反应。
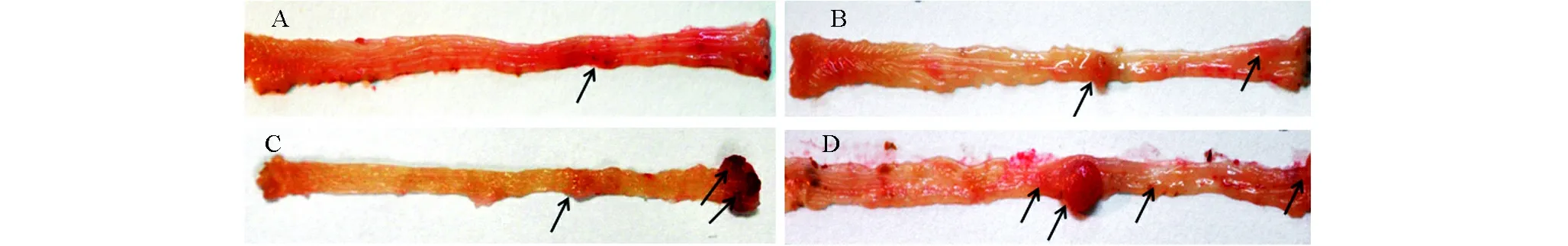
图1 大体解陪显示STAT4基因缺失促进结肠肿瘤的发生和发展
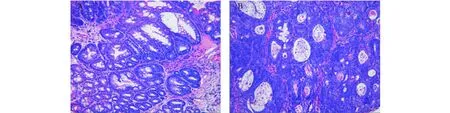
图2 HE组化染色显示瘤变组织中作为上皮分化标识的杯状细胞(×200)
2.3 STAT4缺失促进髓系抑制性细胞MDSCs的分化和动员
应用髓系细胞标识CD11b和中性粒细胞标识Gr-1+鉴别髓系免疫细胞。如图4流式分析结果所示,CD11b+Gr-1+MDSCs在STAT4-/-小鼠的外周血较对照组WT小鼠显著增加(外周血6.8±2.1% vs 2.2±0.3%,P<0.05)。脾脏和骨髓内的百分比较WT小鼠均增加(脾脏3.2±1.1% vs 2.6±0.5%;骨髓48±12% vs 39±9.1%,P<0.05)。
3 讨 论
肠癌的发生与反复迁延的肠道慢性炎症(目前也常称作非可控性炎症)有密切关系,但是对于炎症反应和免疫细胞在结肠肿瘤发生、发展中的作用机制尚未完全阐明[5]。建立高效、稳定的、与炎症相关的小鼠肠癌实验动物模型,将为阐明炎症反应和免疫细胞在肠道肿瘤的发生、发展中的作用及分子机制,为探索、开发抗肿瘤相关药物,提供高效的研究分析平台。氧化偶氮甲烷(AOM)是一种特异的引起肠道上皮细胞基因突变的化学试剂,其病变主要发生在结肠。硫酸葡聚糖(DSS)可以引起小鼠的溃疡性结肠炎。已有研究表明,不同分子量的DSS所诱导的肠炎病变特征不同,如分别用5KD,40KD和500KD分子量的DSS喂养小鼠,结果典型结肠炎病变只出现于5KD组和40KD组,50KD组的病变主要见于盲肠和上段结肠。DSS结肠炎的严重度并不完全依赖于DSS摄入总量,而主要是由DSS浓度决定[4]。在本研究中,我们应用AOM和DSS处理STAT4-/-小鼠,建立了高效、敏感的炎症相关小鼠结肠癌模型。此外,我们在预实验也发现小鼠不同种属对于DSS的敏感度不一,Balb/c小鼠较C57/B6小鼠对AOM和DSS刺激更敏感,成瘤率更高。
STAT分子家族是一类有着共同重要功能特点的转录因子,其分子结构特点有:一个N基末端的STAT二聚化结构域、一个DNA结合域、一个Src同源结构域(SH2)、一个保守的酪氨酸残基和一个C基末端的反式激活结构域[6-7]。目前已经被证实的STAT家族成员有7个,分别是STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6。研究发现STAT4是T淋巴细胞、NK细胞、树突状细胞和巨噬/枯否细胞等免疫调控细胞内IL-12/STAT4/IFN-γ信号传导途径的关键组成元件,是IL-12诱导免疫调控细胞产生IFN-γ的关键调控因子[7]。在STAT4-/-小鼠,IL-12诱发的所有主要的T细胞和NK细胞功能反应均明显减弱,其中包括IFN-γ产生减少与Th1型反应减弱,而STAT4的这一作用有可能是通过p38MAPK途径介导的[8]。但是当前对STAT家族在固有免疫细胞增殖和分化中的作用及分子机制研究尚有待加强和深入。

图3 HE组化染色显示STAT4基因缺失促进大量免疫细胞浸润炎症组织(×200)
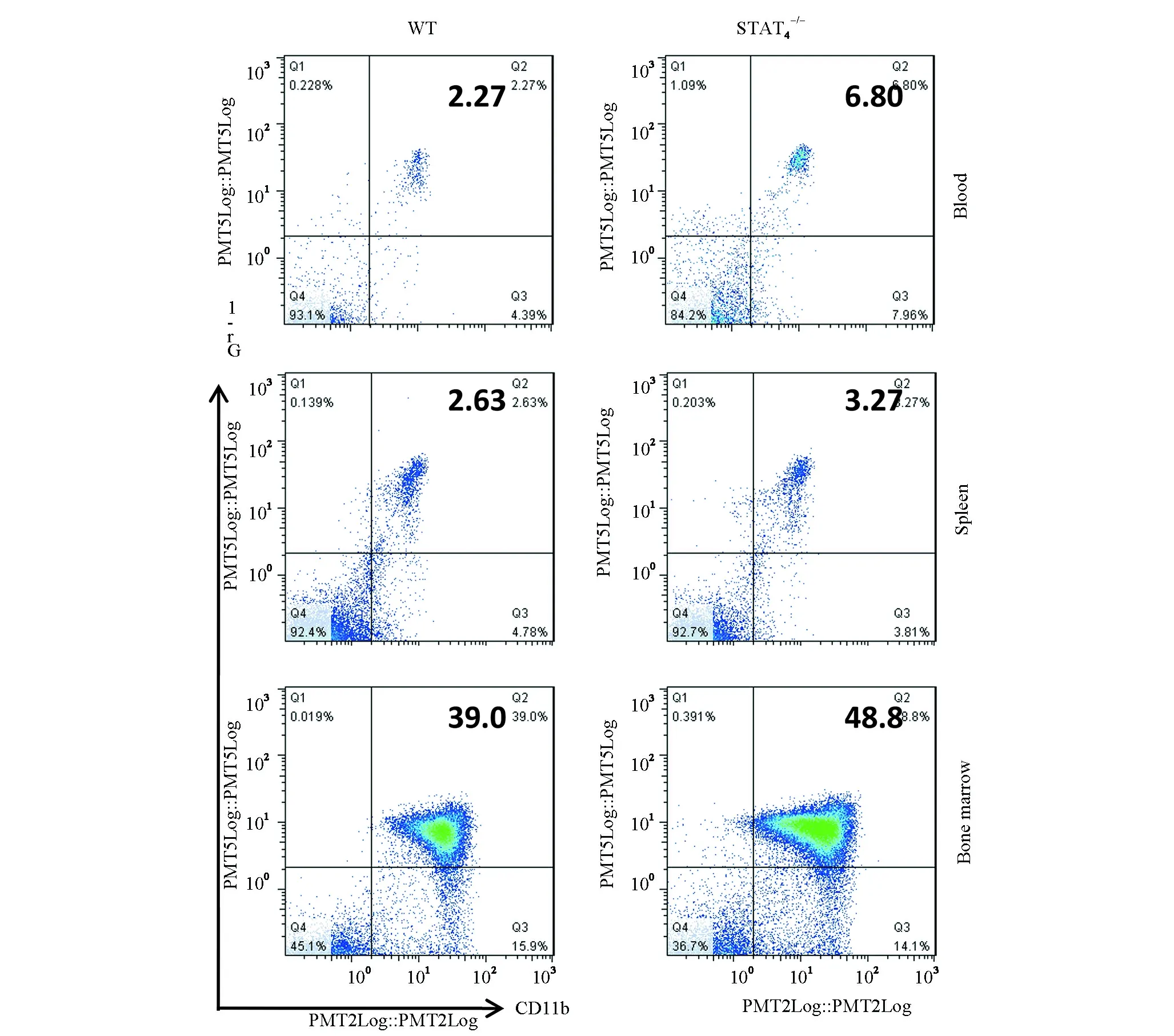
图4 流式细胞分析检测CD11b+Gr-1+MDSCs在外周血、脾脏和骨髓的表达(FACS代表图)
髓系抑制性细胞MDSCs(小鼠的常用细胞标识为CD11b+Gr-1+,而人的CD14+CD33+CD11b+)是来源于骨髓的一大类异构细胞的总称,包括单核系、粒系细胞和髓系前体细胞,具备向中性粒细胞、单核/巨噬细胞或者树突状细胞分化的能力[9]。CD11b+Gr-1+MDSCs在急慢性感染、自身免疫疾病和肿瘤发生中发挥了重要作用[10]。我们的研究进一步揭示STAT4在CD11b+Gr-1+MDSCs有较高水平的表达;STAT4缺失促进MDSCs的增殖和动员,增强由DSS引起的肠道炎症反应。研究发现[3],小鼠骨髓和脾脏有大量的CD11b+Gr-1+不成熟髓系细胞(immature myeloid cells,IMCs),与MDSCs具有一样的细胞表面识别标识。这些不成熟髓系细胞与炎症相关的小鼠结肠癌和皮肤癌的发展密切相关,其向巨噬细胞的分化与内源性组胺的表达有关[11-12]。最近的研究发现,在MDSCs的发育中,STAT/IRF-8轴扮演着重要的角色。我们研究证实STAT4缺失促进肠癌的发展,与STAT4信号通路调节MDSCs的增殖、分化和动员有关。STAT4信号通路与组胺信号通路是否存在“对话”(cross talk)还有待更多的研究[13]。
综上所述,本研究应用STAT4基因敲除小鼠,通过AOM+DSS处理诱导建立了一种敏感的炎症相关结肠癌实验动物模型,揭示了STAT4信号通路在CD11b+Gr-1+MDSCs增殖、分化和动员中的作用;STAT4缺失导致的信号阻抑显著增强小鼠炎症相关结肠肿瘤的发生和发展。以STAT4信号通路及其上下游调控因子为靶标,可能为结肠肿瘤的发生机制和药物开发研究提供新的靶点。
[1]Fridlender ZG,Sun J,Kim S,et al.Polarization of tumor-associated neutrophil phenotype by TGF-beta:“N1” versus “N2” TAN[J].Cancer Cell 2009,16(3):183-194.
[2]Youn JI,Nagaraj S,Collazo M,et al.Subsets of myeloid-derived suppressor cells in tumor-bearing mice[J].J Immunol,2008,181(8):5791-5802.
[3]Yang XD,Ai W,Asfaha S,et al.Histamine deficiency promotes inflammation-associated carcinogenesis through reduced myeloid maturation and accumulation of CD11b+Ly6G+immature myeloid cells[J].Nat Med,2011,17(1):87-95.
[4]Tanaka T,Kohno H,Suzuki R,et al.A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate[J].Cancer Sci,2003,94(11):965-973.
[5]Ullman TA,Itzkowitz SH.Intestinal inflammation and cancer[J].Gastroenterology,2011,140(6):1807-1816.
[6]Pfitzner E,Kliem S,Baus D,et al.The role of STATs in inflammation and inflammatory diseases[J].Curr Pharm Des,2004,10(23):2839-2850.
[7]Morinobu A,Gadina M,Strober W,et al.STAT4serine phosphorylation is critical for IL-12-induced IFN-gamma production but not for cell proliferation[J].Proc Natl Acad Sci USA,2002,99(1):12281-12286.
[8]Visconti R,Gadina M,Chiariello M,et al.Importance of the MKK6/p38 pathway for interleukin-12-induced STAT4serine phosphorylation and transcriptional activity[J].Blood,2000,96(5):1844-1852.
[9]Bronte V.Myeloid-derived suppressor cells in inflammation:uncovering cell subsets with enhanced immunosuppressive functions[J].Eur J Immunol,2009,39(10):2670-2672.
[10]Peranzoni E,Zilio S,Marigo I,et al.Myeloid-derived suppressor cell heterogeneity and subset definition[J].Curr Opin Immunol,2010,22(2):238-244.
[11]Swirski FK,Nahrendorf M,Etzrodt M,et al.Identification of splenic reservoir monocytes and their deployment to inflammatory sites[J].Science,2009,325 (5940):612-616.
[12]Wang KY,Tanimoto A,Guo X,et al.Histamine deficiency decreases atherosclerosis and inflammatory response in apolipoprotein E knockout mice independently of serum cholesterol level[J].Arterioscler Thromb Vasc Biol,2011,31 (4):800-807.
[13]Jutel M,Klunker S,Akdis M,et al.Histamine upregulates Th1 and downregulates Th2 responses due to different patterns of surface histamine 1 and 2 receptor expression[J].Int Arch Allergy Immunol,2001,124(1-3):190-192.

