哮喘豚鼠气道TGF-β1重塑及黄芪的干预研究
张满燕,熊 花,陆 煜,刘 鑫
(1.南华大学附属第一医院呼吸内科,湖南 衡阳 421001;2.南华大学附属第一医院急诊科;3.南华大学附属第一医院中医科)
气道重塑为哮喘的主要病理学特征之一,气道重塑可加重气道高反应性,导致肺功能持续性与进行性损害,其一旦形成就很难逆转,因此防治气道重塑是哮喘治疗的重点。近年来研究显示,哮喘病人被募集到呼吸道的炎性细胞都表达和分泌TGF-β1[1],TGF-β1是致呼吸道重塑的重要细胞因子之一[ 2-5 ]。
黄芪作为传统中药,能显著调节和增强细胞免疫功能,也可调节人体细胞亚群的平衡,起加强呼吸道反复感染细胞免役功能作用,而且使用安全,不良反应小[6],但是否对气道重塑有影响不清楚。鉴于此,本研究以豚鼠哮喘模型为研究对象,以气道上皮组织中TGF-β1的表达作为观察指标,进而阐明黄芪的平喘机制是否与TGF-β1的表达下调有关。
1 材料与方法
1.1 动物、试剂与仪器
健康清洁级(SPF)雄性豚鼠40只(由南华大学动物实验部提供),12周龄左右,体重(400±50)g。卵蛋白(OVA)(美国Sigma公司),NGF-β抗体(博奥森生物技术有限公司),黄芪注射液(成都地奥九泓制药公司生产批准文号国药准字Z51021776),地塞米松注射液(天津药业焦作有限公司批准文号国药准字H41020036),JSC-OK 超声波雾化器(辽宁省鞍山市电子医疗仪器厂),自制封闭雾化吸入箱。氢氧化铝AI(OH)3、NGF多克隆兔抗大鼠抗体、羊抗兔二抗、DAB显色剂(博奥森生物技术有限公司)。图像分析仪(重庆天海公司Q/TH03—1999)。
1.2 动物分组、模型制备及标本采集
豚鼠随机分为4组:对照组、哮喘模型组、黄芪注射液组、地塞米松组。适应喂养一周后,对照组不予任何处理,其他三组在第1天和第8天腹腔注射OVA(1mg)/AL(OH)3(100 mg)混合液1 mL致敏,第15天开始以1%OVA雾化激发,每次30 min,隔天一次,共8周。每次激发前30 min,哮喘模型组、黄芪注射组、地塞米松组分别给予生理盐水2 mL、地塞米松1.0 mg/kg、黄芪12 g/kg灌胃[7]。抗原激发后,以豚鼠出现呼吸增快,点头呼吸,躁动,唇发绀、四肢无力、行动迟缓或俯伏不动等代表模型复制成功。模型复制成功后,末次激发2 h内每只腹腔内注射10%水合氯醛2 mL处死大鼠,开胸迅速取左肺置于液氮中保存,用于提取mRNA;取右肺置于10%多聚甲醛中固定,用于HE染色及免疫组化。动物处理:哮喘豚鼠于末次雾化吸入24 h后,以1 000 u/mL肝素钠腹腔注射抗凝,水合氯醛(0.8g/ kg) 腹腔注射麻醉,无菌开胸穿刺心脏取血处死豚鼠,迅速取左肺置于液氮中保存,用于提取mRNA;取右肺置于10%多聚甲醛中固定,用于HE染色及免疫组化。
1.3 肺组织病理HE染色
通过气管插管导管(由中心静脉导管改成)灌注10%中性甲醛使肺叶充分膨胀,肺组织置于10%中性甲醛中固定24 h以上,常规石蜡包埋,切片行HE染色。
1.4 气道形态学分析
采用图像分析软件,测定气管腔的内周长(Pi)、管壁面积(WA)、外周长(Pe)、气道平滑肌的面积、气道平滑肌细胞核数(N),用管腔的内周长(Pi)进行标准化,分别以WA/Pi、气道平滑肌的面积/Pi、N/Pi表示。肺组织切片在光学显微镜下放大 200 倍,每张切片均选取上、中、下3个视野中完整的小支气管[500 μm < 支气管基底膜周径(Pbm)< 1 500 μm],采用图像采集系统获取图像后,用医学图像分析软件测定支气管基底膜周径(Pbm) 、总管壁面积(Wat) 、内管壁面积(Wai) 、气道平滑肌面积(Wam) ,将测得的后3个值除以 Pbm 进行标化,分别代表总管壁标化厚度(Wat/ Pbm) 、内管壁标化厚 度 (Wai/ Pbm) 、平 滑 肌 标 化 厚 度 (Wam/Pbm)(见表1)。
1.5 免疫组化检测气道中TGF-β1蛋白的表达
TGF-β1蛋白表达采用链霉亲和素-生物素-酶(SABC)免疫组化染色法测定。豚鼠肺组织标本石蜡包埋组织切片常规脱蜡,抗原沸热修复,3%H2O2消除内源性过氧化物酶,山羊血清封闭非特异性抗原,加一抗TGF-β1单克隆抗体4 ℃冰箱过夜,第二天切片恢复室温后,依次加生物素标记的二抗及链霉素抗生物素蛋白-过氧化物酶溶液,DAB显色,苏木精衬染,梯度乙醇脱水,二甲苯透明封片,用已知阳性片做阳性对照,同时用PBS代替一抗为阴性对照。胞膜或胞浆内有棕黄色颗粒且着色明显高于背景者为阳性。免疫组化结果在 400 倍视野下,每张玻片随机取 10 个视野,用BLTS2080病理图象采集系统和Image Pro Plus 5.02专业图像分析软件,分别测定阳性颗粒的平均光密度值,进行分析处理。
1.6 统计学处理
所有统计学分析均采用 SPSS18.0 统计软件进行分析。计量资料以均数±标准差表示,统计学分析采用方差分析法,统计学检测P<0.05具有统计学意义。
2 结 果
2.1 气道形态学变化
对照组气道上皮完整,杯状细胞少见,支气管、细支气管管壁平滑肌层较薄,黏膜皱襞矮平,肺泡间隔正常,炎性细胞浸润少见。哮喘组气道壁结构发生改变,杯状细胞增生,气道平滑肌增殖,支气管管腔变窄,气道上皮细胞脱落,平滑肌增生肥大,支气管周围和黏膜层及肺泡壁Eos明显增多, 肺泡间隔增厚,管腔可见粘液栓,表现出气道慢性炎症特征和非特异性的气道高反应性。黄芪治疗组和地塞米松治疗组经治疗后,其改变基本接近对照组,同哮喘组相比,支气管以及肺泡区炎性细胞浸润明显减少,肺泡隔明显变薄,肺泡腔变大,支气管管壁增厚和管腔狭窄均减轻(图1)。
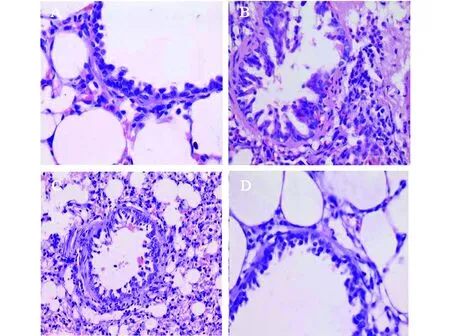
图1 气道形态学变化(HE染色×400)
2.2 气道重塑图像分析
图像分析结果表明,哮喘组气道壁厚度(WA/Pi)、气道平滑肌厚度(平滑肌的面积/Pi)分别较对照组显著增加26%(t=4.523,P<0.01)和58%(t=3.788,P<0.01)。气道平滑肌细胞核数量(N/Pi)哮喘组亦高于对照组23%(t=3.712,P<0.05),见表1。

表1 哮喘组与对照组WA/Pi、平滑肌的面积/Pi、N/Pi比较(n=10)
2.3 豚鼠气道TGF-β1蛋白的表达
哮喘组切片可见气道黏膜、黏膜下层、肺泡区有大量呈棕黄色的阳性细胞(图2B);对照组切片可见气道黏膜、黏膜下层、肺泡区有少量呈棕黄色的阳性细胞(图2A)。平均光密度值分析比较,哮喘组TGF-β1的平均光密度值均明显高于对照组,示哮喘组TGF-β1阳性表达明显强于对照组,而黄芪治疗组(图2C)及地塞米松治疗组(图2D)TGF-β1F的表达相对于哮喘组均有不同程度的减轻,差异均有统计学意义,见表2。
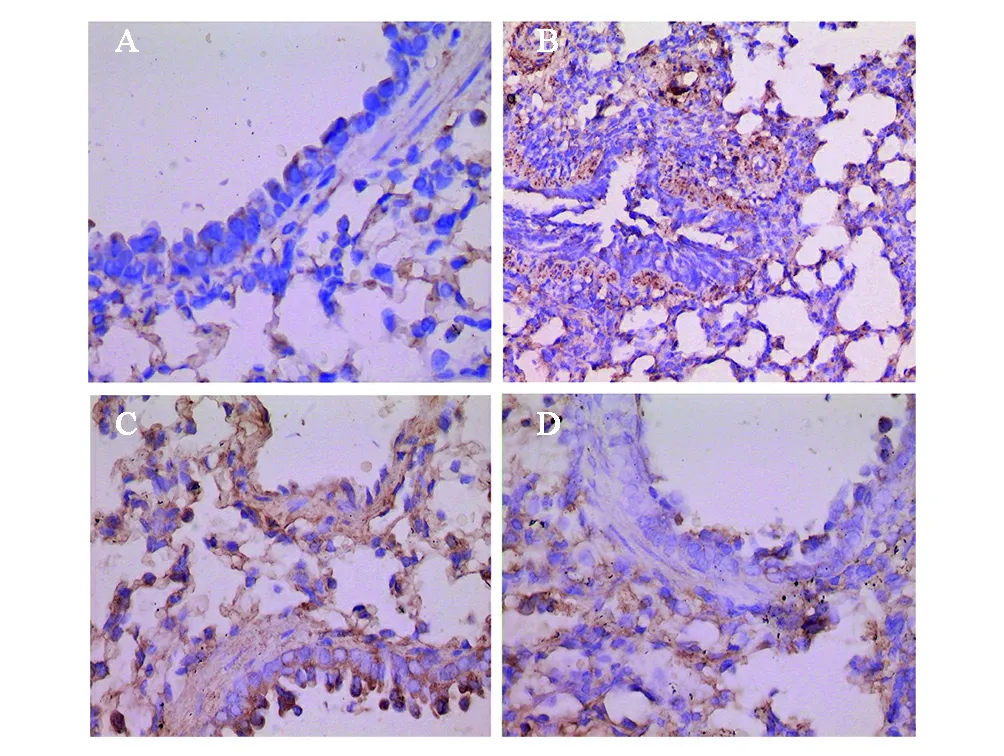
图2 TGF-β1的表达(HE,×400)

表2 各组大鼠支气管上皮VEGF、TGF-β1蛋白的积分光密度IOD值(n=10)
3 讨 论
支气管哮喘是一种慢性气道炎症性疾病,多种细胞和炎性介质及细胞因子参与哮喘的发生发展过程。目前国内外通用的哮喘诊治方案,均强调对气道炎症控制,而对气道炎症损伤后的气道重塑机制重视不够。在气道炎症环境下,气道壁上皮脱落、平滑肌收缩、平滑肌细胞增生和肥大等,都会使气道壁面积明显增大,气道内径缩小。因此,针对气道重塑的研究成为哮喘防治的新方向,对哮喘患者,特别是早期患者的预后具有重要意义。
目前公认治疗哮喘最有效的药物是糖皮质激素,但长期服用激素可形成激素依赖和激素抵抗,产生许多副作用。吸入性糖皮质激素(glucocorticoid,GC) 已被公认为哮喘治疗的一线药物,在临床中可看到部分病人,尤其是反复发作的患者,即使给予抗炎与支气管扩张治疗,仍气流阻塞,其主要原因在于气道重塑[8]。越来越多的动物实验和临床实验证实,TGF-β1在哮喘气道重塑过程中起到重要作用。TGF-β1被认为是纤维化疾病过程中最为关键的致纤维化因子[9]。在哮喘气道中TGF-β1主要来自气道上皮、纤维母细胞、嗜酸细胞及巨噬细胞,气道中TGF-β1表达增高,能刺激气道平滑肌细胞(ASMC) 分裂与增殖,导致平滑肌增生和肥厚[10],且TGF-β参与气道上皮损伤、ECM沉积和上皮下纤维化、杯状细胞增生、ASM重塑及微血管生成等,Khalil[11]。等认为TGF-β1 通过诱导产生PDGF和TNF-β来调节炎症和纤维化过程。
近年来,黄芪作为纯中药免疫调节剂防治哮喘受到学者的重视[12],其药理研究表明,黄芪主要化学成分为黄芪甲甙、黄芪多糖等,具有免疫调节、抑制炎症作用,可通过降低患者气道高反应性,调节患者免疫功能,而对支气管哮喘有一定的治疗作用[13]。在实验过程中,我们观察到黄芪组以及激素干预组的豚鼠出现典型的哮喘症状相对要轻。黄芪组治疗后气道上皮脱落、胶原沉积、气道平滑肌增加、气道壁增厚等气道重塑的特征明显减轻,提示黄芪组对哮喘炎症和气道重塑有较好的抑制作用。哮喘防治的关键则是采用早期干预的手段有效地控制哮喘气道炎症及防止气道重塑的发生。哮喘的气道重塑过程中,TGF-β1具有重要的调控作用,其在很大程度上促使或诱发气道重塑的发生。黄芪可能通过抑制TGF-β1在哮喘豚鼠肺组织中的表达,从而达到抑制气道重塑的作用,减轻哮喘症状,避免或延缓肺功能的进一步损害。同时,黄芪作为中药制剂,副作用小,极可能成为防治哮喘较具前途药物。
经黄芪干预治疗后,气道重塑明显减轻,而且TGF-β1表达量也下降,故提示TGF-β1在气道重塑中起着重要作用。抑制TGF-β1的表达可能阻止或减轻哮喘的气道重塑。说明黄芪可以从减少气道TGF-β1的表达来影响气道重塑。
[1]Halwani R,Al-muhsen S,Al-jahdali H,et al.Role of transforming growth factory-βin airway remodeling in asthma[J].Am J Respir Cell Mol Biol,2011,44(2):127-133.
[2]Salam MT,Gauderman WJ,McConnell R,et al.Transforming growth factor-β1 C-509T polymorphism,oxidant stress,and early-onset childhood asthma[J].Am J Respir Crit Care Med,2007,176(12):1192-1199.
[3]管小俊,张维溪,李昌崇,等.细胞外信号调节激酶和转化生长因子β1 在哮喘呼吸道重塑中的作用以及糖皮质激素的调控[J].中华医学杂志,2007,87(25):1767-1772.
[4]Alcorn JF,Rinaldi LM,Jaffe EF,et al.Transforming growth factor-β1supp resses airway hyperresponsiveness in allergic airway disease[J].Am J Respir Crit Care Med,2007,176(10):974-982.
[5]Yamaguchi M,Niimi A,Matsumoto H,et al.Sputum levels of transforming growth factor-β1 in asthma:Relation to clinical and computedtomography findings[J].Am J Investig Allergol Clin Immunol,2008,18(3):202-206.
[6]聂琼芳,易屏.黄芪对反复呼吸道感染患者体内 SIL-2R、IL-8 及 Ig的影响[J].细胞与分子免疫学杂志,2009,25(4):362-364.
[7]陶伍元,张文武.黄芪注射液对急性肺损伤大鼠热休克蛋白70核转录因子-κB表达的影响[J].中国急救医学,2012,32(3):227-231.
[8]钟南山.支气管哮喘-基础与临床[M].北京:人民卫生出版社,2006:438.
[9]Wen FQ,Kohyama T,Skold CM,et al.Glucocorticoids molecular TGF-beta production by human fetal lung fibroblast[J].Inflammation,2003,27(1):9-19.
[10]李明才,何韶衡.转化生长因子-β与哮喘[J].生命的化学,2003,23 (1):57-58.
[11]Khalil N,O’Cnnor RN,Flanders KC,et al.TGF-β,but not TGF-βor TGF-βis diferentially present on epithelial cellsof advanced pulmonary fibrosis:all immunohisto chemicl study[J].Am J Respire Cell Mol Biol,1996,14(2):131.
[12]鲍志坚,徐俭朴,楼景英.黄芪复方对哮喘患者气道高反应性的影响[J].浙江中西医结合杂志,2002,11(2):30-31.
[13]黄翠萍,杨和平,杨颖乔.黄芪注射液对哮喘大鼠 p38 蛋白激酶和白细胞介素 -5 表达的影响[J].中国临床药理学与治疗学,2008,13(8):900-903.

