Akt1在环氧合酶-2抑制剂抑制宫颈癌Hela细胞增殖中的作用
刘小叶,周建斌,李 婷,黄余良
(南华大学附属第二医院妇产科,湖南 衡阳 421001)
宫颈癌是较为常见的女性生殖系统恶性肿瘤,据WHO统计,全球80%的宫颈癌患者集中在发展中国家,国内每年新增病例约11万以上[1],对宫颈癌发病机制的研究越来越引起研究者的重视。环氧合酶(cyclooxygenase,COX)是前列腺素生物合成过程中重要的限速酶,COX-2是其中的一种亚型,生长因子,促炎症细胞因子等的激活可以促进COX-2的表达。大量的研究发现,COX-2存在于许多恶性肿瘤中,如结肠癌、肺癌、乳腺癌、胰腺癌和宫颈癌等,可能通过影响肿瘤细胞的增殖,增强肿瘤侵袭力,促进肿瘤转移等机制与恶性肿瘤的不良预后及低生存率密切相关[2-3]。氮-2,环己氧-4,硝基苯-甲基磺胺(NS398)是COX2的特异性抑制剂,研究发现它可抑制肿瘤的增殖,促进肿瘤细胞的凋亡,但其具体机制尚不清楚。Akt1是一种丝氨酸/苏氨酸蛋白激酶,又称为蛋白激酶B(protein kinase,PKB)。活化的Akt1可以抑制细胞的凋亡,促进细胞周期运行,促进细胞侵袭和转移[4]。本研究以人宫颈癌细胞株(Hela细胞)为研究对象,观察NS398对Hela细胞增殖的抑制作用及Akt1蛋白表达的变化,并采用Akt1激动剂活化Akt1,进一步探讨Akt1在NS398抑制Hela细胞增殖过程中的作用。
1 材料与方法
1.1 主要试剂
NS398购自美国Sigma公司,溶解在100%二甲基亚砜(DMSO)溶剂中,配成100 mmol/L的液体,实验时稀释至不同浓度。IGF-1购自澳大利亚GroPep公司,磷酸化Akt1单克隆抗体(即p-Akt,为Ser473位点磷酸化)购自美国Cell Signaling Technology公司,Western blotting免疫印迹所用二抗购自武汉博士德生物工程有限公司。DMEM培养基购自美国Hyclone公司,BCA蛋白检测试剂盒购自Hyclone公司,噻唑蓝(MTT)比色法试剂盒、丽春红染色剂及其它检测试剂盒均为国产试剂。
1.2 细胞株及培养条件
人宫颈癌细胞株(Hela细胞)购自中科院上海细胞生物学研究所。细胞贴壁生长于含双抗(青霉素和链霉素)及10%小牛血清的DMEM中,置37 ℃、5%的CO2饱和湿度培养箱中培养,以0.25%胰酶和0.02%乙二胺四乙酸(EDTA)1∶1(V/V)混合的消化液进行传代换液,各组实验分别取对数生长期的细胞进行。
细胞在给NS398和IGF-1前无血清培养基饥饿过夜,使细胞处于相同增殖状态。NS398用DMSO配制成50mmol/L的贮存液(使用时培养液中DMSO浓度不超过0.1%),-80°C保存,使用时用无血清培养基稀释成所需要的工作浓度。
1.3 MTT比色法检测细胞的生长
取对数生长期的培养细胞,传代并接种于96孔板中,培养24 h后,以无血清培养液处理24 h,然后换含不同处理因素的培养液分别分组处理细胞,每组设5个复孔,分别培养相应的时间后,加入新鲜配制的MTT,再继续培养4h后,弃去培养液,加入二甲基亚砜(DMSO),10 min后在全自动酶标仪上测定570 nm处吸光度(A值),以A570 nm值代表细胞活力。细胞生长抑制率(IR)按如下公式计算:生长抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
1.4 Western blotting免疫印迹检测蛋白质的表达
采用悬浮缓冲液裂解细胞,常规提取细胞总蛋白。经BCA法蛋白定量后,各组分别取。50 μg蛋白进行电泳,转PVDF膜后用丽春红染色检测转膜效果,再用10%脱脂奶粉封闭PVDF膜,然后依次孵育一抗(4 ℃孵育过夜)、TBST液洗涤(三次,共15 min)、二抗(室温孵育1 h),经TBST液洗涤(三次,共15 min)后,以Western免疫荧光检测试剂盒激发荧光,于暗室中显示于X光片,结果用凝胶图像分析系统对胶片扫描进行相对灰度分析。
1.5 统计学分析

2 结 果
2.1 环氧合酶抑制剂NS398对Hela细胞增殖的影响
为了解NS398对Hela细胞增殖的影响,采用MTT法检测细胞的吸光度,计算IR值后显示,不同浓度(0、50、100、150、200 μmol/L)NS398分别处理细胞0,12,24,36,48 h后,细胞代谢MTT的能力明显降低,IR值逐渐上升,这表明NS398可明显抑制Hela细胞的生长,并且其抑制作用呈浓度依赖性和时间依赖性(P<0.05)(图1)。

图1 MTT法分析不同浓度的NS398对Hela细胞生长抑制率的影响
2.2 环氧合酶抑制剂NS398对Hela细胞p-Akt1蛋白表达的影响
为观察环氧合酶抑制剂NS398对Hela细胞p-Akt1蛋白质表达的影响,采用不同浓度(0、50、100、150、200 μmol/L)NS398处理Hela细胞24 h后,以Western blotting免疫印迹法检测p-Akt1蛋白质的表达,结果显示,随着NS398浓度的增加,细胞中p-Akt1蛋白的表达逐渐下调,其效应呈浓度依赖性(P<0.05)(图2)。

图2 不同浓度NS398处理Hela细胞24h后p-Akt1蛋白质表达的变化
此外,为观察环氧合酶抑制剂NS398对Hela细胞p-Akt1蛋白质表达的影响的时效性,采用150 μmol/L的NS398处理Hela细胞不同时间(0,12,24,36,48 h),以Western blotting免疫印迹法检测p-Akt1蛋白质的表达,结果显示,随着NS398处理时间的增加,细胞中p-Akt1蛋白的表达逐渐下调,其效应呈时间依赖性(P<0.05)(图3)。
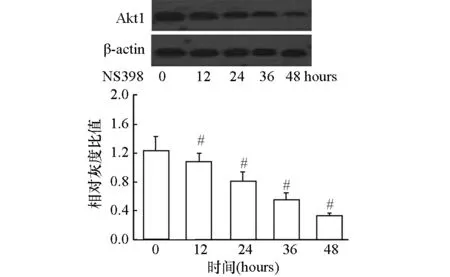
图3 NS398(150 μmol/L)处理Hela细胞不同时间后p-Akt1蛋白表达的变化
2.3 Akt1激动剂IGF-1在NS398抑制Hela细胞增殖过程中的作用
为进一步探讨Akt1在环氧合酶抑制剂NS398影响Hela细胞增殖过程中的作用,在150 μmol/L NS398处理细胞的基础上,同时结合不同浓度的Akt1激动剂IGF-1(50,100,150 ng/ml)处理Hela细胞0,12,24,36,48 h,经MMT法检测细胞的吸光度并计算IR值后显示,Akt1激动剂处理后,Hela细胞代谢MTT的能力明显增强,其IR值逐渐下降,这表明Akt1活性增强可以在一定程度上逆转NS398对Hela细胞增殖的抑制作用,并且其作用呈浓度依赖性和时间依赖性(P<0.05)(图4)。
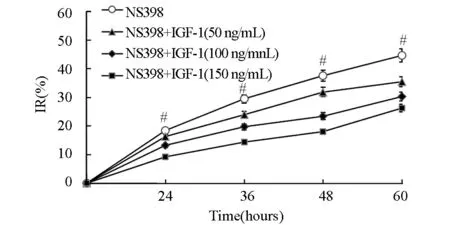
图4 不同浓度IGF-1对NS398(150 μmol/L)作用下的Hela细胞生长抑制率的影响
3 讨 论
宫颈癌是女性最常见的恶性肿瘤,发病率居女性生殖道肿瘤的首位,近年来其发病率有逐年上升和发病年轻化的趋势[5],但目前宫颈癌的发病机制尚未完全阐述清楚。NS398是环氧合酶-2(Cycolooxygenase 2,COX-2)的选择性抑制剂,属磺胺类制剂的衍生物,是非甾体类抗炎药物之一[6]。近年来,大量的研究表明NS398除特异性地抑制COX-2的表达之外,还可以抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡[7-8]。有研究发现,NS398可呈浓度依赖性抑制舌鳞癌细胞株Tca8113细胞中MMP2的表达,抑制肿瘤细胞的增殖和侵袭[9]。邹明英等[5]研究发现,NS398抑制宫颈癌Hela细胞增殖及MMP2的表达。这些研究说明NS398可以抑制宫颈癌的发展,但其具体分子机制尚未研究清楚。我们在实验中也发现,NS398可呈浓度依赖性和时间依赖性抑制Hela细胞的增殖。
Akt1在组织中分布广泛,是Akt的亚型之一,也是PI3K/Akt通路下游的主要作用靶点。它作为细胞信号网络中的中枢环节,对细胞增殖、分化及存活等多种生物学业过程起重要的调节作用,参与调节肿瘤、糖尿病、炎症和动脉粥样硬化等疾病的发生。研究发现,Akt可磷酸化Caspase-9前体,抑制细胞凋亡[10];上调抑癌基因c-Myc的表达,调节细胞周期,促进细胞的增殖[11];Akt稳定转染的细胞株能诱导上皮间质转换且E-钙黏素表达下调,细胞黏附性降低,促进细胞的侵袭和转移,从而在肿瘤的发生发展中起着重要的作用[12]。此外,国内研究也发现,磷酸化Akt(p-Akt)特异性过表达于子宫内膜样癌中,与其侵袭、转移等恶性生物学行为密切相关[13]。
本研究采用环氧合酶抑制剂NS398处理宫颈癌Hela细胞后,发现p-Akt1蛋白质表达下调,并且NS398的作用效应呈浓度依赖性和时间依赖性,这提示NS398抑制宫颈癌细胞增殖的作用可能与p-Akt1表达的下调有关。为明确Akt1在其中的作用,我们采用了不同浓度的Akt1激动剂IGF-1与NS398共同处理Hela细胞,结果发现,Akt1激动剂可以在一定程度上逆转NS398对Hela细胞增殖的抑制作用,并且其作用效应也呈浓度依赖性和时间依赖性。本实验表明,Akt1参与了NS398抑制宫颈癌Hela细胞增殖的作用,NS398可能是通过抑制Akt1的表达而影响Hela细胞的增殖。
总之,本研究证实了p-Akt1表达的变化能影响NS398对Hela细胞增殖的抑制作用,表明Akt1与宫颈癌的发生发展有着较为密切的关系,可能是环氧合酶-2抑制剂抗宫颈癌的可能作用机制之一。
[1]肖和龙,琚雄飞,马剑玲,等.惠州市成年女性HPV感染及其基因型分布[J].中南医学科学杂志,2013,41(4):361-364.
[2]Kargi A,Uysal M,Bozcuk H,et al.The importance of COX-2 expression as prognostic factor in early breast cancer [J].JBUON,2013,18(3):579-584.
[3]Schildberg C,Abbas M,Merkel S,et al.COX-2,TFF1,and Src define better prognosis in young patients with gastric cancer [J].J Surg Oncol,2013,108(6):409-413.
[4]Cariaga-Martinez AE,Lopez-Ruiz P,Nombela-Blanco MP,et al.Distinct and specific roles of Akt1 and AKT2 in androgen-sensitive and androgen-independent prostate cancer cells [J].Cell Signal,2013,25(7):1586-1597.
[5]邹明英,周菊香,曾希,等.NS398抑制宫颈癌Hela细胞增殖及MMP2的表达[J].现代生物医学进展,13(25):4940-4943.
[6]Qiu R,Chen J,Sima J,et al.NS398 induces apoptosis in non-small cell lung cancer cells [J].J Cancer Res Clin Oncol,2012,138(1):119-124.
[7]Lee SJ,Hwang JW,Yim H,et al.Synergistic effect of simvastatin plus NS398 on inhibition of proliferation and survival in hepatocellular carcinoma cell line [J].J Gastroenterol Hepatol,2014,29(6):1299-1307.
[8]胡孙宽,周琴,林铁素,等.选择性环氧化酶2抑制剂NS-398对胃癌细胞AGS增殖的抑制作用[J].中国药理学与毒理学杂志,2013,27(1):72-76.
[9]佘先麟,郝艳梅,司晨晨,等.NS-398对舌鳞癌基质金属蛋白酶2蛋白表达的影响[J].江苏医药,2012,38(2):140-141.
[10]Quan JH,Cha GH,Zhou W,et al.Involvement of PI 3 kinase/Akt-dependent Bad phosphorylation in Toxoplasma gondii-mediated inhibition of host cell apoptosis [J].Exp Parasitol,2013,133(4):462-471.
[11]Radke J,Bortolussi G,Pagenstecher A.Akt and c-Myc induce stem-cell markers in mature primary p53(-)/(-) astrocytes and render these cells gliomagenic in the brain of immunocompetent mice [J].PloS One,2013,8(2):e56691.
[12]Fenouille N,Tichet M,Dufies M,et al.The epithelial-mesenchymal transition (EMT) regulatory factor SLUG (SNAI2) is a downstream target of SPARC and AKT in promoting melanoma cell invasion [J].PloS One,2012,7(7):e40378.
[13]陈红霞,尹春华,陶雪勤.子宫内膜样癌组织中p-Akt表达变化及意义[J].山东医药,2013,53(32):40-43.

