开发演示实验的科学探究功能——《碳酸氢钠的性质与应用》教学反思
葛珊珊 丁爱军
(江苏省扬州中学 江苏 扬州 225009)
一、开发演示实验科学探究功能的重要性
化学实验是提高学生科学探究能力的重要立足点。 实施化学实验是学生体验科学探究过程和培养探究能力的最佳手段。 通过观察演示实验、自己动手实验、理论设计实验等学习过程,可以有效地帮助学生形成化学概念、培养观察能力、实验操作能力、提高思考能力、培养科学研究的习惯和态度。
在日常教学过程中,演示实验是最常见的实验类型。 与学生实验相比,教师演示实验对仪器、药品、场地的要求较低, 也更容易在有限的教学时间内完成。所以,演示实验这样一个在课堂中高频率出现的实验类型其科学探究功能应该被更好的开发。
二、开发演示实验科学探究功能的三条思路
实际上,演示实验的科学探究功能常常被教师忽视,主要原因还是大家对演示实验的实施过程存在一些固定思维。 比如,人们常常把演示实验与验证性实验划等号,将演示实验的操作方式趋向于表演性。 学生往往先学习实验原理,获得完整的实验装置,了解实验过程,然后再知晓实验结果。 教师对实验的教学精力集中在实验原理的灌输上,希望通过新奇的实验想象帮助学生掌握知识,完成一场“成功”的课堂演示实验。 固然这样的实验会给学生带来感官上的刺激,有助于其记住实验原理,但要想帮助学生进行科学的探究实验,获得“化学思维”,还需要教师对实验作一些精心的设计。
我在《碳酸氢钠的性质与应用》一节课的教学过程中,作了以下的一些尝试,提供了开发演示实验科学探究功能的三条思路供大家参考。
1. 在演示实验中培养条件控制意识
在实验研究过程中,要想专注于研究某个条件对实验结果的影响,就必须排除其它干扰因素,如对比两反应产生气体的体积时,必须控制两反应在同样的温度和压强条件下。 这样的条件控制意识对实验设计的科学性有着举足轻重的作用。 如果仅仅要求学生按照书本或实验报告册中的实验程序操作,学生很难发现过程中哪些条件是被控制的,这要求教师对演示实验的过程教学做些小设计。
本课中就有两个简单的实验——对比碳酸钠和碳酸氢钠溶液的碱性、对比碳酸钠和碳酸氢钠溶液与酸反应产生气体的速率。
要求学生根据提供的仪器和药品(药品中既有碳酸钠和碳酸氢钠固体, 也有同浓度的两者的溶液)设计两个实验, 对比Na2CO3和NaHCO3溶液的碱性,以及Na2CO3和NaHCO3溶液与酸反应产生气体的速率。不少学生面露难色,觉得这些实验挺简单的,没什么实验步骤好设计的。5 分钟后,将学生设计中比较典型的实验步骤投影给全体同学:
各种影像中有关大运河的记录,也不过百年,但这些记录,却写满了沿岸人民的回忆……今天,我们就走进运河岸边的江北水城——聊城,听一听她的运河故事。
[实验1]取两种固体配成溶液/取两溶液,用玻璃棒测溶液的pH。
[实验2]分别取少量固体与盐酸反应,观察气体产生的速率。
这样的设计从原理上来讲并没有什么大问题,但实际操作起来科学性却不是很强,这与学生在初中主要学习原理而很少关注定量科学研究有关。 高中的学习过程中, 教师要努力帮助学生加强对量的理解,加强有条件控制的实验设计。
于是,我让学生对比教科书中的实验步骤,找找其中有哪些同学没提到的关键词。
教科书中实验步骤如下:
[实验1]取两张pH 试纸置于干燥洁净的玻璃片上。用干燥洁净的玻璃棒沾取瓶中0.5mol/L 的碳酸氢钠溶液和碳酸氢钠溶液滴在试纸上。 将试纸与标准比色卡对比,读出pH。
[实验2] 在两支小试管中分别倒入1mL 0.5mol/L 碳酸钠和碳酸氢钠溶液备用。 用两只胶头滴管吸取整滴管的盐酸,同时全部加入两支小试管中,对比反应的剧烈程度。
经过引导,学生在实验1 中发现了“干燥洁净”、“0.5mol/L”两个关键词,并认识到这两个关键词是为了控制浓度这个重要的实验条件。 经过进一步总结,同学们发现溶液的pH 除了取决于其本身的碱性还和溶液的浓度密切相关, 要想研究物质的碱性强弱,必须将浓度这一影响因素排除。 再来对实验2 分析的时候,学生就熟练了很多,直接确定了浓度、体积、酸用量、时间等多项影响因素,并将控制这些条件的关键词一一找到。
初入门的学生们经过先设计再与书本实验步骤对比的学习过程, 可以提高对实验条件控制的意识,辨别和设计更科学的实验步骤,掌握实验的真正研究途径。 教师要在设计中提醒学生注意实际操作中的若干细节,学生对实验细节的设计往往决定着他们的思考价值。
2. 在演示实验中推广对比实验思路
对比实验是一种常用的化学实验思路, 指设置两个或两个以上的实验组,通过对比结果,来探究各种因素与实验对象的关系。 例如上述实验2 的设计就属于一种比较典型的对比实验。 不过还有很多演示实验,虽然没有典型的对比实验过程,却充满了丰富的对比实验思路, 如果学生不能领会这些实验是如何进行对比的, 就不能说他真正领会了实验的原理。
在碳酸钠和碳酸氢钠的热稳定性学习中,书本上出现的实验装置如图1。
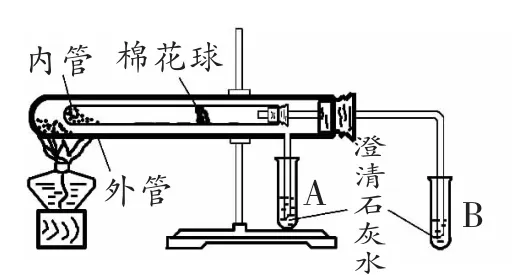
图1
实验装置是实验原理的载体,饱含着设计者对实验的深刻理解。 不要直接告诉学生内管装什么药品、外管装什么药品,让他们自己思考一下内外管在什么实验条件上有差异。 学生可以说的出是温度存在差异。
再帮助学生回忆一些以往学习的相关知识信息,如碳酸钙和碳酸氢钙的热稳定性差异,让他们预测碳酸钠和碳酸氢钠的热稳定性是否也有这样的差异。不论学生作出怎样的预测此时都是合理的,让他们设计内外管的样品应该装什么才可以佐证自己的预测。这样一来,学生在课堂中完成了科学探究的实际过程,获得的远不止于“碳酸氢钠稳定性弱于碳酸钠”。
甚至有的学生还可以发现,对比实验有时候不一定非要设定为一模一样的实验条件,有时候“不平等”的实验条件反而更有说服力。
这样的教学过程并不复杂,一个简单的问题可以帮助学生思考对比实验的设计精髓,掌握科学的研究思路,少点教条、多点思考。
3. 在演示实验中形成工业生产模型
演示实验对学生来说是一座桥梁,它连接了书本上的化学原理和实际中的工业生产。 从演示实验中,学生可以直观地看到化学原理是如何发生的,并了解工业生产中复杂的工艺设计是如何从最基本的化学原理开始的。
本节课有一个拓展视野的阅读内容——侯氏制碱法,书本上没有安排实验,学生看了之后既觉得很兴奋,又觉得很神奇。 兴奋是因为侯德榜圆了中华民族的强国之梦,觉得神奇是因为不太看得懂反应的原理。
在课堂上如果安排做侯氏制碱法的演示实验,实验装置是比较复杂的、气味是比较难闻的、实验时间是比较漫长的。 这不符合安排演示实验的基本要求,所以我作了另一个实验设计:取一支干燥的试管,倒入约2mL 饱和NHHCO、 2mL 饱和NaCl 溶液,另一支试管加入4mL 蒸馏水做对比。 观察实验现象。 同时提供10℃(当地当时气温) 时几种盐的溶解度数据:
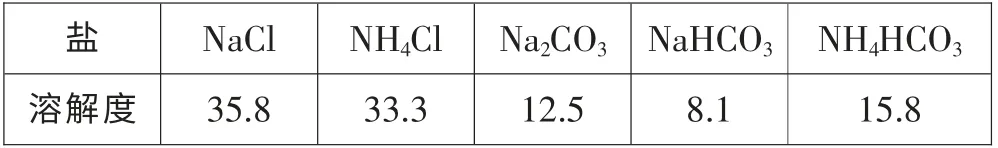
?
学生惊讶地看到装有碳酸氢钠和氯化钠的试管中出现了浑浊,根据溶解度数据发现原来复分解反应也不一定非要生成“沉淀”,只要浓度达到饱和,可溶性盐也可以变成“沉淀”。
此时,学生已经掌握了侯氏制碱法中关键的一步反应原理:
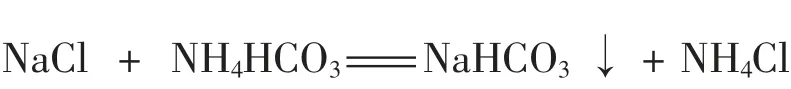
再介绍一下工业上为了降低成本和连续生产,并没有使用碳酸氢铵,而是使用氨气和二氧化碳通入饱和食盐水中。 学生对侯氏制碱法的理解就会比较深入,甚至能够很快回答出氨气和二氧化碳的通入顺序问题,因为他们已经认识到碳酸氢铵需要浓度比较大时碳酸氢钠才能饱和析出。
工业设计是比较复杂的, 但其中蕴含的化学原理可能比较简单。通过这样的演示实验设计,可以帮助学生将侯氏制碱法的工业原理化繁为简、 化整为零,建立简单的工业原理分步模型。 同时,通过对实验信息的深入分析, 同学们还能更好的理解复分解等反应原理,从离子角度认识溶液反应。演示实验此时无疑成了一剂催化剂, 促成了学生脑袋中的思维大爆炸。
以上就是我在《碳酸氢钠的性质与应用》教学过程中形成对演示实验的一些研究想法。 我认为演示实验的魅力值得广大教师同仁发现,演示实验这棵老树应该在探究实验的课堂上发新枝,充分开发演示实验在探究性学习中的功能, 对于改变学生的学习方法,形成终身学习的能力具有重要的意义。
[1] 林长春, 彭蜀晋. 中外理科实验教学比较与思考[J]. 课程·教材·教法,2001,(2)
[2] 罗芳. 课程改革下的化学实验科学探究[J]. 科教文汇,2007,(2)

