青贮饲料中优良乳酸菌的分离鉴定及其生物学特性研究
何轶群 雷赵民 吴润 万学瑞 刁小龙 艾文娜
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃农业大学动物科学技术学院,兰州 730070)
近几年来,我国畜牧业发展迅速,动物养殖规模日益扩大,但由于我国耕地面积减少,用于生产饲料的原料严重不足,加之对秸秆类植物的利用率相对较低,养殖业和饲料生产的矛盾日益突出,这些问题严重制约着我国畜牧业的发展。因此,发展饲料工业以及加大对秸秆类植物饲料化的转化是目前我国畜牧业迫切需要解决的问题。目前对秸秆类粗饲料的加工处理主要有物理加工法、化学加工法和微生物发酵法,其中以微生物发酵法中的青贮法应用最为广泛。这是因为秸秆类植物经微生物青贮发酵后具有柔软多汁、气味芳香、适口性好、原料营养保留较多、胡萝卜素和蛋白质损失少、水分多以及可长期保存等特点[1-3]。研究发现,青贮饲料质量的好坏又同它所含有的乳酸菌有很大的关系,但秸秆类植物表面附生的乳酸菌数往往较少,为改善青贮饲料的营养品质,最行之有效的方法是添加优质乳酸菌生物添加剂,使乳酸菌迅速成为青贮环境的优势菌群,迅速降低青贮饲料的pH值,抑制有害菌的生长,改善青贮饲料发酵品质、抑制二次发酵,从而达到长期保存饲料营养物质的目的。并且乳酸菌是动物胃肠道的益生菌群,代谢产生的有机酸、细菌素、过氧化氢、双乙酰等多种天然抑菌物质,具有维持肠道内菌群平衡,提高机体免疫力,促进营养物质吸收等多种功能[4]。
青贮饲料中含有丰富的乳酸菌,包括肠球菌、乳酸乳球菌、明串珠菌、链球菌和乳杆菌等,它们在青贮饲料发酵中起重要作用。本试验旨在从青贮饲料中分离生物学特性优良的乳酸菌,从而为青贮饲料添加剂的研究和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 青贮样品 玉米秸秆青贮饲料样品采自甘肃省平凉、临洮、康乐等地青贮窑。样品采集后迅速置于无菌自封袋中,4℃保存。
1.1.2 菌株及主要试剂 参考菌株:干酪乳杆菌(Lactobaillus casei)、乳酸乳球菌乳酸亚种(Lactocaccus lactis subsp. lactis)均由甘肃农业大学食品科学与工程学院甘伯中教授惠赠;大肠杆菌(Escherichia coli)、沙门菌(Salmonella)、蜡状芽胞杆菌(Bacillus cereus)、金黄色葡萄球菌(Streptococcus aureus)、酵母菌(Saccharomycetes)、青霉菌(Penicillium)、曲霉菌(Aspergillus)、根霉菌(Rhizopus)、E. coli DH5α均由本实验室保存;细菌基因组提取试剂盒购自北京百泰克生物技术有限公司;糖微量发酵管购自青岛海博生物科技有限公司;其它所需试剂均为进口或国产分析纯产品。
1.2 方法
1.2.1 细菌分离
1.2.1.1 样品采集处理 样品经四分法处理后,无菌称取25 g加入225 mL灭菌生理盐水中,于37℃恒温摇床摇动2 h备用。
1.2.1.2 乳酸菌的分离 用无菌生理盐水稀释样品溶液,取10-3-10-5三个稀释度,各稀释度取液体0.1 mL分别均匀涂布于含有CaCO3的MRS和M17培养基平板上,将平板置于厌氧培养盒后37℃培养72 h。
1.2.2 乳酸菌分离株的鉴定
1.2.2.1 乳酸菌分离株的初步鉴定 挑取溶钙圈较明显的典型菌落,在MRS平板上反复划线得到单个菌落,观察记录菌落形态,进行革兰氏染色镜检,并做触酶试验。
1.2.2.2 乳酸菌生理生化鉴定 根据文献[5]中的方法,对疑似乳酸杆菌做运动性、明胶液化、吲哚、H2S产生、硝酸盐还原和pH4.5生长试验。对于疑似乳酸球菌还需要做精氨酸分解、葡萄糖产酸产气、10℃和45℃生长、pH9.6生长和6.5% NaCl生长试验。对所有菌株采用糖微量发酵管法进行糖发酵试验。
1.2.2.3 乳酸菌16S rRNA基因序列分析 参考已发表的乳酸菌通用引物进行细菌16S rRNA基因扩增,正向引物5'-AGAGTTTGATCCTGGCTCAG-3'[6];反向 引 物5'-CTACGGCTACCTTGTTACGA-3'[7]。以 上引物由上海Invitrogen公司合成。细菌基因组DNA的提取严格按照试剂盒说明进行。PCR扩增体系为25 μL,上下游引物各1 μL、模板DNA 2 μL、预混酶12.5 μL、水8.5 μL。反应条件:95℃预变性5 min;95℃ 45 s,50℃ 45 s,72℃ 1.5 min,35个循环;72℃延伸10 min,4℃保存。预计扩增片段长度约为1 500 bp。将PCR产物回收后,连接pMD18-T载体并转化E. coli DH5α,经蓝白斑筛选为阳性克隆后送上海生工生物工程技术服务有限公司测序。将测序结果在GenBank中进行BLAST分析。
1.2.3 优良乳酸菌的筛选
1.2.3.1 产酸性试验 将活化的乳酸菌分离株按5%量接入MRS液体培养基,每组设3个重复,置于37℃恒温培养箱培养30 h,每隔2 h无菌取样测pH值,记录结果。
1.2.3.2 抑菌试验 乳酸菌分离株发酵上清液抑菌试验参照文献[8]进行。
1.2.4 乳酸菌生物学特性测定
1.2.4.1 乳酸菌生长曲线的测定 将活化的乳酸菌按5%量接入MRS液体培养基,37℃恒温培养30 h。每隔2 h取样测各组菌液的OD600nm值,绘制生长曲线图。
1.2.4.2 温度敏感试验 将活化的乳酸菌按5%量接入MRS液体培养基后分别置于37℃、40℃、45℃、50℃、55℃、60℃温箱,每组设3个重复,恒温培养15 h,取样测各组菌液的OD600nm值,以培养温度为横坐标,菌液OD600nm值为纵坐标制图。
1.2.4.3 耐盐性试验 将活化的乳酸菌按5%量分别接入NaCl浓度为(0、0.02、0.04、0.06、0.08和1.0 g/mL)的MRS液体培养基中,每组设3个重复,37℃恒温培养15 h,取样测各组菌液的OD600nm值,以Na-Cl浓度值为横坐标,菌液OD600nm值为纵坐标制图。
1.2.4.4 不同pH值生长试验 将活化的乳酸菌按5%量分别接入pH为2、4、6、8和10的MRS液体培养基中,每组设3个重复,37℃恒温培养15 h,取样测各组菌液的OD600nm值,以pH值为横坐标,菌液的OD600nm值为纵坐标制图。
2 结果
2.1 乳酸菌分离
从含有CaCO3的MRS和M17平板上挑取溶钙圈直径>4 mm的菌落,在MRS平板上纯化后保存。
2.2 乳酸菌分离株鉴定
2.2.1 形态、染色及培养特性 在MRS培养基上出现乳白色或灰白色、表面光滑、边缘整齐、大小不一的圆形菌落,经革兰氏染色为阳性、无芽孢、触酶试验阴性的初步鉴定为乳酸菌,共分离出12株细菌。
2.2.2 乳酸菌生理生化特性 参考菌株的各生理生化试验均与标准相符,依据分离株的生理生化特性(表1-表3),结合形态和染色特征,12株乳酸菌分离株的运动性、明胶液化、吲哚形成、H2S试验、硝酸盐还原试验均为阴性,其中B1-4、B2-7、B2-8、B2-9、B3-1的pH4.5生长试验为阳性,被鉴定为乳杆菌属细菌,除B1-4外上述各菌株在糖发酵类型上与植物乳杆菌非常相似可能为相同的种。B1-7不分解精氨酸,45℃、6.5% NaCl、pH9.6生长试验均为阴性,被鉴定为明串珠菌属,B1-3、B1-6、B2-3、B4-5、B5-1、B5-2的各生理生化试验结果非常相似,但B1-3、B1-6、B2-3、B4-5、B5-1在糖发酵类型上更为相似,通过生理生化试验暂不能将以上菌株鉴定到属。B2-7、B2-8、B2-9、B3-1、B1-3、B2-3、B4-5、B5-1、B5-2利用葡萄糖只产酸不产气,为同质型发酵乳酸菌,B1-4、B1-6、B1-7利用葡萄糖产酸产气,为异质型发酵乳酸菌。

表1 乳酸杆菌生理生化特性
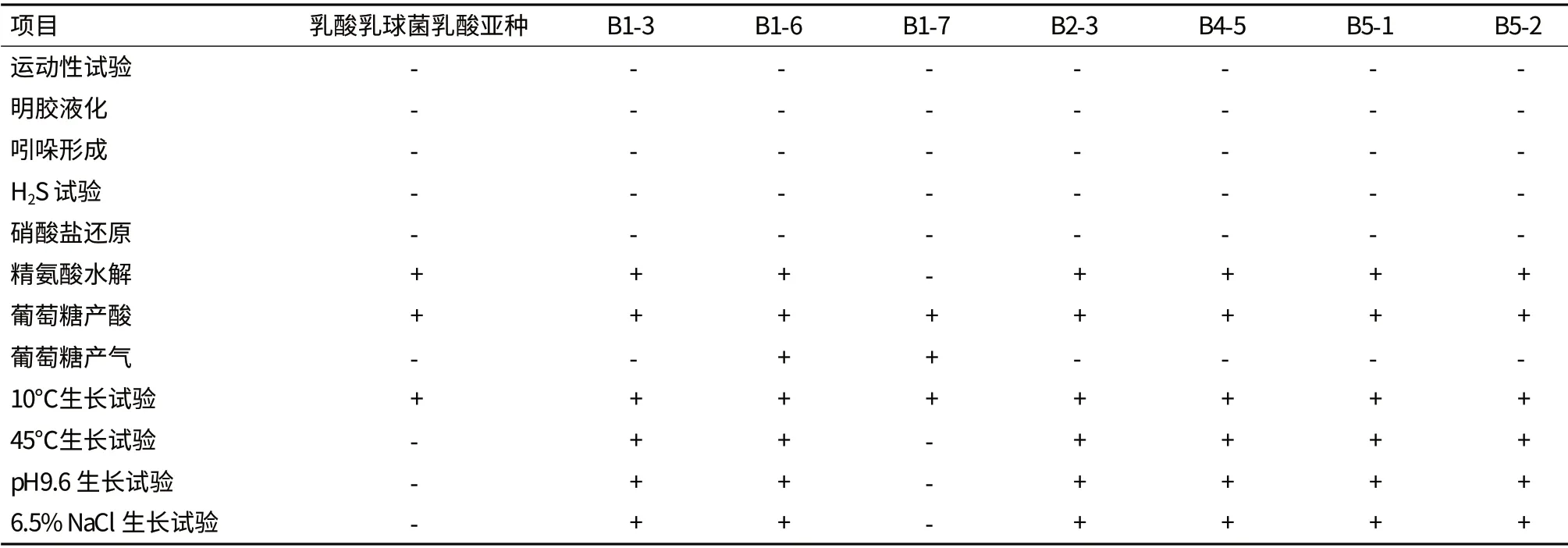
表2 乳酸球菌生理生化特性

表3 乳酸菌糖发酵结果
2.2.3 16S rRNA基因序列特征 PCR扩增产物经12 g/L的琼脂糖凝胶电泳检测,12株分离乳酸菌在1 500 bp处出现特异性条带,与预期扩增大小一致说明扩增成功。将各菌株的16S rRNA基因测序结果在GenBank中进行BLAST分析,各菌株与参考菌株的同源性均达到99%(表4)。菌株B1-3、B1-6、B2-3、B4-5、B5-1被鉴定为戊糖片球菌(Pediococcus pentosaceus)、B2-7、B2-8、B2-9、B3-1被鉴定为植物乳杆菌(Lactobacillus plantarum)、B1-4被鉴定为发酵乳杆菌(Lactobacillus fermentum)、B1-7被鉴定为肠系膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp. mesenteroides)、B5-2被鉴定为屎肠球菌(Enterococcus faecium)。

表4 分离菌株16S rRNA序列的 BLAST分析结果
2.3 优良乳酸菌的筛选

表5 乳酸菌分离株的产酸性(pH值)
2.3.1 产酸性试验 由表5可见,菌株B2-8产酸最快,接种4 h后pH降4以下,20 h后降到2.5;菌株B3-1、B1-6、B1-3次之,分别于6 h后降到4以下,20 h后降到3.0;菌株B2-9、B4-5接种8 h后pH下降到4以下,20 h后下降到3.0。以上菌株显示了较好的产酸能力,具有良好的青贮潜力。菌株B1-7、B2-3、B2-7、B4-5、B5-1、B5-2产酸相对较慢,但20 h后降到4以下,也具有青贮潜能。
2.3.2 抑菌试验 抑菌试验结果由表6可以看出,所有测试乳酸菌分离株上清液对霉菌均无抑制作用,其中菌株B3-1抑菌谱宽,抑菌活性最佳,菌株B2-3和B2-8次之。B1-4、B2-9、B4-5、B5-2对病原细菌、霉菌、酵母菌均无抑制作用。
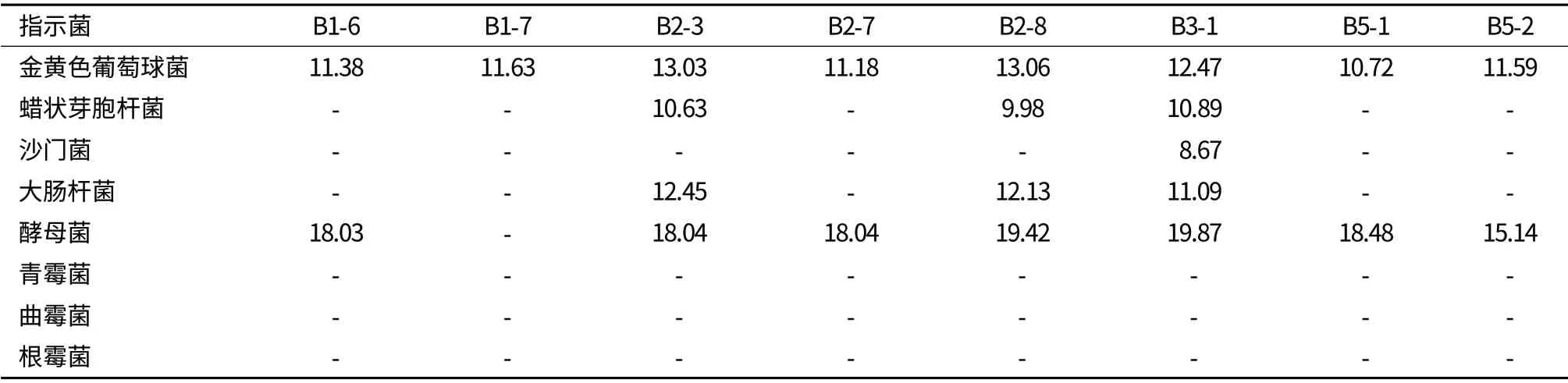
表6 乳酸菌分离株上清液的抑菌效果(mm)
通过产酸性试验和抑菌试验结果,再结合考虑青贮体系生物多样性和菌种自身特性,初步筛选出B1-6、B1-7、B2-3、B2-8、B3-1和B5-2共6株优良的乳酸菌,并进一步对其生物学特性进行比较。
2.4 优良乳酸菌生物学特性比较
2.4.1 生长曲线测定 由图1可知,菌株B1-7和B5-2适应期较短,在2 h后就进入对数期,生长速度较快,8 h后达到稳定期。其余各菌株的适应期较长,4 h后进入对数期,14 h后进入稳定期。

图1 乳酸菌分离株的生长曲线
2.4.2 温度敏感试验 由图2可知各菌株在培养温度高于55℃时基本不再生长。B3-1、B2-8、B1-6和B2-3在培养温度为50℃时OD值均较初始值高,说明上述菌株具有较强的耐高温能力,B5-2次之。菌株B1-7对温度较为敏感在培养温度为45℃时基本不再生长。

图2 乳酸菌分离株经不同温度培养15 h后的OD600nm值
2.4.3 耐盐性试验 由图3可知,随着NaCl浓度的增高各菌株的生长也相应的减弱。B1-7和B5-2在NaCl浓度为0.08 g/mL时基本不再生长,其余菌株在NaCl浓度为0.1 g/mL时基本不再生长。B2-3在NaCl浓度为0.08 g/mL时较初始值显著增高,说明其具有较强的耐盐能力。
2.4.4 不同pH值生长试验 由图4可知培养基pH过高或过低均不利于菌株的生长。各菌株在培养基pH为6时OD值最大,说明pH6为各菌株的最佳培养条件。B3-1、B2-8、B1-6、B2-3和B5-2在pH为4、8、10时OD值均较初始值高说明有较强的耐酸碱能力,但B1-7在pH为10时基本不再生长。

图3 乳酸菌分离株在不同NaCl含量培养基中培养15 h后的OD600nm值

图4 乳酸菌分离株在不同pH培养基中培养15 h后的OD600nm值
3 讨论
秸秆类植物青贮过程中,其表面带有的乳酸菌起到不可替代的作用,在青贮饲料中可能存在优良的青贮用乳酸菌,且由于其附生于植物表面,更能适应青贮环境。因此,从青贮饲料中分离筛选青贮用优良乳酸菌是一条高效、快速的方法。对分离的细菌在形态特征、培养特征和生理生化特征的基础上,结合16S rRNA基因核苷酸序列分析方法,从基因水平对其鉴定是目前较常用的一种方法[9,10]。本研究首先通过传统鉴定方法将细菌鉴定到属,部分细菌还可鉴定到种,最后通过16S rRNA基因序列分析法对上述鉴定结果进行验证进一步说明了生化鉴定的准确性,提高了细菌鉴定的准确率。
青贮时乳酸菌通过厌氧呼吸将青贮饲料中的碳水化合物转化为有机酸,使青贮环境的pH值下降到3.8-4.2,抑制有害菌的生长,从而实现长期保存饲料及其营养物质的目的[11]。因此作为饲料添加剂的乳酸菌的产酸能力和产酸速度直接影响青贮品质。通过产酸性试验对分离出的12株乳酸菌进行初步筛选,菌株B2-8产酸能力最强,接种4 h后pH已降到4以下,20 h后降到2.5,说明其能快速繁殖,创造酸性环境,在青贮初期具有优势;除B1-4外其余菌株接种20 h后pH值均能下降到3.5以下,也具有良好的青贮潜能。
青贮时一些病原细菌、霉菌、酵母均可引起青贮饲料的腐败变质,并且金黄色葡萄球菌引起的奶牛乳房炎,大肠杆菌和沙门菌引起的畜禽肠道腹泻等问题至今仍未很好解决。通过抑菌试验发现,所分离的乳酸菌上清液对霉菌均无抑制作用,对金黄色葡萄球菌的抑菌效果较为显著,其中菌株B3-1抑菌谱宽,抑菌活性最佳,对供试病原细菌和酵母菌均有较好的抑菌作用,菌株B2-3和B2-8次之。本试验所分离的乳酸菌对于改变上述问题提供了新的途径。目前关于乳酸菌的抑菌机制主要认为是以下两方面:一是认为乳酸菌的代谢产物具有抑菌作用[4];二是乳酸菌通过伸出伪足状丝状物与小肠上皮细胞结合,起占位作用,从而阻挡有害菌的侵袭[12,13]。关于乳酸菌的抗真菌机制Anders等认为植物乳杆菌的代谢产物3-羟基脂肪酸具有优良的抗真菌能力。本试验中所分离出的植物乳杆菌发酵上清液均无抑制真菌能力其原因还有待进一步的研究。目前青贮饲料添加剂主要是同质型和异质型乳酸球菌和杆菌的多菌混合应用,这是因为乳酸球菌和明串珠菌在青贮前期迅速发酵,从而为乳酸杆菌的生长提供有利条件。本研究所筛选出的B1-7和B5-2生长速度较快,2 h后就进入对数期,8 h后达到稳定期,符合上述要求。在此之后,片球菌和乳酸杆菌占主导地位,pH值下降到4.2以下只有乳酸杆菌大量繁殖,因此,筛选了B2-3和B1-6两株戊糖片球菌以及B2-8和B3-1两株植物乳杆菌。同质型乳酸菌和异质型乳酸菌混合应用主要是由于同质型发酵乳酸菌主要生成乳酸,营养成分损失少,产酸多且快,异质型乳酸菌除生成乳酸外还生成乙酸等有机酸和气体,并产生热量,造成营养物质的损失,但其产生的乙酸是一种比乳酸更有效的抗真菌及霉菌的酸类物质[14-16],更能有效防止青贮饲料二次发酵和提高其有氧稳定性[17]。本试验所筛选出的B1-6和B1-7为异型发酵乳酸菌,其余为同型发酵乳酸菌。青贮时适量的酵母可以使青贮饲料产生酒香味提高了青贮饲料的适口性,但是当青贮饲料开窖后酵母和氧气接触,大量繁殖并和乳酸菌竞争营养物质引起二次发酵破坏青贮饲料的有氧稳定性[18]。筛选的菌株除B1-7外其余菌株均对酵母有一定的抑制作用,这对改变二次发酵问题提供了可能。
本试验筛出的B1-6、B1-7、B2-3、B2-8、B3-1和B5-2共6株乳酸菌有乳酸球菌和乳酸杆菌,有同质型乳酸菌和异质型乳酸菌,并且筛选出的6株乳酸菌具有较好的产酸能力和抑菌能力,以及具有优良的生物学特性和抗逆性,均为青贮用常见菌种,这对制备优良的青贮饲料添加剂提供了可能,对于各菌株之间如何搭配以及其添加剂量的确定还需要在后续试验中做进一步的研究。
4 结论
本研究成功分离出12株乳酸菌,其中杆菌5株,球菌7株。经鉴定植物乳杆菌4株、发酵乳杆菌1株、屎肠球菌1株、肠系膜明串珠菌肠膜亚种1株、戊糖片球菌5株,其中菌株B1-4、B1-6、B1-7为异型发酵乳酸菌,其余菌株为同型发酵乳酸菌。菌株B1-6、B1-7、B2-3、B2-8、B3-1和B5-2显示了较好的产酸能力和抑菌能力,具有良好的青贮潜力。
[1] Yang XX, Chen HZ, Gao HL, et al. Bioconversion of cornstraw by coupling ensiling and solid state fermentation [J]. Bioresour Technology, 2001, 78(3):277-280.
[2] Weinberg ZG, Ashbell G, Chen Y. Stabilization of returned dairy products by ensiling with straw and molasses for animal feeding [J]. Journal of Dairy Science, 2003, 86(4):1325-1329.
[3] Filya I. The effect of Lactobacillus buchneri and Lactobacillus plantarum on the fermentation, aerobic stability, and ruminal degradability of low dry matter corn and sorghum silages [J]. Journal of Dairy Science, 2003, 86(11):3575-3581.
[4] Schillinger U, Holzapfel WH. Guidelines for manuscripts on bacteriocins of lactic acid bacteria [J]. Journal Food Microbiology, 1996, 33(2-3):3-5.
[5] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社, 1999:117-127.
[6] Mora B, Fortina MG, Nicastro G, et al. Genotypic characterisation of thermophilic bacilli:a study on new soil isolates and several reference strains [J]. Reserch Microbiology, 1998, 149(10):711-722.
[7] Jensen MA, Webster JA, Strauss N. Rapid identification of bacteria on the basis of polymerase chain reaction-amplified ribosomal DNA spacer polymorphisms [J]. Applied Polymerase Environmental Microbiology, 1993, 59(4):945-952.
[8] Werner B, Schumann UB, Krebs A, et al. Rapid method for detection of minimal bactericidal concentration of antibiotics [J]. Journal of Microbiological Methods, 2009, 77(1):85-89.
[9] Woo PC, Ng KH, Lau SK, et al. Usefulness of the Microseq 500 16S ribosomal DNA-based bacterial identification system for identification of clinically significant bacterial isolates with ambiguous biochemical profiles [J]. Journal Clinical Microbiology, 2003, 41(5):1996-2001.
[10] Lau SK, Woo PC, Woo GK, et al. Catheter-related Microbacterium bacteremia identified by 16S rRNA gene sequencing [J]. Journal Clinical Microbiology, 2002, 40(7):2681-2685.
[11] 温雅俐, 高民.青贮饲料中乳酸菌代谢及其青贮品质影响研究进展[J].畜牧与饲料科学, 2010, 31(9):15-17.
[12] 林雪彦, 牛钟相.动物消化道乳酸菌粘附机制及影响因素研究进展[J].家畜生态学报, 2003, 27(3):109-111.
[13] 程波财, 魏华.乳酸菌与肠粘膜免疫[J].中国微生态学杂志, 2001, 13(5):302-304.
[14] Nishino N, Yoshida MH, Shiota E, et al. Accumulation of 1, 2-propanediol and enhancement of aerobic stability in whole crop maize silage inoculated with Lactobacillus buchneri [J]. Journal of Applied Microbiology, 2003, 94(5):800-807.
[15] 张以芳, 罗福成, 刘旭川.微贮饲料添加剂及微贮饲料技术[J].草业科学, 2006, 6:67-70.
[16] Danner H, Holzer M, Mayrhuber E, et al. Acetic acid increases stability of silage under aerobic conditions [J]. Applied and Environmental Microbiology, 2003, 69(1):562-567.
[17] 张晓庆, 樊丽娟.不同发酵型乳酸菌在饲料青贮中应用的研究进展[J].当代畜牧, 2008, 5:24-25.
[18] Driehuis F, Oude Elferink SJWH, Spoelstra SF. Anaerobic lactic acid degradation during ensilage of whole crop maize inoculated with Lactobacillus buchneri inhibits yeast growth and improves aerobic stability [J]. Journal of Applied Microbiology, 1999, 87(4):583-594.

