根癌农杆菌介导深红虫草菌株C033转化体系的建立
郭维 王磊 吴宏清 白玲 章卫民
(1.广东省微生物研究所 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室 广东省华南应用微生物重点实验室-省部共建国家重点实验室培育基地,广州 510070;2.江西农业大学理学院,南昌 330045)
虫草(Cordyceps spp. s. l.)是一类重要的真菌资源,主要寄生于昆虫、蜘蛛和某些大团囊菌属地下种类的子实体上,它是一类复型真菌,在其生活史中存在以分生孢子形成为特征的无性型和以子座形成并产生子囊孢子为特征的有性型[1],其种类繁多,代谢产物丰富,且具有多种生物活性[2]。卵孢菌素(Oosporein)是布氏虫草(C. brongniartii)无性型,即布氏白僵菌(Beauveria brongniartii)的一种天然真菌毒素[3]。研究表明,卵孢菌素是布氏白僵菌唯一的主要次级代谢产物,最大产量可达270 mg/L[4]。因此,卵孢菌素在害虫的生物防治中起着重要的作用。迄今为止,卵孢菌素的相关功能基因及其在虫草菌中的合成途径尚不清楚。
深红虫草(C. cardinalis)是一种寄生于鳞翅目幼虫的病原真菌[5]。本实验室在前期研究中分离获得了深红虫草的无性型(菌株C033),通过研究首次发现其发酵提取物具有良好的生物活性,进一步通过发酵产物的分离纯化,获得了红褐色粉末状活性物质——卵孢菌素,且产量较高,得率为120 mg/L[6,7]。此外,该菌株具有生长速度快、产孢量大的特点,是研究虫草菌生物合成卵孢菌素的理想菌株。但是,根据该菌株现有的卵孢菌素产量,有必要通过遗传改造提高该虫草菌合成卵孢菌素的产量,为今后开发出新型高效的生防制剂奠定基础。
为了研究虫草菌的基因功能、基因表达调控和表达体系,建立一个高效的虫草菌转化体系非常关键。目前,对于丝状真菌的转化方法通常有原生质体转化法、醋酸锂转化法、电穿孔转化法和根癌农杆菌介导转化法(Agrobacterium tumefaciens-mediated transformation,ATMT)等[8]。ATMT是一种最为有效的转化方法,具有操作方法简单、转化受体多样、转化效率较高、遗传稳定等优点。在虫草的无性型及相关真菌中已报道了蛹虫草菌、球孢白僵菌、金龟子绿僵菌等利用ATMT法成功地建立了相应的转化体系[9-14]。
由于深红虫草是2004年才报道的一个虫草新种[5],至今国内外还没有关于该虫草菌的转化体系的研究报道。本研究以深红虫草菌株C033作为出发菌株,根癌农杆菌EHA105为基础,构建含遗传霉素抗性基因的双元载体pCambia2301,建立高效的遗传转化系统,旨在为进一步研究其相关功能基因,高效利用深红虫草菌株防治虫害奠定理论基础,同时也为其它虫草菌重要活性代谢产物相关功能基因的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒转化受体 深红虫草(C. cardinalis)菌株C033由本实验室保存;转化供体:根癌农杆菌(A. tumefaciens)EHA105由华中农业大学提供;双元载体pCambia2301购于北京鼎国生物技术有限责任公司,其包含β-葡萄糖苷酶报告基因(gus)和抗性筛选标记新霉素磷酸转移酶基因(nptⅡ),这2个基因均受CaMV 35S启动子调控,其中gus基因包含一个内含子,可消除残余菌液中的gus基因表达行为,pCambia2301载体通过冻融法导入到农杆菌EHA105菌株。该载体T-DNA 区域的结构见图1。

图1 双元载体pCambia 2301的T-DNA结构
1.1.2 试剂 遗传霉素(G418)、头孢霉素、乙酰丁香酮(AS)购自德国罗氏公司;卡那霉素购自Sigma公司;Ex Taq DNA聚合酶购于日本TaKaRa公司;gus检测液:X-GluC溶液、50 mmol/L的磷酸钠缓冲液、50 mmol/L的铁氰化钾溶液、50 mmol/L的亚铁氰化钾溶液、0.5 mol/L的EDTA溶液,pH8.0。
1.1.3 培养基 C8固体培养基(%):葡萄糖5,蛋白胨1,KNO30.2,MgSO40.2,(NH4)3PO4·3H2O 0.2,CaCl20.01,琼脂1.5,蒸馏水定容,pH自然,用于虫草菌的培养。
YEB固体培养基(g/L):蛋白胨5,蔗糖5,牛肉膏5,酵母提取物1,MgSO40.24,蒸馏水定容,pH7.2,用于农杆菌的活化培养。
MM液体培养基(g/L):K2HPO41.45,KH2PO42.5,NaCl 0.15,MgSO40.5,CaCl20.066,FeSO40.0008,(NH4)2SO40.5,葡萄糖1.8,0.5%甘油(W/V),蒸馏水定容,pH自然,用于农杆菌的扩大培养。
随着电喷柴油机和电控系统相关技术不断发展,电喷柴油机主机遥控系统的设计与实现提出的功能需求不断演变。下面以MAIN的电喷主机的接口和配套的主机遥控系统实现的功能为例进行分析。
IM培养基的组成同MM,另加200 μmol乙酰丁香酮(AS),pH5.3,用于农杆菌的诱导培养。
1.2 方法
1.2.1 菌株C033对遗传霉素(G418)的敏感性试验 将无菌水配制的虫草菌分生孢子悬浮液稀释至106个/mL,取100 μL涂布于含不同浓度G418(0、100、200、400、600和800 μg/mL)的C8平板上,28℃培养4 d,重复3次,根据观察结果,确定G418对深红虫草菌株的最小抑制浓度。
1.2.2 菌株C033分生孢子液的制备 用无菌蒸馏水从培养5-7 d 的C8平板洗下C033菌株的分生孢子,离心后用MM液体培养基重悬,血球计数板计数,再用MM液体培养基将孢子浓度调整为106个/mL。
1.2.3 根癌农杆菌EHA105的转化及活化培养 采用冻融法[15]将质粒pCambia2301直接转化到根癌农杆菌EHA105菌株中,转入含50 μg/mL卡那霉素的YEB平板上培养,挑取单菌落PCR鉴定并测序,结果正常说明转化成功,保存单菌落。从含50 μg/mL卡那霉素的YEB平板上挑取农杆菌单菌落,接种于3 mL YEB液体培养基(含50 μg/mL卡那霉素),28℃、220 r/min振荡培养过夜。
1.2.4 农杆菌介导菌株C033的转化 将培养好的农杆菌菌液250 μL接种于50 mL MM培养基中,28℃、220 r/min扩大培养2 d,检测菌液OD600值,将IM培养基稀释至OD600=0.15,继续在相同条件下培养6-12 h,取100 μL菌株C033孢子悬液和活化的100 μL EHA105(含有pCambia2301)混匀后,均匀涂布到表面铺有滤纸的IM固体培养基上,28℃避光培养2 d。将滤纸转移到含G418和头孢霉素平板上,28℃继续培养2-4 d,挑取长出的单菌落在不含G418的C8平板上传3代,再接种到含G418的C8平板上传2代,若抗性稳定,则初步认定为虫草菌株的转化子,保存菌种。
1.2.5 gus基因组织化学检测 转化子单菌落形成后,接种到含G418和头孢霉素抗性的C8液体培养基的96孔板上,保证每孔一个单菌落,培养3 d后,此时菌落颜色为正常的红色,向每孔加入50 μL的gus检测液,37℃保温过夜,通过组织化学分析确定gus表达的稳定性。
1.2.6 转化子的鉴定 随机挑选10个单孢分离转化子,按改良的CTAB法[16]分别取菌块0.5 g提取基因组DNA。采用PCR扩增检测目的片段,以pCambia2301载体上的gus和nptⅡ基因序列为参考,设计两者的上下游引物,其中gus正向引物为5'-CGTCCTGTAGAAACCCCAAC-3',反向引物为5'-ATTGACCCACATTTGCCGT-3',nptⅡ正 向 引 物为5'-GAGGCTATTCGGCTATGACTG-3',反向引物为5'-ATCGGGAGCGGCGATACCGTA-3'。gus和nptⅡ基因的预期片段长度分别为300 bp和700 bp左右,引物由上海生工生物公司合成。PCR反应体系共20 μL,包括100 ng DNA,200 μmol/L dNTPs,1 μmol/L的上下游引物,1 U Ex Taq DNA 聚合酶,1.5 mmol/L MgCl2,5 μL 10×Taq DNA聚合酶缓冲液。反应程序为:95℃变性5 min;94℃变性45 s,58℃退火45 s,72℃延伸90 s,32个循环;72℃延伸10 min。取5 μL扩增产物于1%琼脂糖凝胶中进行电泳检测。
2 结果
2.1 菌株C033对遗传霉素的敏感性检测
表1显示,当含有G418的C8固体平板的终浓度为400 μg/mL时,虫草菌丝生长明显受到抑制,而当G418浓度达到500 μg/mL时,菌丝完全不能生长。因此,选择遗传霉素G418的最佳筛选浓度为500 μg/mL。

表1 深红虫草菌株C033对遗传霉素G418的敏感性
2.2 转化子gus基因表达的稳定性
从经检测已导入gus基因的菌体上刮取适量菌丝进行组织化学染色检测,发现均不同程度被染成蓝色。转化菌株重新培养20 d后,再挑选6个转化菌株进行组织化学染色检测,仍然被染成蓝色,说明gus基因转入虫草菌株后能持续表达,证明本试验所建立的转化系统是稳定有效的。
2.3 转化子的PCR鉴定
随机选取10个经G418和头孢霉素筛选的转化子,以野生型菌株为阴性对照,质粒pCambia2301为阳性对照,采用CTAB法提取总DNA,用针对nptⅡ基因所设计的引物nptⅡ-F、nptⅡ-R和gus基因所设计的引物gus-F、gus-R进行PCR扩增。PCR产物的琼脂糖凝胶电泳检测结果如图2和图3所示。所挑取的转化子的扩增产物在700 bp和300 bp处均呈现出与阳性对照相同的特异性片段,而阴性对照没有出现特异性条带,初步说明遗传霉素抗性片段插入至虫草菌株转化子的基因组中。

图2 转化子nptⅡ基因的PCR扩增结果

图3 转化子gus基因的PCR扩增结果
2.4 转化条件的优化
2.4.1 菌株C033的孢子浓度 用无菌水将菌株C033的孢子分别稀释至103、104、105和106个/mL,进行转化试验。结果(图4)显示,当孢子浓度为105个/mL时,转化子数目最多,约40个/平板。因此,选择虫草菌孢子的最佳浓度为105个/mL。
2.4.2 根癌农杆菌OD值 分别采用OD600值为0.1、0.2、0.4、0. 6和0.8等5个浓度梯度的农杆菌对孢子浓度为105个/mL的虫草菌株进行转化,结果(图5)显示,当农杆菌OD值为0.6时转化效果最佳。
2.4.3 诱导剂乙酰丁香酮(AS)浓度 调整转化过程中的AS浓度分别为100、150、200、250和300 μmol/L,结果(图6)显示,随着共培养基中AS浓度增高,转化子数目也相应增加,当AS浓度达200 μmol/L时转化子数目达到最高,提高AS浓度至250和300 μmol/L时转化效率逐渐降低,因此200 μmol/L为AS的最佳添加浓度。

图4 菌株C033孢子浓度对转化效率的影响

图5 根癌农杆菌的OD值对转化效率的影响
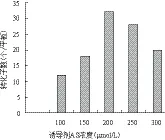
图6 诱导剂AS浓度对转化效率的影响
2.4.4 共培养时间 调整共培养时间为24、36、48、60和72 h,结果(图7)显示,当共培养为24 h时,转化子数量稀少,随共培养时间的延长,转化子数目增多,当培养时间为48 h时,转化子数达到最多,而继续延长共培养时间,转化子数目则逐渐减少。
3 讨论
自1998年de Groot等[17]首次将根癌农杆菌介导转化法应用于丝状真菌的遗传转化以来,已有许多丝状真菌通过ATMT法成功实现了遗传转化。本研究利用这一转化系统成功实现了对深红虫草菌株的遗传转化,建立了该虫草菌的转化体系,并通过分析各转化因素对转化效率的影响优化了转化条件。

图7 共培养时间对转化效率的影响
在虫草菌的遗传转化过程中,首先必须寻找合适的抗生素作为遗传改造的抗性标记。目前,用于真菌转化筛选的抗生素抗性标记中主要有潮霉素(HygB)、遗传霉素(G418)等,而以HygB最为常见。在蛹虫草(C. militaris)的遗传转化中发现HygB对其具有明显抑制效果,因此以它作为抗性标记,利用ATMT法成功获得了转化子,并筛选到虫草突变株[9]。G418及其抗性基因npt II已在啤酒酵母(Saccharomyces cerevisiae)[18]、须癣毛癣菌(Trichophyton mentagrophytes)[19]等真菌的遗传转化中得到应用。本研究通过试验证明,深红虫草菌株C033对HygB具有高度的抗性,因此HygB不宜用来筛选该菌株的转化子。该菌株对新霉素类抗生素较为敏感,因此选择G418用于转化子的筛选。
虫草菌孢子的浓度及农杆菌的菌液浓度、诱导剂AS浓度及共培养时间是实现虫草菌遗传转化的关键因素,因此本研究主要对这些影响因素进行了优化。随着虫草菌孢子浓度的提高,转化效率明显提高,但过高的孢子浓度会造成菌丝的蔓延,不利于转化子的生长。本研究通过对不同孢子浓度的虫草菌进行转化试验,结果虫草菌孢子浓度为105个/mL时转化率最高。在一定的浓度范围内,增加农杆菌的菌液浓度会提高虫草菌的转化效率,但过高的农杆菌浓度反而降低转化效率,其原因可能是农杆菌浓度过高抑制了虫草菌的生长。本试验通过不同浓度的农杆菌对虫草菌株进行转化,结果农杆菌OD值为0.6时转化效果最好。
共培养基中AS能起到诱导活化农杆菌vir基因的作用,浓度太低会导致农杆菌病毒蛋白表达量不够,难以完成转化,AS浓度过高可能会导致T-DNA插入的拷贝数目增加[20]。本试验发现添加不同浓度的AS转化效率不同,当AS浓度达200 μmol/L时转化子数目达到最高。但也有研究发现,在对蛹虫草菌株的转化中添加AS与否并不影响转化效率,说明AS并非是诱导蛹虫草转化所必须的[9],推测这与不同的转化宿主有关。共培养时间关系到农杆菌vir基因的表达、蛋白的活化、T-DNA的剪切和复合物向孢子内的转移,过短的共培养时间将导致转化无法顺利完成,共培养时间太长,非转化子对转化子生长的竞争作用将导致转化效率降低,加大假阳性出现的概率[21]。在本试验中,当共培养时间为48 h时虫草菌的转化子数量最多。
深红虫草菌是鳞翅目幼虫的病原真菌,卵孢菌素为其主要的次级代谢产物[22],在虫草菌侵染昆虫,最终导致昆虫死亡的过程中发挥着重要作用。尽管卵孢菌素的化学结构、理化性质及生物活性已有相关报道[23,24],但其相关功能基因及合成途径尚未见报道。在本研究建立的虫草菌遗传转化体系中,该菌株的生长速度快,产孢量大,转化效率高,获得的转化子遗传稳定性好,由此构建的虫草菌T-DNA插入突变体库将为虫草菌株的选育、相关功能基因的克隆及功能分析,阐明卵孢菌素的合成途径奠定技术基础。
4 结论
遗传霉素和头孢霉素分别为深红虫草菌株C033的有效筛选剂和除菌剂,筛选剂的浓度为500 μg/mL。通过根癌农杆菌EHA105介导建立了深红虫草菌株的遗传转化体系。当根癌农杆菌菌液在600 nm处的吸光值为0.6左右,虫草菌孢子的浓度为105个/mL,AS的浓度为200 μmol/L,根癌农杆菌与虫草菌的共培养时间为48 h时,该体系的转化效率最高,可获得约100个转化子。
[1] 梁宗琦.中国真菌志(第32卷):虫草属[M].北京:科学出版社, 2007:1-17.
[2] 胡丰林, 李增志.虫草及相关真菌的次生代谢产物及其活性[J].菌物学报, 2004, 26(4):607-632.
[3] Eyal J, Mabud MDA, Fischbein KL, et al. Assessment of Beauveria bassiana nov. EO-1 strain, which produces a red pigment for microbial control [J]. Appl Biochem Biotechnol, 1994, 44(1):65-80.
[4] Strasser H, Abendstein D, Stuppner H, et al. Monitoring the distribution of secondary metabolites produced by the entomogenous fungus Beauveria brongniartii with particular reference to oosporein [J]. Mycol Res, 2000, 104(10):1227-1233.
[5] Sung GH, Joseph WS. Cordyceps cardinalis sp. nov., a new species of Cordyceps with an east Asian-eastern North American distribution [J]. Mycologia, 2004, 96(3):658.
[6] 李义勇, 陈玉婵, 李冬利, 等.几种虫草菌发酵提取物的抗菌抗肿瘤活性研究[J].食品工业科技, 2010, 31(6):88-90, 93.
[7] 李冬利, 李义勇, 陈玉婵, 等.一种深红虫草及利用其制备卵孢菌素的方法和其用途[P]. 中国专利:CN 102168108, 2011-08-31.
[8] 陈东亮, 李纪元, 范正琪, 等.根癌农杆菌介导真菌遗传转化的影响因素及应用[J].安徽农业科学, 2010, 38(7):3317-3320.
[9] Zheng ZL, Huang CH, Cao L, et al. Agrobacterium tumefaciensmediated transformation as a tool for insertional mutagenesis in medicinal fungus Cordyceps militaris [J]. Fungal Biol, 2011, 115(3):265-274.
[10] Fang W, Zhang Y, Yang X, et al. Agrobacterium tumefaciensmediated transformation of Beauveria bassiana using an herbicide resistance gene as a selection marker [J]. J Invertebr Pathol, 2004, 85(1):18-24.
[11] Fang W, Pei Y, Bidochka MJ. Transformation of Metarhizium anisopliae mediated by Agrobacterium tumefaciens [J]. Can J Microbiol, 2006, 52(7):623-626.
[12] Luo ZB, Zhang YJ, Zhang KJ, et al. Construction of Beauveria bassiana T-DNA insertion mutant collections and identification of thermosensitive and osmosensitive mutants [J]. Acta Microbiol Sin, 2009, 49(10):1301-1305.
[13] Kirkland BH, Westwood GS, Keyhani NO. Pathogenicity of entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae to Ixodidae tick species Dermacentor variabilis, Rhipicephalus sanguineus and Ixodes scapularis [J]. J Med Entomol, 2004, 41(4):705-711.
[14] Dos Reis MC, Pelegrinelli Fungaro MH, Delgado Duarte RT, et al. Agrobacterium tumefaciens-mediated genetic transformation of the entomopathogenic fungus Beauveria bassiana [J]. J Microbiol Methods, 2004, 58:197-200.
[15] 王学全, 沈晓, 任天年, 等.根癌农杆菌EHA105和LBA4404冻融法转化条件的优化研究[J]. 药物生物技术, 2011, 18(5):382-386.
[16] 孙立夫, 张艳华, 裴克全.一种高效提取真菌总DNA的方法[J].菌物学报, 2009, 28(2):299-302.
[17] de Groot MJ, Bundock P, Hooykaas PJ, et al. Agrobacterium tumefaciens-mediated transformation of filamentous fungi [J]. Nat Biotechnol, 1998, 16(9):839-842.
[18] Guerra OG, Rubio IGS, Filho CGDS, et al. A novel system of genetic transformation allows multiple integrations of a desired gene in Saccharomyces cerevisiae chromosomes [J]. J Microbiol Methods, 2006, 67(3):437-445.
[19] Yamada T, Makimura K, Hisajima T, et al. Genetic transformation of the dermatophyte, Trichophyton mentagrophytes, based on the use of G418 resistance as a dominant selectable marker [J]. J Dermatol Sci, 2008, 49(1):53-61.
[20] Covert SF, Kapoor P, Lee M, et al. Agrobacterium tumefaciensmediated transformation of Fusarium circinatum [J]. Mycol Res, 2001, 105(3):259-264.
[21] Huser A, Takahara H, Schmalenbach W, et al. Agrobacterium tumefaciens-mediated transformation as a tool for random mutagenesis of Colletotrichum trifolii [J]. J Gen Plant Pathol, 2004, 70(2):93-96.
[22] 李义勇.虫草菌次级代谢产物及其生物活性研究[D].宜昌:三峡大学, 2010.
[23] Seger C, Erlebach D, et al. Physicochemical prorerties of oosporein, the major secreted metabolite of the entomopathogenic fungus beauveria Brongniartii [J]. Helv Chim Acta, 2005, 88(4):802-810.
[24] Toshinori N, Kengo N, Kenji K, et al. Antifungal activity of oosporein from an antagonistic fungus against Phytophthora infestans [J]. Verlag der Zeitschrift für Naturforschung, 2004, 59(3-4):302-304.

