河西绒山羊GOLA-DQA1基因第2外显子遗传特征分析
柴文琼 王继卿 胡江 刘秀 李少斌 罗玉柱
(甘肃农业大学甘肃省草食动物生物技术重点实验室 动物科学技术学院 研究测试中心,兰州 730070)
主要组织相容性复合体(major histocompatibility complex,MHC)是由紧密连锁的高度多态性基因座所组成的染色体上的一个与免疫应答和抗病性密切相关的多基因复合体。它广泛存在于脊椎动物中,决定着动物的免疫排斥反应[1]。MHC基因复合体由Ⅰ、Ⅱ类和Ⅲ类3类基因组成。Ⅱ类基因包括高度多态的DQ和DR基因家族,DQ 基因家族至少含有DQA1、DQA2、DQB1和DQB2等4个基因座位。它们所编码的MHC抗原在其免疫系统中发挥着最重要的作用,与家畜的多种疾病之间存在强相关。如牛乳房炎、口蹄疫、慢性后脊椎轻瘫,绵羊的线虫、痒病、包虫病,鸡传染性疾病等[2-6]。山羊的MHC 称为GoLA(Goat lymphocyte antigen),即山羊白细胞抗原。山羊GoLA的结构和功能与牛、绵羊非常相似,具有高度多态性和连锁不平衡的特点。国内外对山羊GoLA遗传多态性的研究主要集中在GoLADRB1和GoLA-DRB3[7-9]基因上,但是尚未见我国优良地方山羊品种DQA基因的研究报道,明显不利于我国地方山羊品种的合理利用和抗病育种研究。
河西绒山羊是中国固有的三大绒山羊品种之一,现存栏116.8万只(占甘肃省山羊存栏总量的30.22%),是甘肃省绒山羊生产的重要遗传资源。但流产严重影响着河西绒山羊的健康发展。据课题组对26 831只河西绒山羊适繁母羊的调查,河西绒山羊平均流产率达20%以上。其他学者也证实了河西绒山羊流产病的发生[10]。目前还没有针对山羊流产的专用治疗药物,因此只能通过药物预防和加强饲养管理来降低流产率,但使用药物会造成畜产品品质下降(如羊肉),且和加强饲养管理一样,虽然在预防流产中发挥了重要作用,但无法根除它。相同环境条件下个体对山羊流产病的抗性有差异,为从遗传本质上消灭此病提供了理论依据,但前提是需要找到与流产相关的抗性等位基因。因此,本研究应用PCR-SSCP和测序技术,以与家畜多种疾病存在强相关的GOLA-DQA1基因为研究对象,分析河西绒山羊DQA1基因第2外显子的遗传特征,探讨等位基因频率与山羊流产的相关性,以期为河西绒山羊抗流产病分子育种提供基础性资料。
1 材料与方法
1.1 材料
采集864只河西绒山羊血样记录是否流产,其中正常个体610只,流产254只。颈静脉采血10 mL,ACD抗凝,-20℃保存。采用常规酚-氯仿抽提法提取血液基因组DNA[11]。
1.2 方法
1.2.1 引物设计及PCR扩增 参照GenBank中山羊DQA1基因第2外显子序列(AY464657)设计1对引物,由大连宝生物有限公司合成。引物序列见表1。
PCR反应体系:总体积20 μL,5 U/μL Taq酶0.2 μL,2.5 mmol/L dNTP 0.3 μL,10×Buffer(含2.5 mmol/L Mg2+)2 μL,10 pmol/μL引物0.4 μL,模板1 μL,加H2O补足20 μL。PCR反应条件:94℃预变性2 min;94℃ 30 s,60℃ 35 s,72℃ 30 s,共32个循环;72℃ 7 min,4℃保存。PCR产物用1.5%的琼脂糖凝胶(含EB)检测,用凝胶成像仪检验扩增效果。
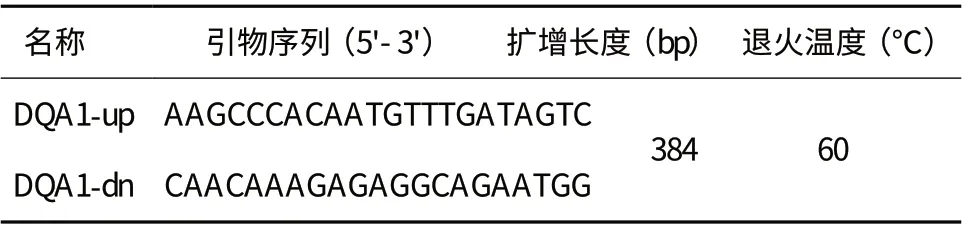
表1 DQA1基因第2外显子的引物序列、扩增长度及退火温度
1.2.2 SSCP分析及序列测定 取PCR产物2-3 μL,与8 μL加 样 缓 冲 液(98% formamide,10 mmol/L EDTA,0.025% bro-mophenol blue,0.025% xylenecyanol)混合,98℃变性10 min,立即转置冰上冷却,加入14%(37.5∶1)的非变性聚丙烯酰胺凝胶,在0.5×TBE、4℃、280 V电压下,电泳18 h。为保证内循环温度不受外界温度影响,电泳在温控室进行。电泳结束后,采用银染法显色,判定等位基因和基因型。
1.2.3 测序 纯合子PCR产物送北京六合华大基因科技股份有限公司直接进行序列测定,杂合子克隆后对菌液进行序列测定。为确保结果准确,所有等位基因序列均选择2个以上的不同个体测序2次。
1.2.4 数据分析 根据文献[12,13]统计基因型,计算χ2值、多态信息含量(PIC)、有效等位基因数(Ne)和位点的杂合度(He)。使用SPSS16.0软件比较河西绒山羊不同等位基因与山羊流产的关联性。
2 结果
2.1 DQA1基因第2外显子PCR-SSCP检测结果与序列分析
PCR-SSCP检测结果(图1)显示,河西绒山羊DQA1第2外显子共存在A、B、C、D、E、F、G、H、I 9个等位基因。与GenBank中山羊GOLA-DQA1基因第2外显子序列比对发现,GOLA-DQA1*B、GOLADQA1*E和GOLA-DQA1*H 3个等位基因为本研究新发现,Cahi-DQA1.7[14]未在本研究中发现。根据等位基因核苷酸序列比对结果(图2)显示,河西绒山羊DQA1中发现42个核苷酸多态位点,占总分析位点的12.65%(42/332)。其中转换位点23个,占核苷酸多态位点的54.76%(23/42),包括G/A的转换位点15个,T/C的转换位点8个;颠换位点13个,占核苷酸多态位点的30.95%(13/42);转换和颠换共存位点5个,占11.9%(5/42);本试验还发现1个插入位点(17位点)。因此,河西绒山羊DQA1基因第2外显子多态性较丰富,转换在核苷酸多态位点中占优势(54.76%)。

图1 河西绒山羊GOLA-DQA1基因第2外显子PCR-SSCP检测结果
2.2 DQA1基因第2外显子遗传特征分析
河西绒山羊DQA1等位基因频率(表2)表明,在9等位基因中GOLA-DQA1*G的频率最高(21.82%),其次是GOLA-DQA1*D和GOLA-DQA1*C,等位基因频率分别为18.75%和15.16%。等位基因GOLA-DQA1*B和GOLA-DQA1*I的频率最低,仅分别为4.22%和2.60%。
多态性分析结果(表3)表明,河西绒山羊多态信息含量为0.837 9,属于高度多态,杂合度和有效等位基因数分别为0.421 3和6.879 5,说明河西绒山羊有丰富的遗传多样性。经χ2适合性检验,河西绒山羊各基因座位的基因频率分布明显偏离Hardy-Weinborg平衡(P<0.01)。

表2 河西绒山羊DQA1基因第2外等位基因频率
2.3 DQA1基因第2外显子多态性与山羊流产关联性分析
经SPSS单变量线性模型分析(表4)[15],病例组与正常组之间的等位基因分布差异显著(P<0.05),病例组中等位基因GOLA-DQA1*A的频率显著高于正常组(P<0.05),等位基因GOLA-DQA1*H的频率显著低于正常组(P<0.05)。其余各等位基因频率无显著差异(P>0.05)。
3 讨论

表3 DQA1基因第2外显子群体遗传结构

表4 河西绒山羊正常组与病例组等位基因频率
多态性且多碱基突变是脊椎动物MHC的一个突出特点。与人类、小鼠、牛、猪、绵羊和家禽等相比,山羊MHC遗传多态性的研究主要集中在DRB1和DRB3两个等位基因[7-9,16]上,结果表明山羊DRB1、DRB3基因多态性极为丰富。有关GoLA-DQA1基因的研究很少,只有Amills等[17]利用PCR-SSCP 方法检测到7个等位基因,发现了23个氨基酸多态位点。Zhou 等[18]在GoLA-DQA2中发现了11个等位基因。本研究应用PCR-SSCP技术,在河西绒山羊GoLA-DQA1基因中检测到9个等位基因。与GenBank中已有序列相比,本研究在DQA1中新发现了GoLA-DQA1*B、GoLA-DQA1*E和GoLADQA1*H3个等位基因,未发现Cahi-DQA1.7。本研究结果使DQA1等位基因数目从7个增加到9个。同时在DQA1中发现42个核苷酸多态位点(占总分析位点的12.65%),表明该基因具有高度的多态性。这主要与河西绒山羊常年生活在海拔1 400-5 564 m的干旱、寒冷、缺氧的严酷条件下,具有的适应性强、耐粗饲、抗病性强等特性有关。由于地理环境改变产生的选择作用产生了物种的多样性,不同环境中所接触的病原体不同,所以其免疫系统要增加遗传多样性来应对这种情况,这是MHC对环境和病原体的适应性的体现。动物体只有具有多态的机体免疫系统才能适应千差万别的外界环境。由于动物MHC起抗原呈递作用、与免疫应答密切相关,因此作为主要编码MHC肽结合区(Peptide-binding region,PBR)的DQA1基因也表现为丰富的多态性。新等位基因的出现可能与其所处的地理环境和山羊品种有关。
许多研究表明,DQA1与人类和家畜部分疾病的易感性和抗性有关,它能诱导强排斥反应并参与免疫调节[19,20]。Demurov等[21]报道莫斯科人2型糖尿病与DQA1*0301呈正相关。Lunden等[22]研究发现只有一种DQ单倍型与奶牛乳房炎易感性显著相关。国外学者对高加索人群研究结果表明,反复自然流产(recurrent spontaneous abortion,RSA)的发生与单倍型DQA1*0201-DQB1*0201、DQA1*0101-DQB1*0501、DQA1*0501-DQB1*0201相关[23]。我国林其德等[24]研究上海人群不明原因RSA患者,发现DQA1*01-DQB1*0604,0605单倍型可能是该病的易感单倍型。本试验结果表明,GoLA-DQA1不同等位基因对流产的易感性和抗性存在差异。在相同的饲养管理及防疫条件下,不同表型间的等位基因分布差异显著(P<0.05),病例组中等位基因GoLADQA1*A的频率显著高于正常组(P<0.05),等位基因GoLA-DQA1*H的频率显著低于正常组(P<0.05)。由此推测等位基因GoLA-DQA1*A与流产的易感性相关,GoLA-DQA1*H与流产抗性有关。但需进一步扩大试验群体样本量进行深入研究,以确定山羊流产的有效分子标记,为河西绒山羊抗病育种奠定良好的基础。
4 结论
在河西绒山羊GoLA-DQA1基因第2外显子中检测到9个等位基因,其中GoLA-DQA1*B、GoLADQA1*E和GoLA-DQA1*H 3个为本研究首次发现。9个等位基因中存在42个核苷酸多态位点,占总分析位点的12.65%。其中转换位点23个,颠换位点13个,转换和颠换共存位点5个,插入位点1个。说明河西绒山羊GoLA-DQA1具有丰富的多态性。相关性结果表明,不同表型间的等位基因分布差异显著(P<0.05),等位基因GoLA-DQA1*A可能与流产的易感性相关,GoLA-DQA1*H可能与流产抗性相关。
[1] Anlong X. Polymorphism in BoLA-DRB3 exon2 correlated with resistance to persisten. Lymphocytosis caused by Bovine Leukemia virus [J]. Journal of Immunology, 1993, 15(12):6977-6985.
[2] 张夫千, 郑小敏, 唐大伟, 等. 荷斯坦牛BoLA-DRB3 基因多态性及其与乳房炎抗性关系分析[J].畜牧兽医学报, 2007, 38(2):115-119.
[3] Aarestrup FM, Jensen NE, Ostergard H. Analysis of association between major histocompatibility complex (BOLA) class I haplotypes and subclinical mastitis of dairy cows [J]. Dairy Science, 1995, 78(8):1684-1692.
[4] 贾斌, 申红, 余智勇, 等.多浪羊和中国美利奴羊MHC-DRB1基因多态性与包虫病的遗传易感性[J].中国人畜共患病学报, 2007, 23(10):1004-1008, 1012.
[5] Sayers GG, Hanrahan B, Ryan JP, et al. Major histocompatibility complex DRB1 gene:its role in nematode resistance in Suffolk and Texel sheep breeds [J]. Parasitology, 2005, 131(3):403-409.
[6] 李国勤, 卢立志, 王得前, 等.鸡MHC 与传染性疾病遗传抗性的相关性研究进展[J].遗传, 2006, 28(7):893-898.
[7] 孙东晓, 张沅, 李宁.蒙古山羊和哈萨克山羊GOLA-DRB3基因的HaeⅢ切多态性分析[J].遗传, 2004, 26(1):55-58.
[8] Li MH, Li K, Kantanen J, et al. Allelic variations in exon2 of caprine MHC class II DRB3 gene in Chinese indigenous goats [J]. Small Ruminant Research, 2006, 66(1):236-243.
[9] 杨易, 徐金瑞, 王杰, 等.四川4个山羊品种MHC-DRB3外显子2的多态性[J].黑龙江畜牧兽医, 2006(1):12-15.
[10] 张贞明, 张少平.甘肃河西绒山羊流产原因调查与防治[J].中国草食动物, 2009, 29(5):38-40.
[11] Sambrook J, Fritsch EFMT. Molecular Cloning [M]. Second edition. New York:Cold Spring Habor Laboratory, 1999.
[12] Yang D, Chen H, Wang X, et al. Association of polymorphisms of leptin gene with body weight and body sizes indexes in Chinese indigenous cattle [J]. Journal of Genetics & Genomics, 2007, 34 (5):400-405.
[13] Rupp R, Hernardez A, Mallard BA, et al. Association of bovine leukocyte antigen (BoLA) DRB3.2 with immune response, mastitis, and production and type traits in Canadian Holsteins [J]. J Dairy Sci, 2007, 90 (2):1029-1038.
[14] Amills M, Sulas C, Sanchez A, et al. Nucleotide sequence and polymorphism of the caprine major histocompatibility complex class II DQA1 (Cahi-DQA1) gene [J]. Molecular Immunology, 2005, 42(3):375-379.
[15] Forrest RH, Hickford JGH, Frampton CM. Polymorphism at the ovine β3-adrenergic receptor locus (ADRB3) and its association with lamb mortality [J]. J Anim Sci, 2007, 85(11):2801-2806.
[16] 彭林泽, 袁其彬, 郭玉强, 等.多浪羊MHC-DRB1基因的Hae Ⅲ酶切多态性[J].石河子大学学报:自然科学版, 2007(2):177-179.
[17] Amills M, Sulas C, Sanchez A, et al. Nucleotide sequence and polymorphism of the caprine major histocompatibility complex class II DQA1 (Cahi-DQA1) gene [J]. Molecular Immunology, 2005, 42(3):375-379.
[18] Zhou H, Hickford JGH, Fang Q. Polymorphysim of the DQA2 gene in goats [J]. J Anim Sci, 2005, 83(5):963-968.
[19] Wedekind C, Walker M, Portmann J, et al. MHC-linked susceptibility to a bacterial infection, but no MHC-linked cryptic female choice in whitefish [J]. J Evol Biol, 2004, 17(1):11-18.
[20] Traul DL, Li H, Dasgupta N, et al. Resistance to malignant catarrhal fever in America bison (Bison bison) is associated with MHC class lla polymorphisms [J]. Animal Genetics, 2007, 38(2):141-1461.
[21] Demurov LM, Chistiakov DA, Kondrate'v IuIu, et al. Polymorphism of HLA-DQA1 and DQB1 genes in the Moscow population and in patients with diabetesmellitus type I and II [J]. Mol Biol, 1998, 32(6):964-969.
[22] Lunden A, Sigurdardottir S, Edfors-Lilja I, et al. The relationship between bovine major histocompatility complex classⅡ polymorphism and disease studied by use of bull breeding values [J]. Animal Genetics, 1990, 21(3):221-232.
[23] Steck T, van Der, Ven K, et al. HLA-DQA1 and HLA-DQB1 haplotypes in aborted fetuses and couples with recurrent spontaneous abortion [J]. Reprod Immunol, 1995, 29(2):95-104.
[24] 林其德, 陆佩华, 汪希鹏, 等.原因不明习惯性流产患者人类白细胞抗原-DQ区域基因多态性的研究[J]. 中华妇产科杂志, 2001, 36(5):293-295.

