反胶束体系中脂肪酶催化乙酸甲酯与棉籽油合成生物柴油
左晓旭,李芳芳,龚春霞,高剑峰
(石河子大学 生命科学学院,新疆 石河子 832000)
反胶束是一种由表面活性剂(有时还需助表面活性剂)在含少量水的非极性溶剂中自发形成的透明或半透明的热力学稳定系统[1-2],其内部可溶解水和其他水性分子,这些水性分子所形成的膜能将油水两相分开。高度分散的反胶束体系不仅为酶催化提供更大的相界面,且避免了酶和周围有机相接触,从而使酶保持较高活性[3]。利用酶法合成生物柴油具有反应条件温和、产物易回收、无污染物排放等优点[4-7];但该方法也存在一些问题:由于甲醇等短链醇对酶等蛋白质有变性作用,因而过量的短链醇对酶催化反应有很强的抑制作用,使酶活性降低甚至失去活性。若用乙酸甲酯作为制备生物柴油的酰基受体,其自身不仅能和油脂完全混溶,且反应副产物三乙酸甘油酯对脂肪酶也无毒害作用[8]。
采用固定化脂肪酶催化酯化和酯交换反应生产生物柴油已有很多报道[9-12]。 唐功等[13]研究了反胶束体系中的酶催化反应,证明反胶束不仅可溶解酶,而且还可包埋细胞,从这个意义上讲反胶束是一种新的生物催化剂固定化技术;他们还利用丁二酸二酯磺酸钠(AOT)/正己烷反胶束体系催化合成己酸乙酯[14]。刘伟东等[15-16]在AOT/异辛烷反胶束体系中,以甲醇作为酰基受体,用Candida sp.99-125脂肪酶催化合成生物柴油,AOT反胶束体系为Candida sp.99-125脂肪酶催化大豆色拉油合成生物柴油提供了合适的微环境。Badenes等[17]在AOT/异辛烷反胶束体系中,用角质酶催化甲醇和甘油三脂制备生物柴油,生物柴油收率超过75%。但在AOT/异辛烷反胶束体系中,用乙酸甲酯作为酰基受体来制备生物柴油尚未见报道。
本工作发挥新疆本地优势资源,以棉籽油为原料利用生物法合成生物柴油。用乙酸甲酯代替甲醇作为酰基受体,AOT反胶束作为酶的催化介质,考察了反应条件的影响以及脂肪酶的重复使用性能。
1 实验部分
1.1 原料与试剂
棉籽油:新疆石河子市新安棉油有限责任公司;乙酸甲酯:分析纯,天津市光复科技发展有限公司;石油醚:分析纯,天津市富宇精细化工有限公司;脂肪酶(100~400 U/mg)、AOT(纯度96%)、异辛烷(色谱纯)及油酸甲酯、亚油酸甲酯、棕榈酸甲酯、硬脂酸甲酯标准品(色谱纯):Sigma公司。
1.2 实验方法
1.2.1 AOT反胶束体系的制备
按照一定的比例先后向50 mL三角瓶中加入60 mmol/L的AOT异辛烷溶液2.5 mL和溶有适量脂肪酶的缓冲溶液,在振荡器上振荡10 min,制成反胶束体系。
1.2.2 基本反应体系
在上述反胶束体系中依次加入1 g棉籽油和382.3 μL乙酸甲酯,用保鲜膜封口,放入30 ℃摇床中振荡反应。改变反应条件进行实验,定时取样。将试样用石油醚稀释50倍,经微孔滤膜过滤后分析。
1.3 分析方法
采用Agilent公司7890A型气相色谱仪对产物进行分析,色谱柱为HP-INNOHAA(30 m×0.32 mm×0.5 μm),FID检测。色谱柱升温程序:初温180 ℃保持2 min,以5 ℃/min升至220 ℃保持3 min。进样口温度250 ℃,检测器温度260 ℃,分流比30∶1,载气为高纯N2,进样量2 μL。
通过标准试样定性分析,确定产物中含有硬脂酸甲酯、棕榈酸甲酯、油酸甲酯和亚油酸甲酯4种脂肪酸甲酯;用外标法定量分析脂肪酸甲酯的含量,并用式(1)计算脂肪酸甲酯的收率(Y):

式中,ρ1为产物中脂肪酸甲酯的质量浓度,g/mL;ρ2为棉籽油完全甲酯化后脂肪酸甲酯的质量浓度,g/mL。
1.4 脂肪酶的重复使用
每一批次反应结束后,取样待测;然后直接向原体系中加入1 g棉籽油和适量充当酰基受体的有机溶剂,进行下一批次反应;直至反应后的脂肪酸甲酯收率降至40%以下,停止实验。第N批脂肪酸甲酯收率(YN)的计算方法见式(2):

式中,N为反应批次;YTN,YTN-1分别为第N批和第N-1批反应结束时的总脂肪酸甲酯收率。
2 结果与讨论
2.1 单因素实验
分别考察了AOT浓度、水与AOT的质量比(ζ0)、脂肪酶用量、缓冲溶液pH、乙酸甲酯与棉籽油的摩尔比(r)、反应温度和摇床转速等各种单因素对脂肪酶催化棉籽油与乙酸甲酯合成生物柴油反应的影响。
2.1.1 AOT浓度的影响
表面活性剂的浓度关系到反胶束的形成和脂肪酶的催化活性。浓度太低,无法形成反胶束体系,而浓度太高,阴离子表面活性剂对脂肪酶有毒害作用,抑制酶的活性。AOT浓度对脂肪酸甲酯收率的影响见图1。由图1可看出,随AOT浓度的增加,脂肪酸甲酯收率提高,当AOT浓度为50 mmol/L时,脂肪酸甲酯收率达到最大值64.5%,即此浓度的表面活性剂既能维持反胶束体系的稳定又能保持酶的催化活性;继续增加AOT浓度,脂肪酸甲酯收率降低。因此,适宜的AOT浓度为50 mmol/L。
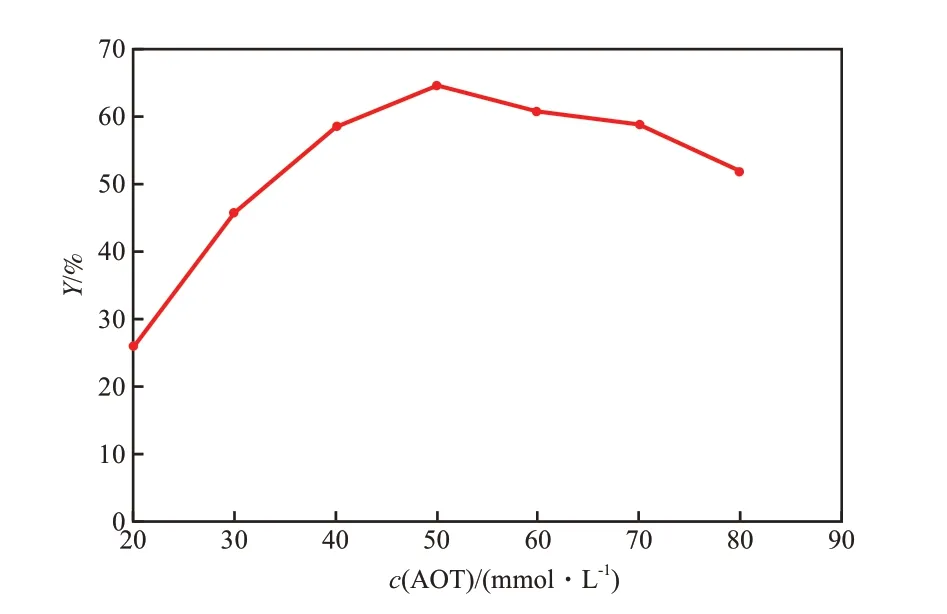
图1 AOT浓度对脂肪酸甲酯收率的影响Fig.1 Effect of AOT concentration on the yield of fatty acid methyl ester(Y).
2.1.2 含水量的影响
在有机相中进行的酶催化反应,水的存在是维持脂肪酶催化活性的重要因素。对于反胶束体系,ζ0过小时,反胶束的水池尺寸较小,不能完全容纳下酶分子,导致体系中的自由水大部分与表面活性剂结合,不够维持脂肪酶活性构象所需的自由水,从而使酶分子在有机溶剂中失活;ζ0太大时,酶分子虽能完全增溶于反胶束水池内,但反胶束的稳定性下降。ζ0对脂肪酸甲酯收率的影响见图2。由图2可看出,当ζ0=3~5时,随ζ0的增加,脂肪酸甲酯收率下降;ζ0继续增至7时,脂肪酸甲酯收率提高到最大值62.5%;当ζ0>7后,随ζ0的增加,脂肪酸甲酯收率逐渐降低。因此,适宜的ζ0=7。

图2 ζ0对脂肪酸甲酯收率的影响Fig.2 Effect of ζ0 on Y.
2.1.3 脂肪酶用量的影响
在反胶束体系中,脂肪酶应完全包容在反胶束水池中。在一定范围内增加脂肪酶用量,可提高反应的转化率;但当达到一定用量后,由于酶促界面的限制,转化率不再提高。因此在反应体系中维持合适的脂肪酶用量非常重要。脂肪酶用量对脂肪酸甲酯收率的影响见图3。由图3可看出,脂肪酸甲酯收率随脂肪酶用量的增加而提高,当脂肪酶用量为15 mg(溶液体积为2.5 mL,下同)时,脂肪酸甲酯收率达到最大值59.6%;继续增加脂肪酶用量,脂肪酸甲酯收率反而有所下降。因此,脂肪酶用量为15 mg较为适宜。

图3 脂肪酶用量对脂肪酸甲酯收率的影响Fig.3 Effect of lipase dosage on Y.
2.1.4 缓冲溶液pH的影响
缓冲溶液pH决定脂肪酶分子和反胶束膜所带电荷的种类,它不仅决定酶的活性构象及其在反胶束体系中的溶解能力,而且其变化也可能引起酶分子与反胶束膜之间相互作用的改变,从而多方面地影响酶的催化活力[18]。缓冲溶液pH对脂肪酸甲酯收率的影响见图4。

图4 缓冲溶液pH对脂肪酸甲酯收率的影响Fig.4 Effect of buffer pH on Y.
由图4可看出,随缓冲溶液pH的增大,脂肪酸甲酯收率缓慢提高,缓冲溶液pH=7时达到最大值63.6%;随后脂肪酸甲酯收率随缓冲溶液pH的增大而降低。因此,缓冲溶液pH=7较适宜。
2.1.5 底物配比的影响
底物浓度过高会对酶催化反应产生底物抑制现象,抑制酶的活性;而底物浓度过低又无法使反应向正方向进行。r对脂肪酸甲酯收率的影响见图5。由图5可看出,随r的增大,脂肪酸甲酯收率提高,当r增至4时,脂肪酸甲酯收率达到最大值63.5%;但当r>4后,脂肪酸甲酯收率降低。因此,r=4较适宜。

图5 r对脂肪酸甲酯收率的影响Fig.5 Effect of r on Y.
2.1.6 反应温度的影响
在反胶束体系中控制一定的温度范围,既能提高脂肪酶的活性,又能维持反胶束结构的稳定性。反应温度对脂肪酸甲酯收率的影响见图6。

图6 反应温度对脂肪酸甲酯收率的影响Fig.6 Effect of reaction temperature on Y.
由图6可看出,在一定范围内,随反应温度的升高,脂肪酸甲酯收率提高,当反应温度为40 ℃时达到最大值62.1%,这可能是由于反应温度的升高增加了乙酸甲酯在水中的溶解度,加快了反应速率;当反应温度超过40 ℃时,脂肪酸甲酯收率降低,这可能是由于反应温度升高一方面使反胶束结构不稳定,另一方面改变了酶的活性构象,使其活性降低。因此,最佳的反应温度为40 ℃。
2.1.7 摇床转速的影响
对于反胶束体系中的酶催化反应,摇床转速影响反应的传质和传热,同时也影响反胶束结构的稳定性,因此控制合适的摇床转速对脂肪酶的活性有重要的影响。摇床转速对脂肪酸甲酯收率的影响见图7。由图7可看出,随摇床转速的增大,脂肪酸甲酯收率逐渐升高,当摇床转速为140 r/min时,脂肪酸甲酯收率达到最大值63.8%;但随摇床转速的继续增大,脂肪酸甲酯收率不断降低。这可能是由于摇床转速升高导致胶束之间的碰撞几率增加,反胶束之间重新并合和形成,使得部分脂肪酶在有机溶剂中失活。因此,摇床速度设置在140 r/min较适宜。

图7 摇床转速对脂肪酸甲酯收率的影响Fig.7 Effect of rotating speed on Y.
2.2 正交实验
在单因素实验的基础上,进行了7因素3水平的正交实验。正交实验的因素水平设计见表1,正交实验结果和分析见表2。
由表2可知,在反胶束体系下脂肪酶催化棉籽油与乙酸甲酯合成生物柴油的影响因素大小依次为:缓冲溶液pH>反应温度>r>脂肪酶用量>AOT浓度>摇床转速>ζ0;优化的反应条件为:缓冲溶液pH=7,反应温度35 ℃,r=3,脂肪酶用量10 mg,AOT浓度40 mmol/L,摇床转速160 r/min,ζ0=7。
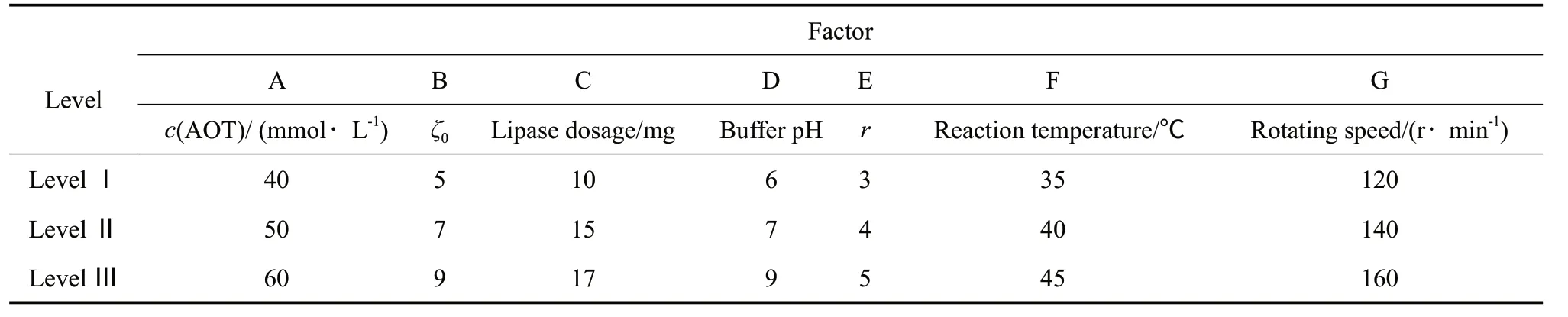
表1 正交实验的因素水平设计Table 1 Orthogonal experimental design

表2 正交实验极差分析Table 2 Range analysis of the orthogonal experiments
2.3 脂肪酶的重复使用性能
在反胶束体系中利用3种酰基受体(甲醇、碳酸二甲酯、乙酸甲酯)与棉籽油催化合成生物柴油,所得脂肪酸甲酯收率最高分别可达73.4%,66.2%,65.53%。由此可知,不同的酰基受体得到的脂肪酸甲酯收率不同。在此基础上,探索了在反胶束体系中脂肪酶催化3种酰基受体与棉籽油合成生物柴油反应中脂肪酶的重复使用性能,实验结果见图8。由图8可看出,在用反应产物作为溶剂、不改变反应体系和反应环境的情况下,使用甲醇时脂肪酶的活性能维持3个批次,在第3个批次后脂肪酸甲酯收率明显下降;使用碳酸二甲酯时脂肪酶的活性能维持4个批次,在第4个批次后脂肪酸甲酯收率虽有所下降,但下降速率比使用甲醇时趋缓;使用乙酸甲酯时脂肪酶的活性能维持7个批次,在第7个批次后脂肪酸甲酯收率的下降趋势仍不明显,说明乙酸甲酯作为酰基受体时,乙酸甲酯及其反应副产物三乙酸甘油酯对脂肪酶均无毒害作用,且对脂肪酶的活性也无明显负面影响,很大程度上提高了脂肪酶的稳定性。相比于甲醇和碳酸二甲酯,乙酸甲酯作为酰基受体时的脂肪酸甲酯收率虽不高,但它对脂肪酶的稳定性和活性的提高具有明显的优势。今后需进一步寻求提高乙酸甲酯作为酰基受体时脂肪酸收率的方法,为生物柴油的生产开拓新的途径。

图8 使用3种酰基受体时脂肪酶的反应批次Fig.8 Enzymatic reactions with three acyl receptors.
3 结论
1)反胶束体系下脂肪酶催化棉籽油与乙酸甲酯合成生物柴油的影响因素大小依次为:缓冲溶液pH>反应温度>r>脂肪酶用量>AOT浓度>摇床转速>ζ0;优化的反应条件为:缓冲溶液pH=7,反应温度35 ℃,r=3,脂肪酶用量10 mg,AOT浓度40 mmol/L,摇床转速160 r/min, ζ0=7。在此反应条件下,脂肪酸甲酯收率最高可达65.53%。
2)与甲醇和碳酸二甲酯相比,在反胶束体系下,乙酸甲酯作为酰基受体与棉籽油合成生物柴油对提高脂肪酶的稳定性具有显著的作用。
3)在反胶束体系中合成生物柴油,使用的是游离脂肪酶,而不必使用固定化脂肪酶,从而大幅降低了成本。表明AOT反胶束体系为脂肪酶催化棉籽油合成生物柴油提供了合适的微环境。今后还需对反胶束体系的反应动力学进行更深入的研究,以寻求进一步提高脂肪酸甲酯收率的方法。
[1] 禹邦超,刘德立. 应用酶学导论[M]. 武汉:华中师范大学出版社,1995:25 - 27.
[2] Yang Fangxiao,Russel A J. Two-Step Biocatalytic Conversion of an Estert an Aldehyde in Reverse Micelles[J]. Biotechnol Bioeng,1994,43(3):232 - 241.
[3] 王乃兴,刘薇,王林.酶催化反应研究进展[J]. 合成化学,2004,12(2):131 - 136.
[4] Selmi B,Thomas D. Immobilized Lipase-Catalyzed Ethanolysis of Sunflower Oil in a Solvent-Free Medium[J]. Am Oil Chem Soc,1998,75(6):691 - 695.
[5] Nelson L A,Foglia T A,Marmer W N. Lipase-Catalyzed Production of Biodiesel[J]. Am Oil Chem Soc,1996,73(8):1191 - 1195.
[6] Iso M,Chen Baoxue,Eguchi M,et al. Production of Diesel Fuel from Triglycerides and Alcohol by Using Immobilized Lipase[J]. Mol Catal B:Enzym,2001,16(1):53 - 58.
[7] Shimada Y,Watanabe Y,Sugihara A,et al. Enzymatic Alcoholysis for Biodiesel Fuel Product-Ion and Application of the Reaction to Oil Processing[J]. Mol Catal B:Enzym,2002,17(3/5):133 - 142.
[8] 田雪. 棉籽油制备生物柴油技术的研究[D]. 石河子:石河子大学, 2009.
[9] 聂开立,王芳,谭天伟. 固定酶法生产生物柴油[J]. 现代化工,2003,23(9):35 - 38.
[10] 邓利,刘柳,董贤,等. 固定化假丝酵母99-125脂肪酶催化酯化脂肪酸低碳醇酯反应条件的研究[J]. 现代化工,2002,22(9):30 - 33.
[11] 田雪,周斌,李鑫,等. 固定化脂肪酶催化棉籽油与碳酸二甲酯反应制备生物柴油[J]. 石油化工,2009,38(6):677 - 681.
[12] 张宝华,潜飞,叶俊丹,等. 脂肪酶的固定化及其催化合成生物柴油[J]. 石油化工,2009,38(12):1336 - 1341.
[13] 唐功,杨兴江,杨子松,等. 反胶束体系中的酶催化反应[J]. 安徽农业科学,2010,38(21):11047 - 11048.
[14] 唐功,杨兴江,任朝琴,等. AOT/正己烷反胶束体系酶催化合成己酸乙酯研究[J]. 粮食与油脂,2010(11):44 - 47.
[15] 刘伟东,聂开立,鲁吉珂,等. 反胶束体系中脂肪酶催化合成生物柴油[J]. 生物工程学报,2008,24(1):142 - 146.
[16] 刘伟东. 反胶束体系下假丝酵母99-125脂肪酶催化合成生物柴油[D]. 北京:北京化工大学,2008.
[17] Badenes S M,Lemos F,Cabral J M S. Transesterification of Oil Mixtures Catalyzed by Microencapsulated Cutinase in Reversed Micelles[J]. Biotechnol Lett,2010,32(3):399 - 403.
[18] 邓欣,方真,胡远飞,等. 微水相超声波协同纳米Ca-Mg-Al固体碱催化制备生物柴油[J]. 石油化工,2009,38(10):1071 - 1075.

