调节性T 细胞与Th17细胞的失衡及其对大鼠肺纤维化的影响*
万 勇, 张 念, 李剑平, 孙洁民
1武汉市第一医院呼吸内科,武汉 430022
2新疆克拉玛依市中心医院呼吸内科,克拉玛依 834000
目前已经有许多研究者发现,调节性T 细胞和Th17细胞平衡的打破与多种自身免疫性疾病的发病有关,如支气管哮喘、风湿性关节炎[1-2]。在对调节性T 细胞的研究中,发现肺纤维化患者的调节性T 细胞数量下降,同时伴有其对效应型T 细胞抑制功能的下降[3]。我们认为肺纤维化作为一种伴有自身免疫紊乱特征的疾病,也存在调节性T 细胞和Th17细胞的不平衡。我们利用气管内注入博来霉素复制大鼠肺纤维化模型,通过免疫细胞化学方法检测IL-2、IL-17、IL-6、TGF-β等细胞因子表达水平,以IL-17的表达水平作为衡量Th17细胞功能的指标;通过流式细胞术检测CD4+调节性T 细胞和CD8+调节性T 细胞的比例,取得十分有意义的结果,现报告如下。
1 材料和方法
1.1 材料
10 只体重在180~200g 的健康SPF 级雌性SD 大鼠,购自武汉大学动物中心。eBioscience公司流式抗体(CD4-FITC、CD8-FITC、CD25-PE、Foxp3-PE-Cy5、Foxp3Staining Buffer Set)、Santa Cruz公司免疫组化一抗抗体(IL-2、IL-6、IL-17、TGF-β)、抗兔二抗(购自DAKO 公司,针对IL-2、IL-17、TGF-β3种一抗,货号K5007)、抗羊二抗(购自KPL公司,针对IL-6一抗)、博来霉素(天津太和制药有限公司,4mg/支)、红细胞裂解液(Beckman Coulter公司)。
1.2 动物分组和处理
SD 健康大鼠10只,随机分为博来霉素组(实验组,n=5)和生理盐水组(对照组,n=5),博来霉素组气管内给药复制大鼠肺纤维化动物模型[4](bleomycin,BLM 5mg/kg),生理盐水组气管内注射等量生理盐水,造模28d期满后处死全部大鼠,取外周血3mL,于左侧肺下叶相同部位的肺组织取材进行常规包埋,石蜡切片。
1.3 肺组织切片苏木精-伊红染色和免疫组织化学检查
肺组织固定、包埋后,制成5μm 厚度的石蜡切片。用苏木精染色液染细胞核3min,流水洗,盐酸乙醇分化,流水洗,氨水返蓝30s,蒸馏水洗,显微镜下观察染色情况。乙醇伊红染细胞质15s。染色后梯度乙醇脱水,二甲苯透明,中性树胶封片,并在显微镜下对肺间质的厚度和肺纤维化的范围进行观察。
免疫组织化学染色按照同济医学院常规方法进行。分别对IL-2、IL-6、IL-17、TGF-β肺组织内的表达水平进行检测。
1.4 流式细胞术检测
通过贝克曼流式细胞仪进行检测。以FSCSSC散点图设定淋巴细胞。然后以CD4-FITC 和SSC设定CD4+T 淋巴细胞为门N。以CD4+淋巴细胞门N 为门选取CD25+CD4+双阳性细胞,并以此CD25+CD4+双阳性细胞为门L2。以CD25+CD4+双阳性细胞为门L2 选取CD4+CD25+Foxp3+3 阳性细胞。通过以上设定,算出CD4+CD25+淋巴细胞/CD4+淋巴细胞、CD4+CD25+Foxp3+淋巴细胞/CD25+CD4+淋巴细胞、CD4+CD25+Foxp3+淋巴细胞/CD4+淋巴细胞比例。同样CD8+CD25+淋巴细胞/CD8+淋巴细胞、CD8+CD25+Foxp3+淋巴细胞/CD25+CD8+淋巴细胞、CD8+CD25+Foxp3+淋巴细胞/CD8+淋巴细胞比例也通过类似设定检测。
1.5 图像分析
石蜡切片苏木精-伊红染色完成后,参照Ashcroft等[5]的文献所述方法进行Ashcroft评分评估肺纤维化的程度。免疫组织化学染色完成后,每张切片选取5个肺间质相似区域,在400倍放大的高倍视野下通过显微镜拍照取图,每次取图保持显微镜光源强度和显微镜放大倍数恒定。通过imagepro plus分析软件对每张图片根据免疫组化阳性着色的深浅及其阳性面积范围计算视野下的积分吸光度。每张切片所有视野的积分吸光度取平均值作为该张切片的积分吸光度。以积分吸光度作为评估目标蛋白表达强弱的指标。
1.6 统计学分析
对两组大鼠Ashcroft评分进行统计学分析,经过方差齐性检测发现方差不齐,采用Mann-Whitney U test进行统计学分析;分别采用两独立样本t检验(标注t值和P 值)和Mann-Whitney U test(标注z值和P 值)对IL-2、IL-6、IL-17和TGF-β积分吸光度和流式细胞学检测结果进行统计学分析。各数据相关分析采用Pearson积差相关分析。
2 结果
2.1 肺组织病理学变化
对照组肺组织切片行苏木精-伊红染色发现,肺泡间隔正常,肺泡的连续性未受到破坏,肺泡的直径和面积大小均匀,大部分区域终末小气道及血管周边无明显炎性细胞浸润表现,有少数个别区域终末小气道管壁有增厚现象及少许炎性细胞浸润表现,未发现纤维化形成。博来霉素组肺组织切片行苏木精-伊红染色发现,肺泡间隔增宽,肺泡的连续性受到破坏,肺泡的直径和面积大小不均匀,终末小气道周边炎性细胞浸润明显,血管周边也发现明显的炎性细胞浸润现象。同时伴有纤维化形成,以支气管周边区域较为明显,外周局部区域也有局灶性的纤维化表现。参照文献实行Ashcroft评分结果如下,对照组(0.28±0.45),博来霉素组(5.76±1.76),Mann-Whitney U test(z 值=-6.192,P<0.01)。见图1。
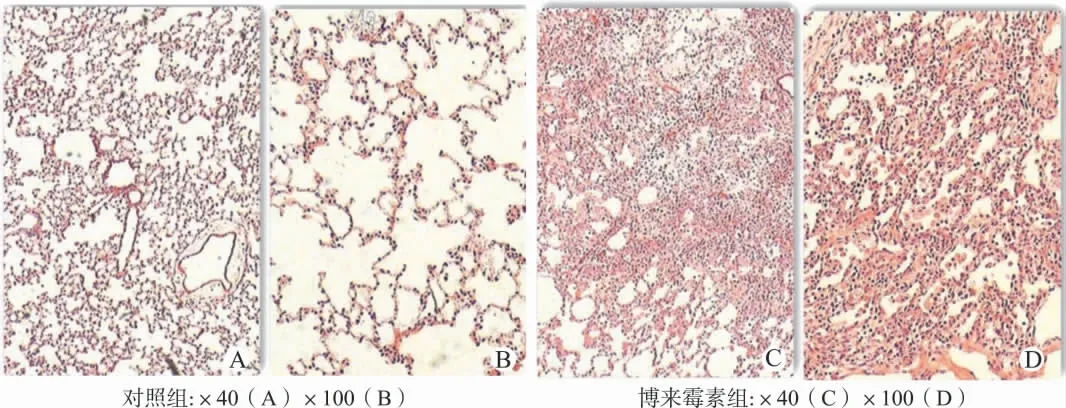
图1 博来霉素组肺组织纤维化与对照组比较(苏木精-伊红染色)Fig.1 Comparison of pulmonary fibrosis between the bleomycin group and the control group(HE staining)
2.2 肺组织免疫组织化学染色
博来霉素组IL-17、IL-6、IL-2和TGF-β的表达水平均较对照组明显升高,差异具有统计学意义,如表1及图2所示。
表1 免疫组化积分吸光度检测结果(±s,n=5)Table 1 The immunohistochemical results of IL-17,IL-6,IL-2and TGF-βin the bleomycin group and the control group(±s,n=5)

表1 免疫组化积分吸光度检测结果(±s,n=5)Table 1 The immunohistochemical results of IL-17,IL-6,IL-2and TGF-βin the bleomycin group and the control group(±s,n=5)
IL-17和TGF-β的积分吸光度数据符合方差齐性,采用独立样本t检验;IL-2和IL-6数据不符合方差齐性,采用Mann-Whitney U test
组别IL-17IL-6IL-2TGF-β 8.06 3 370.07±1 478.14博莱霉素组19 139.15±2 433.30 6 599.45±1 932.89 15 951.37±2 657.63 7 772.23±1 526.46 t或z 值-12.646(t)-2.611(z)-2.611(z)-4.633(t)P 值P<对照组4 419.33±923.65 2 411.16±677.31 6 441.03±1 26 0.01 0.009 0.009 0.002
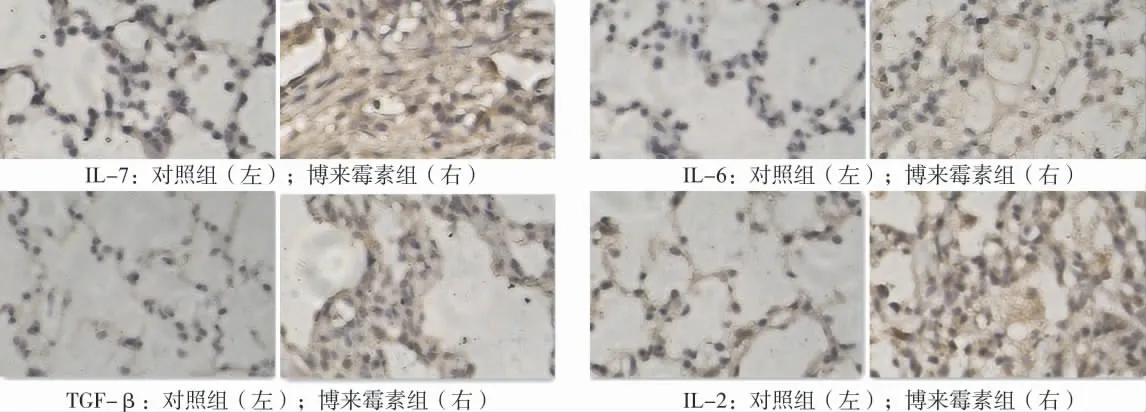
图2 细胞因子在博来霉素组和对照组间的比较(SP法,×100)Fig.2 Comparison of cytokines between the bleomycin group and the control group(SP method,×100)
2.3 流式细胞术检测
博来霉素组的CD4+调节性T 细胞和CD8+调节性T 细胞相关比例与对照组相比,博来霉素组CD8+CD25+Foxp3+细胞占CD8+CD25+细胞百分比较对照组高,差异具有统计学意义(P<0.05);CD4+CD25+Foxp3+细胞占CD4+CD25+细胞百分比两组差异无统计学意义,见表2。
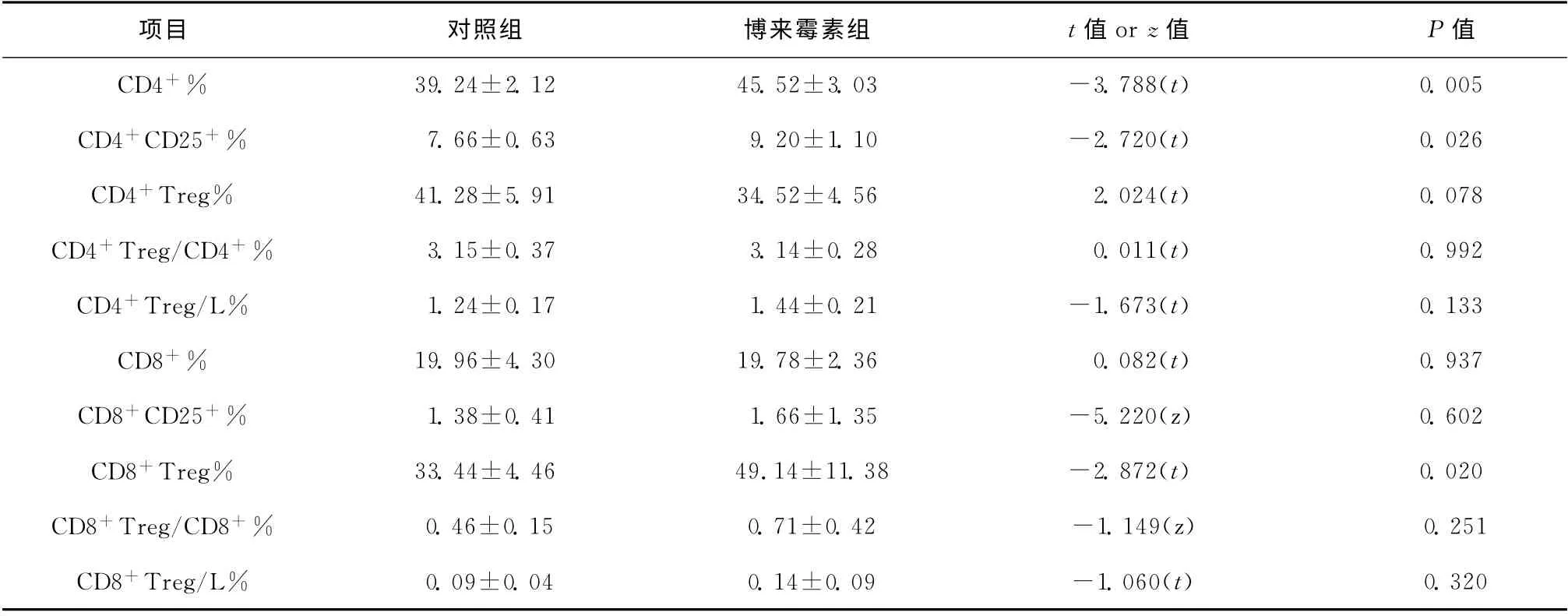
表2 T 细胞亚群和调节性T 细胞在博来霉素组和对照组间的比较Table 2 Comparison of T cell subsets and regulatory T cells between the bleomycin group and the control group
2.4 各细胞因子之间的相关分析
各组样本数据行总体相关分析提示IL-6和IL-17表达水平具有正相关性(r=0.886,P<0.01),IL-17 与TGF-β 具有正相关性(r=0.779,P <0.01)。散点图如图3和图4所示。
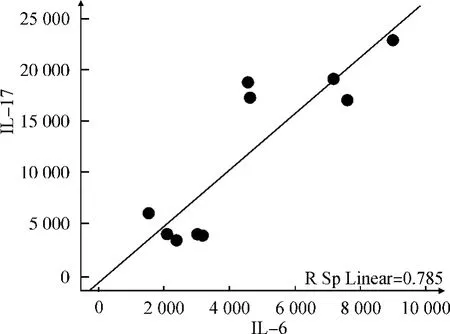
图3 IL-6与IL-17的相关性Fig.3 Correlation between IL-6and IL-17
3 讨论
3.1 IL-17、IL-6等细胞因子与肺纤维化的关系
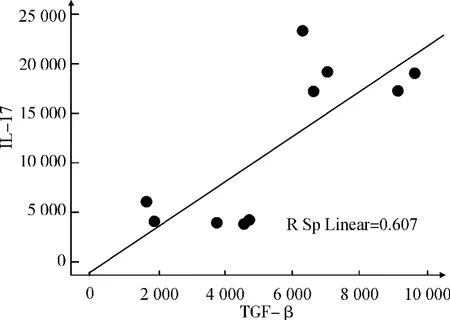
图4 TGF-β与IL-17的相关性Fig.4 Correlation between TGF-βand IL-17
文献报道,IL-17在肺纤维化,支气管哮喘等多种自身免疫疾病中出现了较高的表达,与病情严重程度呈正相关[6-7]。有报告指出IL-17 作为一个致炎因子,通过诱导IL-6和PGE-2的产生,促进中性粒细胞在病灶聚集,使病灶炎症反应加重,同时损伤肺泡上皮细胞,肺泡基底膜[8]。在肺纤维化大鼠的肺成纤维细胞中亦出现IL-17的高表达,同时伴有α-SMA 的合成增加[9]。我们的研究结果同文献一致,发现IL-17在肺纤维化大鼠肺组织内存在高表达,并与肺纤维化严重程度同步上升。IL-17 具有促进纤维化的作用,IL-17既与肺纤维化病灶的损伤有关,也与肺纤维化病灶成纤维细胞聚集及表达异常修复表型有关。
近期研究发现,TGF-β可以诱导人肺成纤维细胞产生新的表型,具有产生平滑肌细胞肌动蛋白的能力,加重肺纤维化[10]。同时有研究发现TGF-β对肺纤维化的促进作用可以通过诱导肺泡上皮细胞向间叶细胞转化,从而影响肺泡组织结构的正常修复[11]。我们前期的研究结果发现,培养的原代肺成纤维细胞可以产生内源性的TGF-β[12]。此次实验结果再次证明肺纤维化大鼠存在TGF-β的高表达。我们推测成纤维细胞和TGF-β之间存在一种正反馈,通过这种正反馈作用,促进肺纤维化的发展。
我们前期的实验发现,肺纤维化大鼠肺组织中有IL-2的表达,随着肺纤维化的加重而增加。排除淋巴细胞和外源性的IL-2后,发现成纤维细胞可以产生内源性的IL-2,随肺纤维化的加重而增多[12]。此次实验,我们将IL-2与IL-6及TGF-β同时检测,研究其相关性。IL-2作为一个基础性炎性因子,其相关性有限。但IL-2与促肺纤维化相关的多种细胞因子能起协同作用。多种细胞具有分泌IL-2的功能,有研究发现,癌症细胞可以产生内源性IL-2,与肿瘤的发展具有正相关性[13]。已有研究发现,肺纤维化的病理进展也具有恶性肿瘤的某些特征[14],因而提示IL-2可能与成纤维细胞的表型改变及肺纤维化的不良预后有关,具体机制有待深入研究。
IL-6对肺纤维化患者的成纤维细胞与正常人的成纤维细胞具有不同的作用。IL-6 对肺纤维化患者的成纤维细胞具有抑制凋亡的作用,对正常人成纤维细胞则具有促凋亡作用[15]。IL-6还具有调节效应型Th17细胞和调节性T 细胞之间的平衡作用[16]。我们的研究发现肺纤维化大鼠存在IL-6的高表达,并与肺纤维化严重程度同步上升,说明IL-6具有促进肺纤维化的作用。IL-6对肺纤维化的作用是多方面的,通过促进肺纤维化病灶内的炎性反应来阻碍肺泡组织结构正常修复。也可通过对肺组织内成纤维细胞的抗凋亡作用促进肺纤维化的发展。同时还可能以促进IL-17的表达促进肺纤维化的发展。
通过对免疫组织化学的数据行相关分析发现,IL-6和IL-17 的表达具有正相关,并且TGF-β 与IL-17的表达也有正相关。文献报道IL-6和TGF-β协同作用,可以促使幼稚T 细胞向Th17 方向分化[17],产生高水平的IL-17,促进IL-6 的高表达。我们的结果与文献报道一致。推测在肺纤维化的炎症微环境中,成纤维细胞、TGF-β、IL-6和Th17细胞之间形成一个正反馈过程。正是这种正反馈机制,导致IL-17、IL-6 及TGF-β表达水平的同步上升,并与成纤维细胞的增殖和表型改变相关,导致肺纤维化的渐次加重。
3.2 调节性T细胞与IL-17等细胞因子之间的平衡关系极其对肺纤维化的影响
近期有研究报道,肺纤维化患者中存在调节性T 细胞数量不足,并且对效应性T 细胞的抑制功能减弱。动物实验发现,扩增大鼠调节性T 细胞,能够降低大鼠肺纤维化的程度[3,18]。同时文献报道在肺纤维化患者中,存在Th17细胞升高,IL-17表达水平增高,并同肺纤维化严重程度相关。抑制IL-17,则可以改善肺纤维化病情[19]。这些研究结果说明调节性T 细胞具有抑制肺纤维化的作用,Th17细胞具有促进纤维化的作用。
我们的研究结果发现博来霉素组大鼠发生明显肺纤维化,其调节性T 细胞所占比例较对照组却没有统计学差异。仅有CD8+Treg%较对照组高,提示CD8+Treg的诱导分化可能增多,但其总的数量与对照组一致,无显著性差异。表明在本组实验中,总体上调节性T 细胞没有显著变化;但是肺纤维化大鼠的IL-17表达水平却升高,与对照组比较差异具有统计学意义。这说明博来霉素引起的肺纤维化中Th17细胞数量和功能明显提升,同时调节性T细胞的数量却没有显著提升,其功能和数量相对于Th17细胞是相对不足的,这样Th17/调节性T 细胞的平衡就向促炎方向倾斜了。
导致Th17/调节性T 细胞比例失衡的具体机制尚不明确。文献报道,TGF-β和IL-6能够促使幼稚T 细胞向Th17 方向诱导分化;而IL-2 协同TGF-β可以促进幼稚T 细胞向调节性T 细胞诱导分化[17]。我们的研究结果显示IL-6、TGF-β、IL-2等几种与Th17细胞分化相关的因子的表达水平明显上升。根据文献报道和我们的结果,推测肺纤维化大鼠成纤维细胞在病灶大量聚集并分泌大量IL-6和TGF-β,促使幼稚T 细胞向Th17 细胞分化水平升高,向调节性T 细胞分化水平降低,并促使部分CD4+Treg向Th17细胞转化。并且分泌IL-17增多,从而导致病灶内IL-17表达水平升高,升高的IL-17又促进成纤维细胞发生表型改变,诱导产生IL-6。以上过程形成一个正反馈。在急性炎性刺激下调节性T 细胞数量虽有上升,但相对于Th17细胞的强势增殖,其抑制能力是相对下降的。最终这种不平衡导致肺纤维化病灶内慢性炎症的持续存在,导致肺纤维化病情进展。
[1] Shi Y H,Shi G C,Wan H Y,et al.Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with allergic asthma[J].Chin Med J(Engl),2011,124(13):1951-1956.
[2] Wang W,Shao S,Jiao Z,et al.The Th17/Treg imbalance and cytokine environment in peripheral blood of patients with rheumatoid arthritis[J].Rheumatol Int,2012,32(4):887-893.
[3] Kotsianidis I,Nakou E,Bouchliou I,et al.Global impairment of CD4+CD25+Foxp3+regulatory T cells in idiopathic pul-monary fibrosis[J].Am J Respir Crit Care Med,2009,179(12):1121-1130.
[4] Gao J,Huang Y,Li P,et al.Antifibrosis effects of total glucosides of Danggui-Buxue-Tang in a rat model of bleomycin-induced pulmonary fibrosis[J].J Ethnopharmacol,2011,136(1):21-26.
[5] Ashcroft T,Simpson J M,Timbrell V.Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J].J Clin Pathol,1988,41(4):467-470.
[6] Silverpil E,Lindén A.IL-17in human asthma[J].Expert Rev Respir Med,2012,6(2):173-186.
[7] Zhu S,Qian Y.IL-17/IL-17receptor system in autoimmune disease:mechanisms and therapeutic potential[J].Clin Sci(Lond),2012,122(11):487-511.
[8] Wilson M S,Madala S K,Ramalingam T R,et al.Bleomycin and IL-1beta-mediated pulmonary fibrosis is IL-17Adependent[J].J Exp Med,2010,207(3):535-552.
[9] 董昭兴,康庆鑫,雷雯,等.IL-17 对肺成纤维细胞的增殖、转化和胶原合成作用[J].南方医科大学学报,2012,32(1):75-79.
[10] Lepparanta O,Sens C,Salmenkivi K,et al.Regulation of TGF-β storage and activation in the human idiopathic pulmonary fibrosis lung[J].Cell Tissue Res,2012,348(3):491-503.
[11] Willis B C,Borok Z.TGF-beta-induced EMT:mechanisms and implications for fibrotic lung disease[J].Am J Physiol Lung Cell Mol Physiol,2007,293(3):525-534.
[12] 万勇,黄莺,孙洁明.成纤维细胞在博来霉素致肺纤维化中高表达IL-2、β-catenin、TGF-β1 和IL-10[J].华中科技大学学报:医学版,2010,39(6):766-770.
[13] Reichert T E,Watkins S,Stanson J,et al.Endogenous IL-2in cancer cells:a marker of cellular proliferation[J].J Histochem Cytochem,1998,46(5):603-611.
[14] Vancheri C,Failla M,Crimi N,et al.Idiopathic pulmonary fibrosis:a disease with similarities and links to cancer biology[J].Eur Respir J,2010,35(3):496-504.
[15] Moodley Y P,Misso N L,Scaffidi A K,et al.Inverse effects of interleukin-6on apoptosis of fibroblasts from pulmonary fibrosis and normal lungs[J].Am J Respir Cell Mol Biol,2003,29(4):490-498.
[16] Nishihara M,Ogura H,Ueda N,et al.IL-6-gp130-STAT3in T cells directs the development of IL-17+Th with a minimum effect on that of Treg in the steady state[J].Int Immunol,2007,19(6):695-702.
[17] Mangan P R,Harrington L E,Helms W S,et al.Transforming growth factor-beta induces development of the T(H)17 lineage[J].Nature,2006,441(7090):231-234.
[18] Trujillo G,Hartigan A J,Hogaboam C M.T regulatory cells and attenuated bleomycin-induced fibrosis in lungs of CCR7-/-mice[J].Fibrogenesis Tissue Repair,2010,3:18.
[19] Mi S,Li Z,Yang H Z,et al.Blocking IL-17Apromotes the resolution of pulmonary inflammation and fibrosis via TGFbeta1-dependent and-independent mechanisms[J].J Immunol,2011,187(6):3003-3014.

