Nrf2活化剂SFP对MPP+所致PC12细胞氧化应激损伤的保护作用*
曹 旭, 肖海兵, 杨 燕, 常 飞, 张临洪△
1暨南大学附属深圳市人民医院神经内科,深圳 518020
2武汉市中心医院神经内科,武汉 430014
3香港大学深圳医院神经内科,深圳 518053
帕金森病(Parkinson’s disease,PD)是以黑质多巴胺能神经元变性死亡为主要病理改变的运动障碍性疾病,其主要的临床特征为静止性震颤、肌强直、运动迟缓及姿势步态异常。多巴胺能神经元选择性死亡的机制目前尚不明确,但研究者们普遍认为氧化应激在帕金森病的发病过程中扮演着重要的角色[1-2],因此减轻氧化应激所致的多巴胺能神经元变性损伤是治疗帕金森病的重要策略。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)能够导致各种哺乳动物产生类似帕金森病的症状。它在体内代谢为1-甲基-4-苯基吡啶离子(MPP+),后者进入线粒体抑制氧化呼吸链复合体I(complex I)酶的活性,造成多巴胺能神经元氧化应激损伤。因此以MPP+或其它毒素处理该细胞构建PD 的细胞模型,是一种已经获得公认的实验方法[3-4]。
核因子红系2 相关因子2(nuclear factor erythroid-derived 2-related factor 2,Nrf2)是细胞调节抗氧化应激反应的重要转录因子[5]。近年来多项证据表明Nrf2活化后可以对多种疾病状态的神经元起到保护作用[6]。但Nrf2对帕金森病中多巴胺能神经元损伤的保护作用及其机制仍不清楚,本研究拟观察Nrf2 激动剂莱菔硫烷(sulforaphane,SFP)对MPP+所致PC12细胞损伤的保护作用,并探讨其相关机制。
1 材料和方法
1.1 细胞培养及处理
PC12细胞购自武汉大学典型培养物保藏中心。PC12细胞置于含5%胎牛血清、10%马血清的高糖DMEM 培养液中,在5%CO2、37℃的培养箱培养,隔天换液,当单层培养细胞汇合后,传代培养。
1.2 实验分组
空白对照组:正常培养,不给予任何处理试剂;MPP+组:500μmol/L 的MPP+单独处理PC12细胞24h;SFP+MPP+组:根据SFP 不同浓度[7](0.1、0.5、1.0、5.0、10.0μmol/L)该组细胞再分为5个小组,各浓度SFP 与500μmol/L 的MPP+共同处理24h。SFP+MPP++LY 294002组:以25 mmol/L LY294002 处理细胞1 h 之后加入500 μmol/L的MPP+和5.0μmol/L 的SFP共处理24 h。每组各设定5个标本(n=5)。
1.3 四甲基偶氮唑盐(MTT)比色法检测细胞存活率
用F12培养液调节PC12细胞密度约4×104/孔(100μL/孔)接种于96孔板,置37℃、5%CO2细胞培养箱24h,各组给予相应的药物处理;每孔加5 mg/mL 的MTT 液20 μL(AMRESCO,USA),37℃孵育3h,终止培养并吸去培养液后每孔加150 μL DMSO(AMRESCO,USA),低速振荡10min溶解结晶物;以酶标仪(BioTek synergy2,USA)在测定波长570nm、参考波长540nm 下检测各孔的吸光度(A)值。细胞存活率的计算公式为:细胞存活率(%)=(实验组A 均值/对照组A 均值)×100%。
1.4 流式细胞术检测细胞凋亡
各组细胞用4℃PBS清洗2 次,制成单细胞悬液。调整细胞密度为1×106/mL,取100μL细胞悬液加入5μL Annexin Ⅴ/FITC 和10μL PI溶液(20μL/mL)混匀,室温避光孵育15 min,加入400 μL PBS,流式细胞仪进行检测。
1.5 细胞内活性氧簇(ROS)含量的检测
将各组细胞培养于96孔板,完成造模后吸净细胞培养液,加入适当体积10μmol/L DCFH-DA 液,37℃孵育20 min 后用无血清DMEM/F12 培养液洗涤细胞3次,将96孔板置入全自动酶标仪内,激发波长设定为488nm,发射波长设定为525nm,自动读取各孔内细胞ROS 水平,结果以与对照组ROS含量的百分比表示。
1.6 线粒体膜电位(ΔΨm)的检测
各组细胞用4℃PBS清洗2次,用1mL PBS重悬。加入罗丹明123(碧云天公司,上海)使终浓度为10μg/mL,37℃孵育30 min,600r/min 离心5 min,去除上清,PBS清洗3次后在激发波长为488 nm 下以流式细胞仪检测。每个样本检测10 000个细胞,记录各组荧光强度值。
1.7 pAkt、Akt蛋白表达检测
用含苯甲基磺酰氟(PMSF)的蛋白裂解液分别提取各组细胞总蛋白,蛋白样本用BCA 法定量。取待测蛋白50μg加上样缓冲液(125 mmol/L Tris-HCl pH 6.8,10%甘油,2%SDS,2%β-巯基乙醇,0.1%溴酚蓝和0.1%二甲苯氰)煮沸5 min 变性,于10%SDS 凝胶电泳2h。NC 膜转膜2.5h,用10%牛奶封闭1h,分别加入pAkt抗体(1∶500)或总Akt抗体(1∶500),4℃过夜,常规TBST 洗膜,加羊抗小鼠二抗(1∶5 000)37℃孵育60min,洗涤,用ECL显影。实验重复5次,用凝胶图像处理系统分析pAkt与Akt条带的吸光度比值。
1.8 统计学处理
全部实验数据由SPSS 13.0软件包进行统计学分析。检测结果以均数±标准差(±s)表示,组间均数比较采用单因素方差分析,结果的相关性用各时间点测定指标的均数行相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SFP预处理减轻MPP+导致的PC12细胞死亡
以MTT 法检测细胞活力的结果显示,经500 μmol/L MPP+单独处理24h后PC12细胞存活率下降至(48.32±5.27)%。与MPP+单独处理组相比,不同浓度的SFP(0.1、0.5、1.0、5.0、10.0μmol/L)预处理使各组细胞活力分别上升到了(51.69±4.98)%,(55.64 ±6.01)%,(64.21±4.39)%,(72.18±5.93)%和(66.65±6.08)%,均明显高于MPP+组(P<0.05或P<0.01),见图1。提示应用5.0μmol/L 的SFP 预处理时,MPP+处理的PC12细胞存活率达到最大。
2.2 SFP预处理减少MPP+导致的PC12细胞凋亡
对照组细胞凋亡率为(2.72±1.09)%。500 μmol/L MPP+单独处理组PC12 细胞凋亡率为(42.82±7.66)%,明显高于对照组(P<0.01);应用0.1、0.5、1.0、5.0、10.0μmol/L 的SFP预处理24h后,MPP+诱导的PC12细胞的凋亡率下降,其凋亡率分别为(33.64±5.03)%、(29.77±5.84)%、(21.33±4.65)%、(14.61±5.98)%和(17.26±6.82)%,均明显低于MPP+组(P<0.05或P<0.01),见图2。
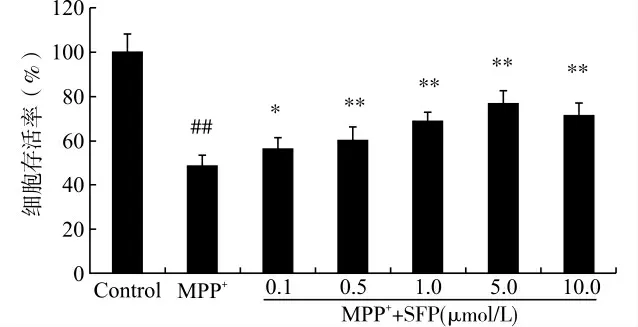
图1 Nrf2激动剂SFP对PC12细胞存活率的影响Fig.1 Effect of SFP on the cell viability of PC12
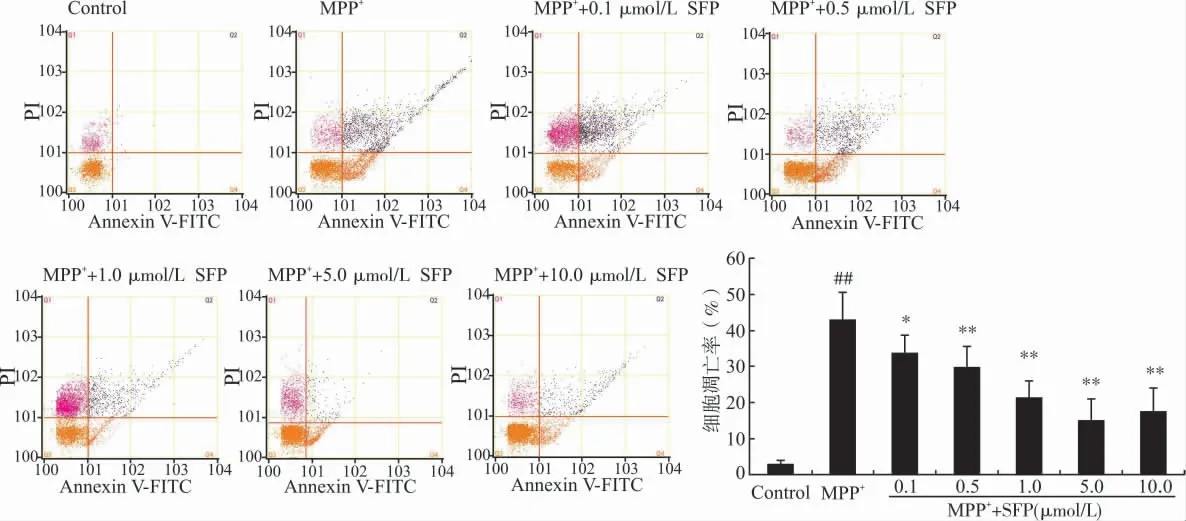
图2 Nrf2激动剂SFP对PC12凋亡的影响Fig.2 Effect of SFP on the apoptosis of PC12cells
2.3 SFP预处理改善MPP+所致PC12细胞氧化应激损伤
我们分别检测ROS生成量及线粒体膜电位以评估细胞的氧化应激水平。500μmol/L MPP+处理24 h,可使PC12 细胞产生大量的活性氧。给予0.1、0.5、1.0、5.0、10.0μmol/L的SFP处理24h可拮抗ROS的形成,酶标仪所读取的荧光强度值明显降低,其中5.0μmol/L的SFP抑制作用最强,见图3。
与对照组的PC12细胞线粒体膜电位相比,500 μmol/L MPP+单独处理组PC12细胞ΔΨm 显著下降,提示线粒体能量耗竭。而应用0.1、0.5、1.0、5.0、10.0μmol/L 的SFP 处理后荧光强度值均升高,显著高于MPP+组(均P<0.05)。与ROS检测结果一致,5.0μmol/L的SFP改善作用最强,见表1。
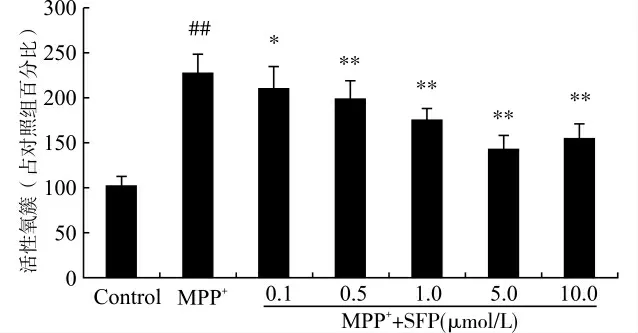
图3 Nrf2激动剂SFP对PC12ROS生成量的影响Fig.3 Effect of SFP on the ROS levels of PC12cells
表1 SFP共处理对MPP+所致线粒体膜电位的影响(±s,n=5)Table 1 Effect of SFP on the mitochondrial transmembrane potential of PC12cells(±s,n=5)
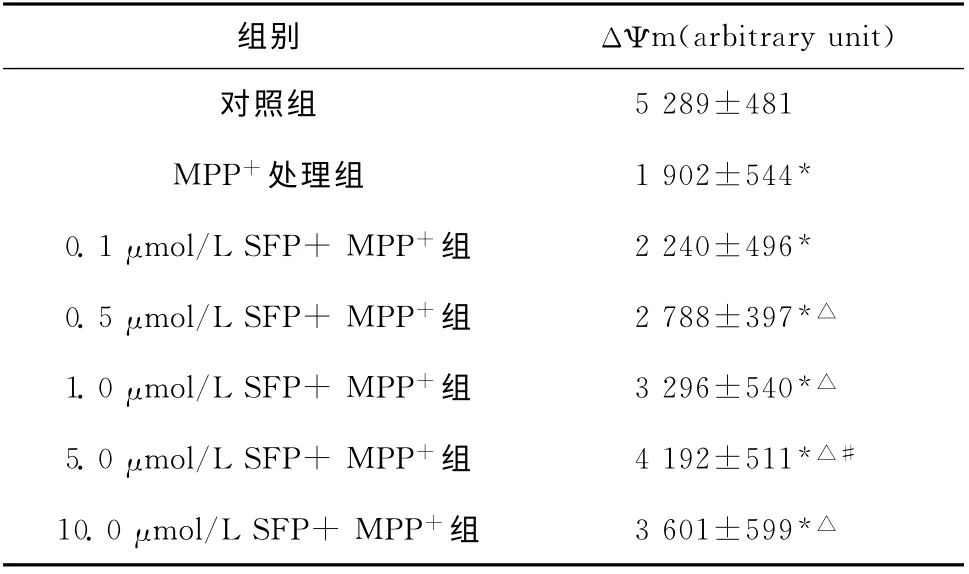
表1 SFP共处理对MPP+所致线粒体膜电位的影响(±s,n=5)Table 1 Effect of SFP on the mitochondrial transmembrane potential of PC12cells(±s,n=5)
与对照组比较,*P<0.05;与MPP+处理组比较,△P<0.05;与10.0μmol/L SFP+MPP+组比较,#P<0.05
组别ΔΨm(arbitrary unit)5 289±481 MPP+处理组1 902±544*0.1μmol/L SFP+MPP+组2 240±496*0.5μmol/L SFP+MPP+组2 788±397*△1.0μmol/L SFP+MPP+组3 296±540*△5.0μmol/L SFP+MPP+组4 192±511*△#10.0μmol/L SFP+MPP+组3 601±599对照组*△
2.4 PI3K/Akt通路参与介导SFP的神经保护作用
免疫印迹法显示,正常对照组PC12 细胞的pAkt表达水平较低;MPP+处理后pAkt有所增高(P<0.05);而MPP+和5.0μmol/L的SFP共同处理组pAkt 表达明显增高,高于MPP+组(P <0.01)。加用10.0μmol/L 的LY294002 后pAkt降低,明显低于MPP+和SFP 共处理组(P<0.05)(图4A)。
与MPP+和5.0μmol/L的SFP共同处理组相比,10.0μmol/L 的LY294002明显削弱了SFP 对于PC12 细胞的保护作用,其存活率为(54.12±9.42)%,明显低于MPP+和SFP 共处理组(P<0.05)(图4B)。
应用10.0μmol/L 的LY294002 与MPP+及SFP共处理后,PC12 细胞的ROS 含量明显高于MPP+和SFP共处理组(P<0.05)(图4C),提示抑制PI3K/Akt通路降低了SFP的抗氧化应激作用。
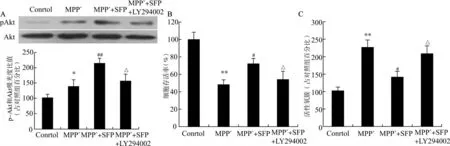
图4 PI3K/Akt通路参与介导SFP的神经保护作用Fig.4 PI3K/Akt pathway involved in the neuroprotective effect of SFP
3 讨论
多巴胺能神经元损伤的保护是帕金森病早期治疗的重要策略之一,而氧化应激损伤可能是多巴胺能神经元变性的最后共同途径。针对氧化应激这一重要损伤环节,研究者们试图使用一些外源性抗氧化剂治疗帕金森病,如特丁基对苯二酚、N-乙酰半胱氨酸、维生素E、辅酶Q10 等。但由于其生物半衰期短,血脑屏障通透性受限等原因,疗效不理想[8]。另一方面,通过激活细胞的内源性抗氧化系统来改善氧化损伤,越来越受到学者们的广泛关注[9]。其中,Nrf2通过调节ARE 驱动多种Ⅱ相解毒抗氧化酶表达[10],目前被认为是调控多种抗氧化酶转录表达的关键内源性通路[11]。SFP 是从花椰菜、卷心菜等植物的硫代葡萄糖酸盐中提炼的一种化学诱导剂,它能通过激活Nrf2发挥去ROS基因诱导作用。其神经保护作用在多种神经系统疾病模型中得到证实,包括:脑缺血/缺氧、脑外伤、肌萎缩侧索硬化等[7,12]。
本研究观察了Nrf2诱导剂SFP对于MPP+所致PC12 细胞损伤的保护作用,当加入0.1、0.5、1.0、5.0、10.0μmol/L 的SFP 后可以部分逆转MPP+所致PC12 细胞存活率下降,并减少细胞凋亡。有趣的是,随着SFP 浓度的增加,细胞存活率并非持续上升,而是呈“钟型曲线”,SFP 的保护作用在5.0μmol/L时达到最高。这与其在脑缺血方面研究结果相似[7],其机制尚不明确,但是这提示在临床应用SFP时剂量并非越大越好。因此,我们选用5.0μmol/L的SFP进行后续研究。
SFP可明显降低MPP+所致PC12细胞氧化应激损伤,表现在抑制ROS 生成和维持ΔΨm 稳定上。线粒体内膜分布着大量质子泵,其功能是将基质内质子H+泵入外室,从而形成横跨内膜的ΔΨm,一定水平的ΔΨm 可以调控线粒体内膜对各种物质的选择性和通透性,维持线粒体的正常功能[13]。细胞内大部分ROS都是在线粒体内代谢产生,并通过线粒体呼吸链复合物进行调节,大量ROS生成和聚集,使得线粒体膜通透性增加,进而影响到细胞的正常结构与功能以及细胞凋亡的发生。ROS的增加可直接或间接损伤线粒体膜而使ΔΨm 降低[14]。我们认为SFP 对氧化应激损伤神经元的保护作用可能是通过激活Nrf2/ARE 通路,促进抗氧化酶表达,清除ROS、稳定ΔΨm 而实现的。
磷酸肌醇3激酶(PI3K)/Akt信号转导通路是近年来发现的一条参与细胞增殖调控的重要信号通路,PI3K 和Akt是其中心环节,研究提示该蛋白激酶途径可能与Nrf2的活性调节有关[15-18]。然而,上述关联尚未在不同的疾病模型中得到广泛验证。
为明确SFP激活Nrf2所带来的抗氧化效应是否有该蛋白激酶途径的参与,我们使用Western blot检测Akt的磷酸化水平,发现MPP+处理使pAkt表达轻度增加,而MPP+和SFP 共处理组pAkt显著增加。进而,我们使用PI3K 抑制剂LY294002,发现应用LY294002 后,SFP 的保护作用被拮抗,表现在pAkt的水平显著降低、细胞ROS含量增加、细胞存活率下降等多个方面。
综上所述,我们的研究提示,Nrf2激活剂SFP可改善MPP+神经毒性作用,它能通过促进Akt磷酸化,减少ROS生成,稳定线粒体膜电位达到减少细胞死亡的目的。本研究为应用激活内源性抗氧化系统以预防MPP+对PC12细胞的神经毒性作用提供了体外实验依据,为进行帕金森病动物实验研究提供了药理学靶位。
[1] Onyango I G.Mitochondrial dysfunction and oxidative stress in Parkinson’s disease[J].Neurochem Res,2008,33(3):589-597.
[2] Miller R L,James-Kracke M,Sun G Y,et al.Oxidative and inflammatory pathways in Parkinson’s disease[J].Neurochem Res,2009,34(1):55-65.
[3] Langston J W,Ballard P,Tetrud J W,et al.Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis[J].Science,1983,219(4587):979-980.
[4] Nicotra A,Parvez S H.Cell death induced by MPTP,a substrate for monoamine oxidase B[J].Toxicology,2000,153(1-3):157-166.
[5] Corbett M,Bogers W M,Heeney J L,et al.Aerosol immunization with NYVAC and MVA vectored vaccines is safe,simple,and immunogenic[J].Proc Natl Acad Sci USA,2008,105(6):2046-2051.
[6] Lin M T,Beal M F.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature,2006,443(7113):787-795.
[7] Danilov C A,Chandrasekaran K,Racz J,et al.Sulforaphane protects astrocytes against oxidative stress and delayed death caused by oxygen and glucose deprivation[J].Glia,2009,57(6):645-656.
[8] Surendran S,Rajasankar S.Parkinson’s disease:oxidative stress and therapeutic approaches[J].Neurol Sci,2010,31(5):531-540.
[9] Satoh T,Lipton S A.Redox regulation of neuronal survival mediated by electrophilic compounds[J].Trends Neurosci,2007,30(1):37-45.
[10] Moi P,Chan K,Asunis I,et al.Isolation of NF-E2-related factor 2(Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1repeat of the beta-globin locus control region[J].Proc Natl Acad Sci USA,1994,91(21):9926-9930.
[11] Copple I M,Goldring C E,Kitteringham N R,et al.The Nrf2-Keap1defence pathway:role in protection against drug-induced toxicity[J].Toxicology,2008,246(1):24-33.
[12] Ferraiuolo L,Heath P R,Holden H,et al.Microarray analysis of the cellular pathways involved in the adaptation to and progression of motor neuron injury in the SOD1 G93A mouse model of familial ALS[J].J Neurosci,2007,27(34):9201-9219.
[13] Zamzami N,Marchetti P,Castedo M,et al.Reduction in mitochondrial potential constitutes an early irreversible step of programmed lymphocyte death in vivo[J].J Exp Med,1995,181(5):1661-1672.
[14] Marcinek D J,Schenkman K A,Ciesielski W A,et al.Reduced mitochondrial coupling in vivo alters cellular energetics in aged mouse skeletal muscle[J].J Physiol,2005,569(Pt 2):467-473.
[15] Nakaso K,Yano H,Fukuhara Y,et al.PI3Kis a key molecule in the Nrf2-mediated regulation of antioxidative proteins by hemin in human neuroblastoma cells[J].FEBS Lett,2003,546(2/3):181-184.
[16] Umemura K,Itoh T,Hamada N,et al.Preconditioning by sesquiterpene lactone enhances H2O2-induced Nrf2/ARE activation[J].Biochem Biophys Res Commun,2008,368(4):948-954.
[17] Nguyen T,Yang C S,Pickett C B.The pathways and molecular mechanisms regulating Nrf2 activation in response to chemical stress[J].Free Radic Biol Med,2004,37(4):433-441.
[18] 张慧,姜咏梅,尹琳.PI3K/AKT/GSK-3β信号在脑缺血预处理中的作用及对海马细胞凋亡的影响[J].华中科技大学学报:医学版,2011,40(4):408-412,428.

