乳果糖预处理减轻大鼠肠缺血再灌注损伤的机制研究*
叶志强, 戴海涛, 刘旭辉, 曾 花, 邢帮荣, 陈锐涵, 卫洪波
(中山大学附属第三医院1急诊科,2胃肠外科,广东 广州510630)
各种原因导致组织器官缺血时,会引起细胞代谢障碍和组织结构出现破坏,而当血供恢复时,组织及细胞损伤反而出现加重的现象称为缺血再灌注损伤(ischemia-reperfusion injury,IRI)。微血管通透性增加、组织间质水肿、血管调节机制受损及炎症细胞浸润与缺血再灌注所引发的器官功能障碍相关。小肠是对缺氧缺血最敏感的器官之一。肠缺血再灌注损伤是一个临床很常见问题,常继发于肠扭转、肠系膜静脉血栓形成以及严重的烧伤、创伤、感染、休克等病理状态。缺血再灌注损伤引起小肠局部微血管通透性增加、肠黏膜屏障功能受损,从而导致肠道细菌和毒素的移位,进而引起大量氧自由基产生和炎症介质的释放,严重时可引发系统性炎症反应综合征[1]。因此,防治肠缺血再灌注损伤是危重病研究领域的重点之一。氧化应激是肠缺血再灌注导致组织损伤的关键过程,因此抗氧化是防治肠缺血再灌注损伤的重要方法。氢气作为一种抗氧化气体,已被证实能减轻多种组织的缺血再灌注损伤,而乳果糖(lactulose)能被定植在胃肠道的菌群分解,氢气是该过程的主要副产物[2]。作为体内氢气的重要来源,乳果糖是否能减轻肠缺血再灌注损伤?因此本研究在构建大鼠肠缺血再灌注损伤模型基础上,观察了乳果糖预处理对肠缺血再灌注损伤的影响及作用机制。
材 料 和 方 法
1 材料
Lactulose 购自Sigma,cleaved caspase-3 抗体(CST9664)和GAPDH 抗体(CST2118)均购自Cell Signaling Technology,Bradford 蛋白定量试剂盒、ECL化学发光试剂盒和HE 染色试剂盒均购自广州永诺生物科技有限公司,TUNEL 试剂盒购自Roche,Hoechst 33258 购自Invitrogen,白细胞介素6(interleukin 6,IL-6)ELISA、IL-1β ELISA 和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA 试剂盒均购自R&D,丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自碧云天生物技术研究所。
2 方法
2.1 实验设计及肠缺血再灌注模型 将30 只SD大鼠(购自中山大学实验动物中心)随机分为3 组,每组10 只,分为假手术组、缺血再灌注组和乳果糖灌胃预处理组。乳果糖组手术前7 d 每天进行乳果糖灌胃(浓度0.1 kg/L,10 mL/kg),假手术组及缺血再灌注组给予等体积的生理盐水灌胃。手术前晚禁食,10%水合氯醛4 mL/kg 腹腔注射麻醉SD 大鼠(7~8 周,250 ~300 g)后,经腹部正中切口,分离肠系膜上动脉(superior mesenteric artery,SMA),sham 组只分离肠系膜上动脉,然后缝合腹部切口;IR 组及lactulose 组分离肠系膜上动脉后,用微动脉夹夹闭,缝合切口,30 min 后经原切口进腹,取出动脉夹,恢复血供,持续再灌注60 min。肠系膜上动脉夹闭成功的标志为微动脉夹夹闭后肠管立即收缩、肠壁变苍白、肠系膜上动脉搏动消失,开放血管后搏动恢复,肠壁出现充血。
2.2 样本采集 再灌注模型完成立即经原切口开腹,sham 组、IR 组及lactulose + IR 组取股静脉血1 mL,室温静置30 min 使血液凝固,4 ℃、1 000 ×g 离心10 min 分离血清,-80 ℃保存备用。取距盲肠约10 cm 小肠组织4 cm,分成3 份,1 份组织用4%PFA固定,石蜡包埋切片,HE 染色观察小肠组织形态的改变,TUNEL 荧光染色评估细胞凋亡情况;其余2 份置液氮中冻存,采用Western blotting 检测cleaved caspase-3 表达水平,并检测小肠组织中MDA 及SOD水平。
2.3 肠黏膜形态学观察 HE 染色后,光镜下观察肠黏膜组织形态学改变,采用Chiu's 评分法评价肠黏膜损伤程度,评分高,表明损伤严重。
2.4 免疫印迹( Western blotting) 100 mg 小肠组织用500 μL RIPA 裂解液裂解后,匀浆,4 ℃、16 000 ×g 离心取上清,采用Bradford 方法进行蛋白定量,煮沸样本5 min,冰上冷却后10 000 ×g 离心30 s,取上清进行SDS-PAGE,然后100 V 转膜1 h,0. 5%(W/V)脱脂牛奶室温封闭PVDF 膜1 h,4 ℃Ⅰ抗孵育过夜,0.1%(V/V)TBST 洗膜2 次后,室温孵育Ⅱ抗1 h ,洗膜3 次后即用ECL 显色曝光。
2.5 原位凋亡检测 采用原位末端标记技术(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling,TUNEL),石蜡切片脱蜡水化后用20 mg/L 蛋白酶K 室温处理30 min,PBS 清洗后在样品上加50 μL 标记液,37 ℃避光孵育60 min,清洗后用Hoechst 33258 染核,封片后用荧光显微镜观察。计数阳性细胞数(绿色)和总细胞数(蓝色),计算凋亡指数(阳性细胞数/总细胞数)。
2.6 其它生化指标检测 血清中IL-6、IL-1β 和TNF-α 水平采用ELISA 检测,小肠组织中MDA 和SOD 水平检测严格按照说明书执行。
3 统计学处理
数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,应用SPSS 软件包进行统计处理,以P <0.05 为差异有统计学意义。
结 果
1 乳果糖预处理对缺血再灌注肠组织的保护作用
假手术组肠绒毛结构完整;缺血再灌注组可见显著的组织损伤,肠绒毛剥脱,间质出血,大量炎症细胞浸润;乳果糖预处理组病变较缺血再灌注组显著减轻,见图1。与假手术组比较,缺血再灌注组Chiu's 评分显著升高(P <0.05),乳果糖预处理组与缺血再灌注组比较,Chiu's 评分显著降低(P <0.05),见表1。
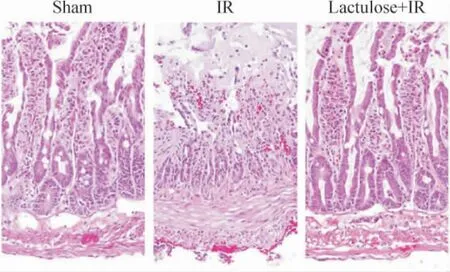
Figure 1. Effect of lactulose preconditioning on the histopathological changes of the intestine in rats with intestinal ischemia-reperfusion injury (HE staining,×200).图1 乳果糖预处理对缺血再灌注损伤诱导小肠组织病理改变的影响
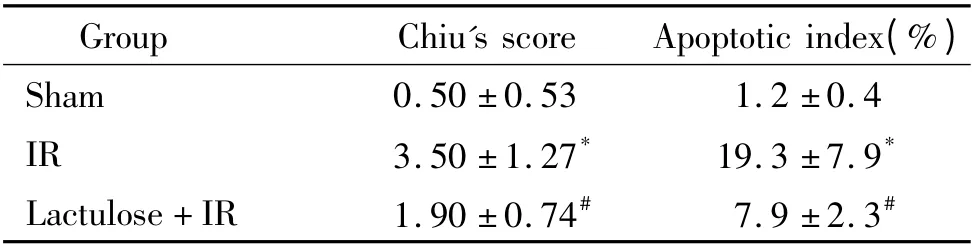
表1 各组大鼠肠黏膜组织Chiu's 评分及凋亡指数的比较Table 1. Changes of Chiu's score and enterocyte apoptotic index(mean±SD.n=10)
2 乳果糖预处理抑制缺血再灌注诱导的肠上皮细胞凋亡。
假手术组未见明显凋亡,缺血再灌注组TUNEL阳性细胞数显著增加,而乳果糖预处理组凋亡细胞数显著低于缺血再灌注组,见图2。与假手术组比较,缺血再灌注组凋亡指数显著升高(P <0.05),乳果糖预处理组与缺血再灌注组比较,凋亡指数显著降低(P <0.05),见表1。
与假手术组比,缺血再灌注损伤诱导激活型caspase-3 上调,而乳果糖预处理对激活型caspase-3上调有抑制作用,见图3。以上两个方面的结果表明乳果糖预处理对缺血再灌注诱导的细胞凋亡有保护作用。
3 乳果糖预处理能抑制缺血再灌注诱导的血清炎症因子水平上升
假手术组、缺血再灌注组及乳果糖预处理组IL-6、TNF-α 和IL-1β 水平有明显改变,见图4。缺血再灌注诱导血清中炎症因子显著上升,而乳果糖预处理对肠缺血再灌注大鼠血清中炎症因子有部分抑制作用。
4 乳果糖预处理抑制缺血再灌注损伤诱导的氧化应激
假手术组、缺血再灌注组及乳果糖预处理组MDA 和SOD 水平有明显改变,见图5。

Figure 2. Effect of lactulose preconditioning on the apoptosis of small intestine in rats with intestinal ischemia-reperfusion injury (TUNEL,×200).图2 乳果糖预处理对缺血再灌注损伤诱导小肠上皮细胞凋亡的影响
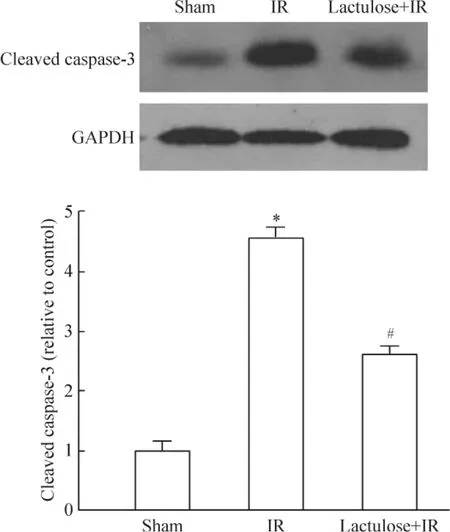
Figure 3. Inhibition of cleaved caspase-3 expression by lactulose preconditioning in the intestine of rats with intesinal ischemia-reperfusion (IR)injury. Mean ± SD. n =10.* P <0.05 vs sham group;#P <0.05 vs IR group.图3 乳果糖预处理抑制激活型caspase-3 上调
讨 论
缺血再灌注损伤是创伤、严重感染及休克等疾病共同存在的病理生理过程,可导致许多严重并发症[2]。小肠是对缺血再灌注损伤最敏感的器官之一,在肠绞窄、小肠移植和肠系膜血管缺血性疾病等情况下,均会造成小肠的缺血性损伤,在组织恢复血供时,再灌注损伤会加重对小肠的损伤。许多研究报道,小肠是机体最大的细菌库,缺血再灌注损伤消化道,削弱小肠的生理屏障功能,可以导致肠内细菌移位,激活网状内皮系统,引起大量炎症因子的释放,诱导全身炎症反应综合症和多器官功能不全综合症的发生。
随着研究的不断进步,人们对肠缺血再灌注损伤的发生机制有了更深入的认识。活性氧簇(ROS)是由氧化还原反应产生的、在分子组成上含有氧、化学性质非常活泼的一类物质的总称。活性氧簇的过量生成是导致小肠缺血再灌注损伤的一个重要机制[3]。小肠组织对缺血再灌注损伤敏感,是由于小肠绒毛富含活性氧簇相关的酶,缺血再灌注激活了腺嘌呤-次黄嘌呤代谢途径,使氧自由基的产生异常增加,消耗内源性抗氧化系统如SOD,并攻击富含不饱和脂肪酸的细胞膜、线粒体膜等膜性结构,导致脂质过氧化,损伤生物膜,此外,蛋白质、核酸等生物大分子也会受到氧自由基攻击。MDA 是反映脂质过氧化水平的一个良好标记物。大量文献报导,缺血再灌注时SOD 活性下降,MDA 显著增高,本研究在诱导小肠缺血再灌注发生后,同样在小肠组织中检测到SOD 活性下降和MDA 水平的异常升高,表明模型诱导成功。
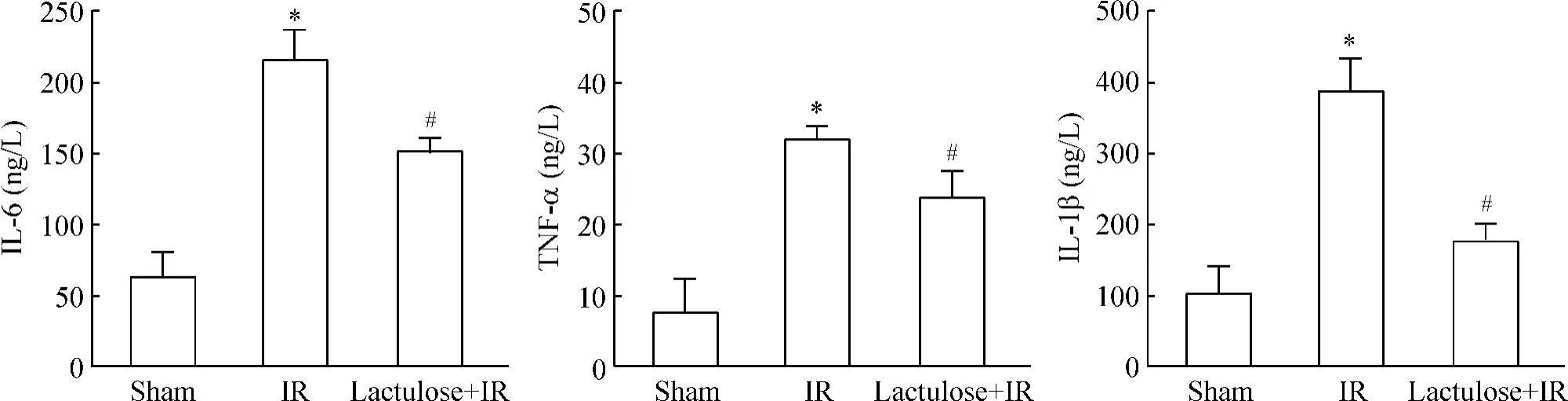
Figure 4. Effects of lactulose preconditioning on the serum levels of IL-6,TNF-α and IL-1β in rats with intestinal ischemia-reperfusion injury.Mean±SD. n=10. * P <0.05 vs sham group;#P <0.05 vs IR group.图4 乳果糖预处理对肠缺血再灌注损伤大鼠血清IL-6、TNF-α 和IL-1β 水平的影响
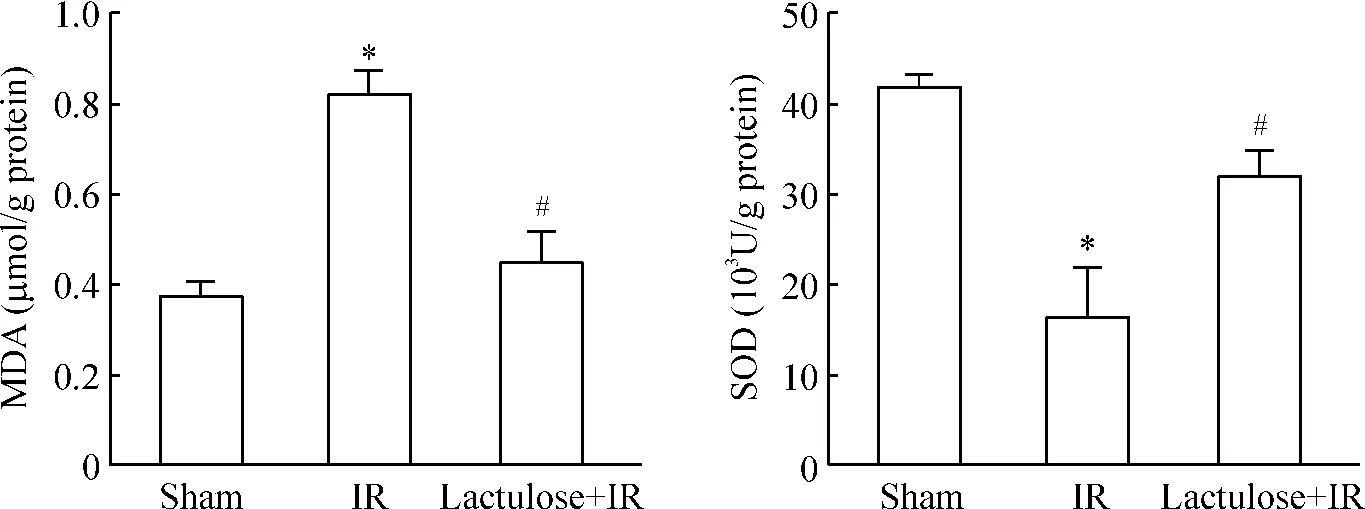
Figure 5. Effects of lactulose preconditioning on the levels of MDA and SOD in the intestine of rats with intestinal ischemia-reperfusion injury.Mean±SD. n=10. * P <0.05 vs sham group;#P <0.05 vs IR group.图5 乳果糖预处理对肠缺血再灌注损伤大鼠肠组织MDA 和SOD 水平的影响
生理情况下,细胞凋亡是一种基本生物学现象,是机体为维持内环境稳定,由基因控制的细胞自主有序的死亡过程。但在病理情况下,细胞发生过度凋亡则会造成组织结构及功能的破坏[4]。多个研究报道,缺血再灌注损伤能造成多种组织器官细胞过度凋亡,从而造成组织损伤[5-8]。Ikeda 等[9]研究表明细胞凋亡是缺血再灌注损伤引起小肠绒毛上皮细胞死亡的主要形式,凋亡细胞数约占细胞死亡总数的80%。过度的氧化应激、炎症反应及菌群移位可能与细胞凋亡相关。本研究结果显示,与假手术组对比,缺血再灌注导致小肠上皮细胞TUNEL 阳性细胞数显著升高,而且主要发生在小肠绒毛的顶部。
基于以上研究,通过抑制氧化应激保护缺血再灌注损伤诱导的细胞凋亡,是治疗肠缺血再灌注损伤的一种策略。乳果糖是人工合成的一种糖类,是由一分子果糖和一分子乳糖形成的双糖,常用于治疗便秘和肝性脑病。乳果糖不能由人体吸收,但可以由定植在结肠的细菌分解,主要副产物之一是氢气,口服乳果糖能显著提高氢气的产率[10]。研究报道乳果糖对DSS 诱导的结肠炎有一定的保护作用,氢气在这个过程中可能起到关键作用,乳果糖能剂量依赖性保护DSS 诱导的小肠组织损伤,MPO 活性、脂质过氧化及组织炎症也同时受到抑制[11-12]。在本研究中,我们观察到预先给予大鼠乳果糖灌胃处理后,能保护缺血再灌注诱导的小肠上皮细胞损伤,抑制小肠上皮细胞凋亡,对炎症因子IL-6、TNF-α和IL-1β 的水平有抑制作用,降低MDA 生成的同时提高小肠组织SOD 水平。氢气的产生在乳果糖对缺血再灌注的保护过程中可能发挥关键作用,这方面的研究需要进一步证实。
[1] Guan Y,Worrell RT,Pritts TA,et al. Intestinal ischemiareperfusion injury:reversible and irreversible damage imaged in vivo[J]. Am J Physiol Gastrointest Liver Physiol,2009,297(1):G187-G196.
[2] Vollmar B,Menger MD. Intestinal ischemia/reperfusion:microcirculatory pathology and functional consequences[J]. Langenbecks Arch Surg,2011,396(1):13-29.
[3] Vandervliet A ,Bast A. Role of reactive oxygen species in intestinal diseases[J]. Free Radic Biol Med,1992,12(6):499-513.
[4] Elmore S. Apoptosis:a review of programmed cell death[J]. Toxicol Pathol,2007,35(4):495-516.
[5] Rudiger HA,Graf R,Clavien PA. Liver ischemia:apoptosis as a central mechanism of injury[J]. J Invest Surg,2003,16(3):149-159.
[6] Maulik N,Yoshida T,Das DK. Oxidative stress developed during the reperfusion of ischemic myocardium induces apoptosis[J]. Free Radic Biol Med,1998,24(5):869-875.
[7] 马 毅,何晓顺,陈规划. 肝脏缺血再灌注损伤与细胞凋亡[J]. 中国病理生理杂志,2003,19(7):1005-1008.
[8] 李 毅,李坤河,温仕宏,等. JAK/STAT 通路在大鼠肠缺血再灌注所致肠损伤中的作用[J]. 中国病理生理杂志,2011,27(12):2338-2344.
[9] Ikeda H,Suzuki Y,Suzuki M,et al. Apoptosis is a major mode of cell death caused by ischaemia and ischaemia/reperfusion injury to the rat intestinal epithelium[J]. Gut,1998,42(4):530-537.
[10]Florent C,Flourie B,Leblond A,et al. Influence of chronic lactulose ingestion on the colonic metabolism of lactulose in man (an in vivo study)[J]. J Clin Invest,1985,75(2):608-613.
[11]Rumi G,Tsubouchi R,Okayama M,et al. Protective effect of lactulose on dextran sulfate sodium-induced colonic inflammation in rats[J]. Dig Dis Sci,2004,49(9):1466-1472.
[12]Chen X,Zuo Q,Hai Y,et al. Lactulose:an indirect antioxidant ameliorating inflammatory bowel disease by increasing hydrogen production[J]. Med Hypotheses,2011,76(3):325-327.

