急、慢性高原缺氧对成年大鼠空间学习和记忆功能的影响*
高伊星, 唐中伟, 袁志兵, 刘 春, 徐 刚, 陈德伟, 高钰琪, 阮怀珍△
(第三军医大学1基础部神经生物学教研室,2高原军事医学系病理生理学与高原生理学教研室,3高原医学教育部重点实验室,重庆400038)
低氧环境可引起人体一定程度的生理功能障碍和病理生理变化。机体约20%的氧是由脑消耗的,因此中枢神经系统对缺氧反应尤为敏感。研究表明,低氧环境下,中枢神经系统的谷氨酸等神经递质代谢紊乱,严重时甚至可造成神经元功能的丢失[1]和胚胎大鼠神经干细胞凋亡[2]。有关高原缺氧对学习记忆功能的影响的研究结果不尽一致。我们以往研究发现,大鼠在胚胎期及新生期处于高原低氧的环境中其学习记忆能力受到抑制,可能与低氧环境下海马区域NMDA 受体的数量和功能相关[3],但也有研究报道,间断性缺氧对新生大鼠的学习记忆功能没有影响[4],甚至有促进作用[5]。但对于成年期动物而言,连续性高原缺氧环境暴露是否影响其空间学习和记忆功能尚缺乏研究。本文旨在探讨急性和慢性高原持续性缺氧对成年大鼠空间学习和记忆功能的影响。
材 料 和 方 法
1 材料
1.1 动物和分组 成年雄性SD 大鼠(由第三军医大学大坪医院动物实验中心提供),起始体质量160 g ~180 g。动物先在光/暗周期为12 h/12 h、光照时间(8:00 ~20:00)的条件下饲养适应3 d。本实验分为三部分。实验一:随机分为平原组(A 组)和急性高原缺氧组(B 组),每组15 只;实验二:随机分为平原组(C 组)和慢性高原缺氧组(D 组),每组13 只;实验三:随机分为平原组(E 组)和急性高原缺氧组(F 组),每组15 只。
1.2 主要仪器 高原低压环境模拟舱(第三军医大学高原军事医学系);Morris 水迷宫(中国医学科学院药物所)。
2 方法
2.1 高原缺氧模型制备 B 组置于低压舱模拟海拔7 000 m高原,连续暴露72 h 后返回平原,24 h 后两组同时进行Morris 水迷宫定位巡航实验和空间探索实验;D 组置于低压舱模拟海拔6 000 m 高原,连续暴露35 d 后返回平原,24 h 后同时进行Morris 水迷宫定位巡航实验和空间探索实验。F 组于Morris水迷宫定位巡航实验和空间探索实验后置于低压舱模拟海拔7 000 m 高原,连续暴露72 h 后返回平原,2 h 后进行空间探索实验。
2.2 Morris 水迷宫实验 实验一:A 组和B 组大鼠进行水迷宫实验,将各组大鼠在开始训练前取出平台在水中适应20 s,再进行学习训练,连续训练3 d,每天4 次,记录大鼠寻找平台的时间(逃避潜伏期)。如果时间超过120 s 大鼠未寻找到平台,则引导大鼠至平台并停留20 s,第4 d 行120 s 的空间探索实验,记录大鼠穿越平台的次数、在目标象限停留的时间、在目标象限的行进速度和第一次寻找到平台的时间。实验二:C 组和D 组大鼠进行水迷宫学习训练,连续训练5 d,每天4 次,第6 天行空间探索实验(方法同前),所记录数据同前。实验三:E 组和F 组均先进行连续5 d 的学习训练,第6 天行空间探索实验后,F 组于低压舱模拟海拔7 000 m 连续暴露72 h 后返回平原,2 h 后行空间探索实验(方法同前),所记录数据同前。所有实验过程中保持实验室的光线和环境布局不变。
3 统计学处理
数据以均数± 标准差(mean ± SD)表示,采用SPSS 16.0 软件包分析,用t 检验进行组间比较,以P <0.05为差异有统计学意义。
结 果
1 急性高原缺氧对大鼠空间学习和记忆能力的影响
以Morris 水迷宫实验检测大鼠空间学习记忆力。在定位巡航实验中,急性高原缺氧组(B 组)在第1 天的逃避潜伏期较平原组(A 组)显著缩短(P <0.05)。在第2 天和第3 天的巡航实验中,两组的逃避潜伏期较第1 天显著缩短(P <0.05),但A、B 两组间无显著差异(P >0.05),见表1。第4 天在撤去平台后120 s 内两组动物穿越平台的次数及在目标象限停留时间的百分比均无显著差异(P >0.05),见表2。
2 慢性高原缺氧对大鼠空间学习和记忆能力的影响
在定向巡航实验中,平原对照组(C 组)和慢性高原缺氧组(D 组)逃避潜伏期均随着训练天数增加而缩短,但在各个时点上2 组大鼠的逃避潜伏期相比均无显著差异(P >0.05),见表3。第6 天撤去平台后,C 组大鼠和D 组大鼠120 s 内跨越平台的次数及在目标象限停留时间的百分比等均无显著差异(P >0.05),见表4。

表1 急性高原缺氧对大鼠空间学习能力的影响Table 1. Effects of acute hypobaric hypoxia on spatial learning of rats (mean±SD.n=15)

表2 急性高原缺氧对大鼠空间记忆能力的影响Table 2. Effects of acute hypobaric hypoxia on spatial memory of rats (mean±SD.n=15)
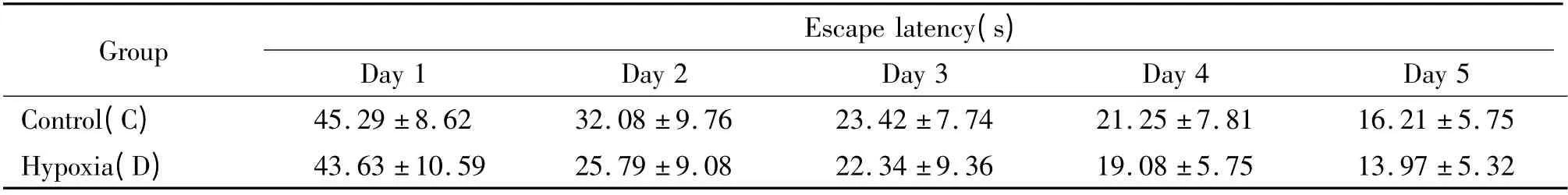
表3 慢性高原缺氧对大鼠空间学习能力的影响Table 3. Effects of chronic hypobaric hypoxia on spatial learning of rats (mean±SD.n=13)

表4 慢性高原缺氧对大鼠空间记忆能力的影响Table 4. Effects of chronic hypobaric hypoxia on spatial memory of rats (mean±SD.n=13)
3 急性缺氧对大鼠空间记忆维持的影响
为了检测缺氧对于大鼠空间记忆维持的影响,在缺氧前对大鼠进行定位巡航实验,连续训练5 d,每天4 次,第6 天进行空间探索实验后,随机分为平原组(E 组)和急性高原缺氧组(F 组),F 组急性高原缺氧72 h,2 h 后行空间探索实验,结果显示,两组大鼠穿越平台的次数及在目标象限停留时间的百分比等均无显著差异(P >0.05),见表5。
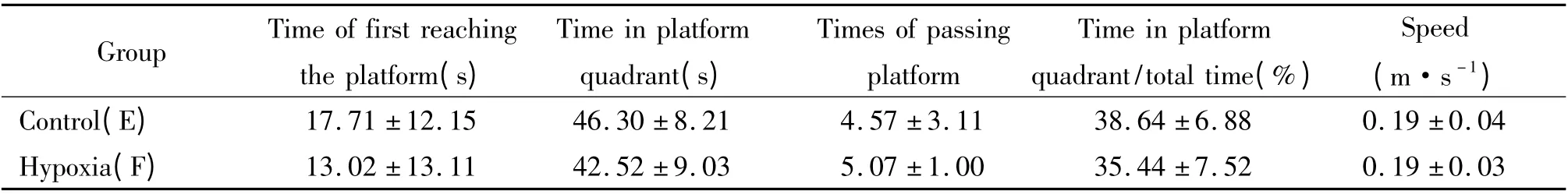
表5 急性高原缺氧对大鼠空间记忆能力维持的影响Table 5. Effects of acute hypobaric hypoxia on spatial memory maintenance of rats (mean±SD.n=15)
讨 论
研究表明,高原缺氧可影响机体的计算、判断、精细操作等认知功能,但其是否影响成年动物空间学习、记忆能力以及学习所获得的空间位置觉和方向觉的维持尚缺乏研究。Morris 水迷宫是一种经典的检测动物空间位置觉和方向觉(空间定位)的学习、记忆能力的方法[6]。大量文献表明动物在水迷宫实验中的表现通常与海马回路的长时程增强(long-term potentiation,LTP)产生及NMDA 受体功能密切相关[7-9]。在本实验中,我们发现在急性高原缺氧后,大鼠在第1 d 的巡航实验中其学习能力较平原组大鼠显著增加,而随后几天的巡航实验和最后1 d的空间探索中与平原组相比没有显著差异;而慢性缺氧的大鼠在整个实验过程中与平原组大鼠相比均无显著差异。这些结果表明成年期大鼠在急、慢性缺氧后其空间位置觉和方向觉(空间定位)的学习、记忆能力并未受到明显抑制,甚至在急性缺氧再复氧后的短期(1 d)内学习能力有一定提升。
长期以来,人们普遍认为缺氧会抑制海马神经元功能,从而导致其学习记忆能力降低。一些人体研究表明,登山或者在低压舱模拟高原缺氧暴露可导致学习、记忆功能受损[10-11]。在动物实验方面,也有研究报道缺氧会引起学习记忆能力的衰退。Mikati 等[4]报道,新生大鼠出生后急性缺氧至P10,其成年后(P80)学习记忆能力明显下降。Simonova等[12]将大鼠在出生后即行间断性缺氧至第19 天,然后在P23 ~P32 和P100 ~P109 时对大鼠进行水迷宫实验,结果显示缺氧组大鼠的逃生潜伏期较对照组大鼠显著延长。我们以往的研究也发现低氧幼鼠和低氧孕鼠所生子鼠在其平均逃生潜伏期明显高于正常对照组[3]。这些研究结果表明高原低氧可造成胚胎期或新生期动物的学习、记忆能力受损,其机制可能与缺氧影响神经系统发育等因素有关。
近年来,有越来越多的文献对缺氧是否引起机体学习记忆功能减退提出了不一致的观点。Mikati等[4]研究发现出生后的大鼠慢性缺氧后其水迷宫实验表现与对照组大鼠相比无显著差异。此外,有研究表明缺氧对于大脑学习和记忆功能具有促进作用。Wittner 等[5]研究发现,出生后30 d 的大鼠短暂缺氧后,其逃避潜伏期较对照组大鼠显著缩短,探索效率(search efficiencies for the memory acquisition test)显著升高。Zhang 等[13]报道,大鼠出生后即行模拟海拔2 000 m 和5 000 m 高原的间断性缺氧4 周后,其逃生潜伏期较对照组显著缩短。而同样的缺氧方式在成年大鼠则表现为水迷宫实验没有明显差异,但在穿梭箱(shutter-box)实验中,海拔5 000 m 缺氧25 d 的大鼠其有效回避反应显著减少,该研究认为高原低压缺氧抑制了海马-非依赖性的认知,而对海马-依赖性的学习记忆功能没有显著影响[14]。上述这些研究中所采用的缺氧方式、强度以及持续时间均有所不同,这可能是这些研究得到的结论不一致的重要原因。上述研究中采用的均是间歇性缺氧的模式,有关持续性不间断高原缺氧暴露对成年动物学习记忆能力影响的报道匮乏。本研究采用持续性不间断模拟高原缺氧的模式,这更接近真实的高原缺氧环境,更有利于准确反映高原缺氧对机体学习记忆的影响。
本研究结果显示,急、慢性持续性高原缺氧暴露后,成年大鼠的空间位置觉和方向觉(空间定位)的学习、记忆能力并未受到明显抑制,我们推测其可能是由于缺氧诱导中枢神经系统产生某些内源性保护机制。研究表明,低氧可以促进神经干细胞增殖,抑制其凋亡,并诱导其分化,从而可能对大脑损伤有潜在的修复能力[15]。另一方面,低氧刺激兴奋性氨基酸、多巴胺等神经递质的释放可能也参与其中,但具体的机制尚有待进一步研究。我们以往的研究结果显示,模拟高原缺氧(7 000 m,2.5 h/d,3 d)对小鼠海马CA1 区的神经元结构和密度无显著影响[16]。Langmeier 等[17]的研究也显示,出生后1 d 的大鼠暴露于模拟高原环境(7 000 m,8 h/d,18 d),1 周后观察脑组织的形态学变化,未见细胞结构显著损伤。在本研究中我们检测了慢性高原缺氧大鼠海马的形态学变化和与学习记忆功能密切相关的突触素的表达,结果显示无显著变化(数据未列出)。总之,高原缺氧环境下机体不同类型学习记忆功能的变化特点、规律及其机制有待进一步深入研究。
[1] Fernando P,Ramirez JM. Hypoxia-induced changes in neuronal network properties[J]. Mol Neurobiol,2005,32(3):251-284.
[2] 王 煜,肖 波. 缺氧诱导胚胎大鼠神经干细胞凋亡的初步研究[J]. 中国病理生理杂志,2003,19(4):544-545,571.
[3] 黄 辉,阮怀珍,张金海,等. 高原低氧对大鼠学习记忆影响的实验研究[J]. 中国行为医学科学,2002,11(01):8-9.
[4] Mikati MA,Zeinieh MP,Kurdi RM,et al. Long-term effects of acute and of chronic hypoxia on behavior and on hippocampal histology in the developing brain[J]. Brain Res Dev Brain Res,2005,157(1):98-102.
[5] Wittner M,Riha P. Transient hypobaric hypoxia improves spatial orientation in young rats[J]. Physiol Res,2005,54(3):335-340.
[6] Vorhees CV,Williams MT. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc,2006,1(2):848-858.
[7] 方 松,余化霖. Morris 水迷宫实验中海马相关空间学习记忆的研究进展[J]. 国际病理科学与临床杂志,2010,30(4):321-326.
[8] Sun MK,Xu H,Alkon DL. Pharmacological protection of synaptic function,spatial learning and memory from transient hypoxia in rats[J]. J Pharmacol Exp Ther,2002,300(2):408-416.
[9] Maiti P,Muthuraju S,Llavazhagan G,et al. Hypobaric hypoxia induces dendritic plasticity in cortical and hippocampal pyramidal neurons in rat brain[J]. Behav Brain Res,2008,189(2):233-243.
[10]Hornbein TF,Townes BD,Schoene RB,et al. The cost to the central nervous system of climbing to extremely high altitude[J]. N Engl J Med,1989,321(25):1714-1719.
[11]Shukitt-Hale B,Banderet LE,Lieberman HR. Elevationdependent symptom,mood and performance changes produced by exposure to hypobaric hypoxia[J]. Int J Aviat Psychol,1998,8(4):319-334.
[12]Simonova Z,Sterbova K,Brozek G,et al. Postnatal hypobaric hypoxia in rats impairs water maze learning and the morphology of neurones and macroglia in cortex and hippocampus[J]. Behav Brain Res,2003,141(2):195-205.
[13]Zhang JX,Chen XQ,Du JZ,et al. Neonatal exposure to intermittent hypoxia enhances mice performance in water maze and 8-arm radial maze tasks[J]. J Neurobiol,2005,65(1):72-84.
[14]Zhang JX,Lu XJ,Wang XC,et al. Intermittent hypoxia impairs performance of adult mice in the two-way shuttle box but not in the Morris water maze[J]. J Neurosci Res,2006,84(1):228-235.
[15]Studer L,Csete M,Lee SH,et al. Enhanced proliferation,survival and dopaminergic differentiation of CNS precursors in lowered oxygen[J]. J Neurosci,2000,20(19):7377-7383.
[16]范有明,高钰琪,刘福玉,等. 低压缺氧延迟预适应对小鼠海马神经元的保护作用研究[J]. 中国病理生理杂志,2006,22(1):93-97.
[17]Langmeier M,Maresová D. Intermittent hypobaric hypoxia during development:morphologic changes in the neocortex and hippocampus[J]. Cesk Fysiol,1998,47(2):62-66.

