纤溶酶原激活物抑制剂1 siRNA对大鼠肺纤维化的治疗作用*
张彦萍, 田园园, 白林林, 王卫丽, 刘 建, 李文斌, 马丽华
(1河北医科大学第二医院呼吸科,河北 石家庄050000;2河北医科大学基础医学院病理生理教研室,河北 石家庄050017)
特发性肺纤维化以成纤维细胞转化为肌成纤维细胞及细胞外基质过度沉积为特征[1]。越来越多的研究表明,纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)可能作为独立的危险因素参与了肺纤维化的进程[2]。RNA 干扰技术的应用为研究PAI-1 在肺纤维化发生中的作用提供了更加有利的手段。我们前期已经通过组织学观察到气管内滴入PAI-1 小干扰RNA (small interfering RNA,siRNA)可减轻肺组织内胶原沉积[3]。然而,其作用机制尚不完全清楚,本研究我们从分子水平进一步观察PAI-1 siRNA 治疗后对肺组织Ⅲ型胶原、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1,TIMP-1)mRNA 表达的影响,并初步探讨其机制。
材 料 和 方 法
1 材料
Wistar 大鼠(河北省实验动物中心),博莱霉素(bleomycin,BLM;天津太河制药有限公司),PAI-1 siRNA(广州锐博生物科技有限公司),PAI-1 活性测定试剂盒(Diagnostica),RT-PCR 试剂盒(TaKaRa),Ⅲ型胶原、α-SMA、TIMP-1 和内参照GAPDH 的引物由上海生工生物工程技术服务有限公司合成,序列见表1。
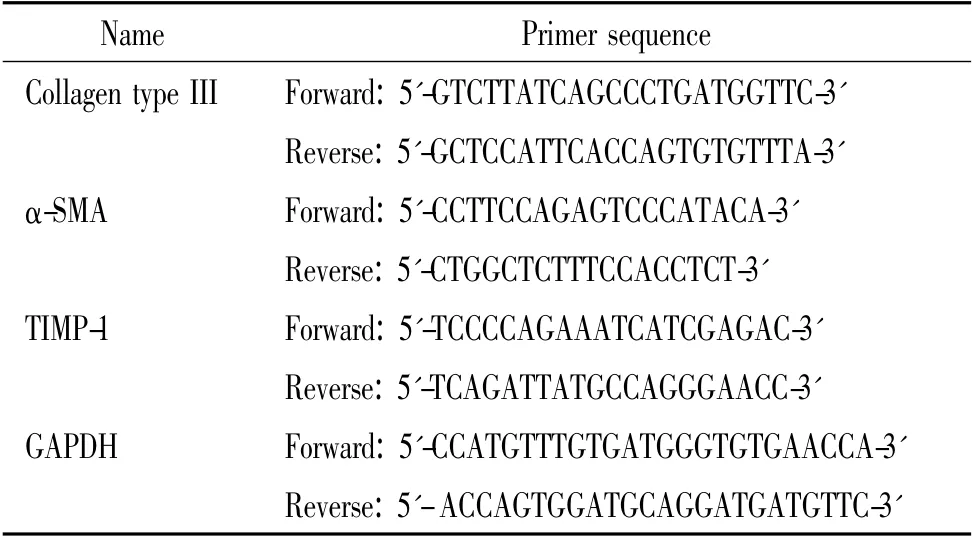
表1 RT-PCR 引物序列Table 1. Sequences of the primers for RT-PCR
2 方法
2.1 博莱霉素肺纤维化模型的建立和PAI-1 siRNA的处理 Wistar 清洁级雄性大鼠72 只,体重(140 ±20)g,采用随机数字表法将实验动物分成4 组,对照组(control 组)、BLM 组、BLM + 非特异siRNA 组(BLM + N 组)和BLM + PAI-1 siRNA 组(BLM + P组),每组18 只,无水乙醚局部麻醉,仰卧位固定,常规消毒,行颈正中切口,暴露气管,BLM 组、BLM +N组和BLM + P 组按5 mg/kg 注入生理盐水溶解的BLM 0.2 mL,control 组注入等体积生理盐水。造模后,每周2 次气管内给药,4 周共给药8 次,BLM +P组注入DEPC 水溶解的PAI-1 siRNA 7.5 nmol (0.2 mL);BLM+N 组注入相同剂量的非特异siRNA;control 组和BLM 组注入0.2 mL 生理盐水。上述4 组动物分别于第7 d、14 d 和28 d 各处死6 只,左侧肺行肺泡盥洗,右中叶组织储存于-80 ℃液氮中,行RT-PCR 检测。
2.2 肺泡灌洗液中PAI-1 活性的测定 采用发色底物法测定肺泡灌洗液中PAI-1 活性,操作按照试剂盒说明书进行。
2.3 RT-PCR 法测定肺组织3 型胶原、α-SMA 和
TIMP-1 mRNA 的表达 采用一步法提取RNA。取大鼠新鲜的肺组织50 ~100 mg 放入匀浆管中,迅速加入1 mL TRIquick,冰上快速充分研磨,4 ℃、12 000 r/min离心10 min,取上清。经加入氯仿、异丙醇、乙醇洗涤沉淀后,紫外分光光度仪对RNA 进行定量分析,以A260与A280比值了解RNA 的纯度。另取1 μL RNA 在1%琼脂糖凝胶上电泳,检测RNA 是否完整。按照试剂盒说明书进行反转录反应。PCR反应条件:94 ℃30 s,60 ℃(Ⅲ型胶原和TIMP-1)或58 ℃(α-SMA)30 s,72 ℃30 s,与内参照GAPDH 同管扩增,共30 个循环。
3 统计学处理
计量资料数据用均数±标准差(mean ±SD)表示。采用SPSS 13.0 进行单因素方差分析(One-way ANOVA),比较组间差异,有显著差异者用最小显著差(LSD)法进行两两比较,以P <0.05 为差异有统计学意义。
结 果
1 每周2 次气管内滴注PAI-1 siRNA 持续抑制肺泡灌洗液中PAI-1 的活性
应用博莱霉素制作肺纤维化模型后,control 组动物身体健壮,BLM 组及非特异siRNA 组动物萎靡不振,呼吸急促,消瘦明显,PAI-1 siRNA 组动物轻度呼吸困难,略有消瘦,虽然反复行气管切开,但切口愈合良好,组织粘连不明显。在我们最近发表的论文中,通过组织学观察也证实博莱霉素肺纤维化模型制作成功[3]。
造模成功后,我们观察到模型组7 d、14 d 和28 d 肺泡灌洗液中PAI-1 活性升高,与control 组比较有明显差异,并且存在时间依赖性。每周2 次气管内注入PAI-1 siRNA 后,BLM +P 组灌洗液中PAI-1 活性明显减低,与同一时点BLM 组有明显差异(均P <0.05),BLM 组与BLM +N 组比较差异无统计学意义,说明非特异性siRNA没有治疗效果,见图1。

Figure 1. The activity of plasminogen activator inhibitor-1 (PAI-1)in bronchoalveolar lavage fluid on day 7,14,and 28 after intratracheal injection or PAI-1 siRNA in bleomycin(BLM)-induced rat lung tissues. Mean ±SD.n=6. * P <0.05 vs control;△P <0.05 vs BLM.图1 气管内滴入PAI-1 siRNA 7 d、14 d 和28 d 支气管肺泡灌洗液中PAI-1 活性的变化
2 PAI-1 siRNA 抑制肺组织Ⅲ型胶原的合成和α-SMA 的表达
由图2、3 可见,气管内滴入博来霉素7 d、14 d和28 d 后,BLM 组动物肺组织Ⅲ型胶原及α-SMA 表达明显升高,与control 组比较有明显差异,BLM 组与BLM+N 组比较无统计学意义。每周2 次气管内注入PAI-1 siRNA 后,3 个时点BLM +P 组动物肺组织Ⅲ型胶原及α-SMA 表达均明显减少,与同一时点BLM 组比较有明显差异(均P <0.05)。
3 PAI-1 siRNA 抑制肺组织TIMP-1 的表达
图4 显示,在7 d、14 d、28 d,博来霉素诱导模型组动物肺组织TIMP-1 表达增加,BLM +P 组动物肺组织TIMP-1 的表达较同一时点BLM 组比较明显减低(均P <0.05)。

Figure 2. The expression of collagen type Ⅲon day 7 (A),14 (B)and 28 (C)after intratracheal injection of PAI-1 siRNA in BLMinduced rat lung tissues. M:marker. Mean±SD. n=6. * P <0.05 vs control;△P <0.05 vs BLM.图2 气管内滴入PAI-1 siRNA 7 d、14 d 和28 d 对肺组织Ⅲ型胶原表达的影响
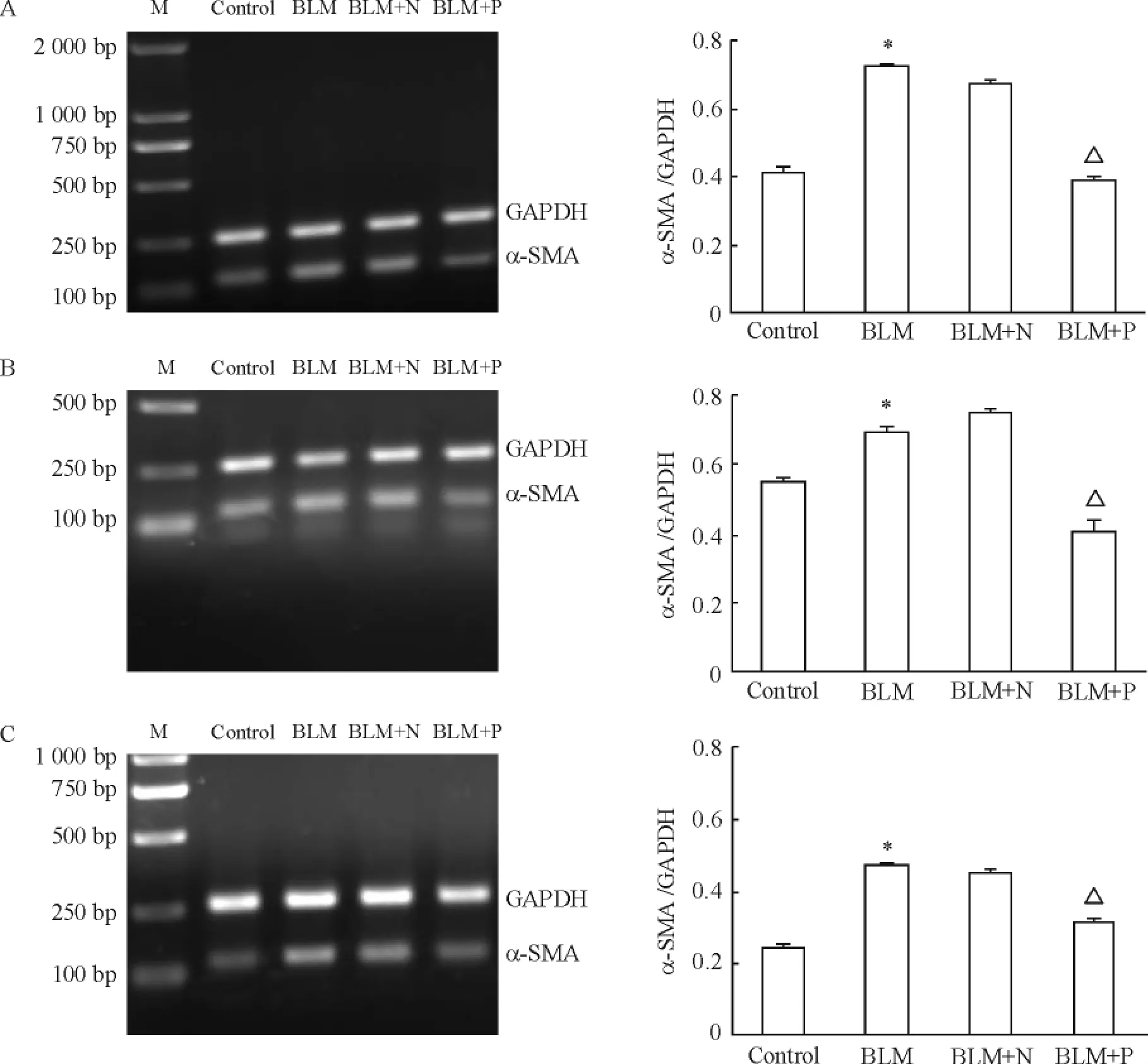
Figure 3. The expression of α-smooth muscle (α-SMA)actin on day 7 (A),14 (B)and 28 (C)after intratracheal injection PAI-1 of siRNA in BLM-induced rat lung tissues. M:marker. Mean ± SD. n =6. * P <0.05 vs control;△P <0.05 vs BLM.图3 气管内滴入PAI-1 siRNA 7 d、14 d 和28 d 对肺组织α-SMA 表达的影响
讨 论
虽然RNA 干扰(RNAi)在哺乳动物细胞中成功应用仅有10 余年,但已经成为基因功能研究及基因治疗的全新手段[4]。由于核酸酶的影响,siRNA 在动物体内不稳定,因此,如何将siRNA 递送到动物体内已经成为RNAi 面临的主要问题。对SARS 病毒、支气管哮喘等模型的研究表明,鼻腔或气管局部给药可以在肺部产生显著的靶向基因沉默[5-7],但是这些模型大多在3 ~5 d,对肺纤维化这样需要至少28 d 的长时间模型,如何减少核酸酶的影响还少有研究。为了产生最大的沉默效果,我们首先进行了细胞水平的实验,观察到PAI-1 促进成纤维细胞增殖和胶原合成[8],PAI-1 siRNA 对肺成纤维细胞的沉默效率在70%左右[9],然后我们将siRNA 进行甲基化修饰,以增加siRNA 的稳定性,局麻下采用每周2 次气管内滴入的方式,将药物直接注入大鼠肺组织,4周内共给药8 次。我们观察到PAI-1 siRNA 组动物精神萎靡不明显,轻度呼吸困难,切口愈合良好,局部黏连较轻,操作时易于分离。同时,我们观察到模型组肺泡灌洗液中PAI-1 活性随着时间延长持续增加,说明肺纤维化过程中纤溶活性持续受损。滴入siRNA 后,7 d、14 d 和28 d 灌洗液中PAI-1 的活性明显减低,说明我们的方法可以成功沉默PAI-1 基因,减少肺组织PAI-1 的表达。

Figure 4. The expression of TIMP-1 on day 7 (A),14 (B)and 28 (C)after intratracheal injection of PAI-1 siRNA in BLM-induced rat lung tissues. M:marker.Mean±SD. n=6. * P <0.05 vs control;△P <0.05 vs BLM.图4 气管内滴入PAI-1 siRNA 7 d、14 d 和28 d 对肺组织TIMP-1 表达的影响
成功地沉默了PAI-1 基因后,我们进一步观察了PAI-1 siRNA 对博莱霉素诱导的纤维化肺组织胶原沉积及成纤维细胞转化的影响。我们知道,α-SMA是肌成纤维细胞特有的标志,α-SMA 表达增加表明成纤维细胞转化为肌成纤维细胞,从而合成更多的胶原纤维。研究表明,肺纤维化程度与α-SMA 的水平有关[10]。我们通过PCR的方法观察到气管内滴入博莱霉素后,肺组织Ⅲ型胶原及α-SMA表达明显升高,诱导肺纤维化发生。每周2 次气管内滴入PAI-1 siRNA 可以使纤维化的肺组织Ⅲ型胶原及α-SMA表达减少。我们最近通过组织学和免疫组化研究也观察到气管内滴入PAI-1 siRNA 减少纤维化肺组织胶原沉积[3],在细胞水平,我们也观察到PAI-1 对成纤维细胞的直接作用[10]。我们认为,降低PAI-1 的表达可以抑制成纤维细胞转化为肌成纤维细胞,抑制胶原合成,从而抑制肺纤维化的发生、发展。PAI-1 可能作为肺纤维化治疗的新靶点。
我们进一步探讨了PAI-1 siRNA 抑制肺纤维化的机制。近年来研究表明,PAI-1 在细胞增殖、凋亡、肿瘤血管的发生、促进动脉硬化及器官纤维化中发挥重要作用[11-12],已有尝试应用PAI-1 siRNA 治疗肝纤维化的报道[13]。但是机制还不清楚。我们知道,PAI-1 的生理作用是抑制尿激酶型纤溶酶原激活剂和组织型纤溶酶原激活剂,进而抑制纤溶酶的活性。纤溶酶能够降解胶原纤维已是不争的事实,更有近来Horowitz 等[14]和Bauman 等[15]认为纤溶酶活化可以促进成纤维细胞凋亡和前列腺素E2的合成。本研究中我们没有从传统观念观察PAI-1 对纤溶酶的影响,而是观察PAI-1 siRNA 对肺组织胶原产生的直接作用和对TIMP-1 表达的影响。我们知道,基质金属蛋白酶及其组织抑制物的平衡在肺纤维化的发生中起重要作用,过度表达TIMP-1 可以使细胞外基质合成过剩,沉积于肺间质,导致肺纤维化,我们在实验中观察到气管内滴入PAI-1 siRNA 可以使纤维化的肺组织中TIMP-1 表达减少,同时伴随有肺纤维化的减轻,因此我们认为,PAI-1 siRNA 可能是通过打破基质金属蛋白酶及其组织抑制物的平衡发挥作用的。
总之,通过本实验我们观察到,每周2 次气管内注入PAI-1 siRNA 可以使支气管肺泡灌洗液PAI-1表达持续减低,并且抑制肺纤维化的发生、发展,在此过程中,伴随有基质金属蛋白酶及其组织抑制物的失衡。PAI-1 有望成为肺纤维化治疗的新靶点。
[1] Doubková M,Skhicková J. Idiopathic pulmonary fibrosis[J]. Vnitr Lek,2005,51(12):1375-1384.
[2] Chuang-Tsai S,Sisson TH,Hattori N,et al. Reduction in fibrotic tissue formation in mice genetically deficient in plasminogen activator inhibitor-1[J]. Am J Pathol,2003,163(2):445-452.
[3] Zhang YP,Li WB,Wang WL,et al. siRNA against plasminogen activator inhibitor-1 ameliorates bleomycin-induced lung fibrosis in rats[J]. Acta Pharmacol Sin,2012,33(7):897-908.
[4] Castanotto D,Rossi1 JJ. The promises and pitfalls of RNA interference-based therapeutics[J]. Nature,2009,457(7228):426-433.
[5] Durcan N,Murphy C,Cryan SA. Inhalable siRNA:potential as a therapeutic agent in the lungs[J]. Mol Pharm,2008,5(4):559-566.
[6] Miyamoto S,Hattori N,Senoo T,et al. Intra-airway administration of small interfering RNA targeting plasminogen activator inhibitor-1 attenuates allergic asthma in mice[J]. Am J Physiol Lung Cell Mol Physiol,2011,301(6):L908-L916.
[7] Cao YL,Wang Y,Guo R,et al. Identification and characterization of three novel small interference RNAs that effectively down-regulate the isolated nucleocapsid gene expression of SARS coronavirus[J]. Molecules,2011,16(2):1544-1558.
[8] 张彦萍,王卫丽,刘 建,等. 纤维溶解酶原激活物抑制剂-1 对大鼠胚肺成纤维细胞的影响[J]. 中华结核和呼吸杂志,2011,34(7):500-503.
[9] Zhang YP,Wang WL,Liu J,et al. Plasminogen activator inhibitor-1 promotes the proliferation and inhibits the apoptosis of pulmonary fibroblasts by Ca2+signaling[J].Thromb Res,2012,131(1):64-71.
[10]李佳鑫,海广范,贾岩龙,等.全反式维甲酸对人胚肺成纤维细胞增殖及α-SMA 表达的影响[J]. 中国病理生理杂志,2011,27(4):787-790.
[11] Balsara RD,Ploplis VA. Plasminogen activator inhibitor-1:the doubleedged sword in apoptosis[J]. Thromb Haemost,2008,100(6):1029-1036.
[12] Lademann UA,Rømer MU. Regulation of programmed cell death by plasminogen activator inhibitor type 1 (PAI-1)[J]. Thromb Haemost,2008,100(6):1041-1046.
[13]Hu PF,Chen H,Zhong W,et al. Adenovirus-mediated transfer of siRNA against PAI-1 mRNA ameliorates hepatic fibrosis in rats[J]. J Hepatol,2009,51(1):102-113.
[14]Horowitz JC,Rogers DS,Simon RH,et al. Plasminogen activation induced pericellular fibronectin proteolysis promotes fibroblast apoptosis[J]. Am J Respir Cell Mol Biol,2008,38(1):78-87.
[15]Bauman KA,Wettlaufer SH,Okunishi K,et al. The antifibrotic effects of plasminogen activation occur via prostaglandin E2synthesis in humans and mice[J]. J Clin Invest,2010,120 (6):1950-1960.

