环氧化酶-2和细胞周期素D1蛋白在胆管癌中的表达及其临床意义
谷化平 黄 勇 尚培中
我们采用免疫组化方法检测胆管癌(CHC)、癌旁胆管组织 (TAC)和正常胆管组织(NBDT)中环氧化酶-2(cyclooxy-genase-2,COX-2)和细胞周期素D1(Cyclin D1)蛋白表达状况,旨在探讨其表达水平与CHC发生发展和临床病理特征的关系,为判断CHC患者的预后提供生物学参考指标。
1 材料与方法
1.1 材料
1.1.1 标本来源 选取我院2003年01月~2012年09月手术切除并经病理检查证实的胆管腺癌标本50例。其中男性33例,女性17例,平均年龄(51.8±13.5)岁,年龄23~77岁;高、中分化癌35例、低分化癌15例;有转移者31例(包括淋巴结、肝、胆囊、肠系膜和胰腺等),无转移者19例。TNM分期: Ⅰ期10例,Ⅱ期18例,Ⅲ期14例,Ⅳ期8例。以与CHC同期的20例TAC(距瘤缘0.5 cm)和20例NBDT作为对照。标本均经40 g/L中性福尔马林液固定,石蜡包埋,4 μm厚连续切片。
1.1.2 试剂 鼠抗人COX-2和Cyclin D1单克隆抗体和LSAB试剂盒购自迈新生物技术公司(均为即用型)。
1.2 方法
1.2.1 免疫组织化学染色 免疫组织化学染色采用微波-EliVisionTM(MW- EliVisionTM)法,参照试剂盒说明书进行操作。实验以已知COX-2和Cyclin D1阳性大肠癌组织作为阳性对照,以枸橼酸缓冲液代替一抗作为阴性对照。H2O2-DAB显色。
1.2.2 结果判断 COX-2阳性产物定位于细胞质、Cyclin D1阳性产物定位于细胞核,呈棕黄色染色者为阳性。采用单盲法,每张切片在400倍显微镜下选定10个视野,计算阳性细胞数。阴性(-):未见棕黄色颗粒;弱阳性(+):阳性细胞数<25%;阳性(++):阳性细胞数25%~75%;强阳性(+++):阳性细胞数>75%。
1.3 统计学处理
应用SPSS 17.0 软件处理数据,计数资料采用χ2检验,免疫组化指标间相关性采用Spearman相关性分析,α=0.05为检验水准。
2 结果
2.1 COX-2和Cyclin D1在胆管良、恶性病变组织中的表达
CHC、TAC 和 NBDT中COX-2阳性表达率分别为78.0%(39/50)、43.3%(13/30)和0(0/20),差异有显著性(χ2=9.90,χ2=43.03,P<0.05),TAC 与 NBDT比较有显著差异性(χ2=8.23,P<0.05);CHC、TAC 和 NBDT中Cyclin D1阳性表达率分别为68.0%(36/50)、36.7%(11/30)和25.0%(5/20),差异有显著性(χ2=9.66,χ2=13.01,P<0.05),TAC 与 NBDT比较无显著差异性(χ2=0.67,P>0.05)。
2.2 COX-2和Cyclin D1表达与CHC临床病理参数的关系
COX-2表达与CHC患者性别、年龄和肿瘤分化程度无关(P>0.05),而与肿瘤TNM分期和转移状况相关(P<0.05);Cyclin D1表达与CHC患者性别、年龄无关(P>0.05),而与肿瘤分化程度、TNM分期和转移状况相关(P<0.05),见表1。
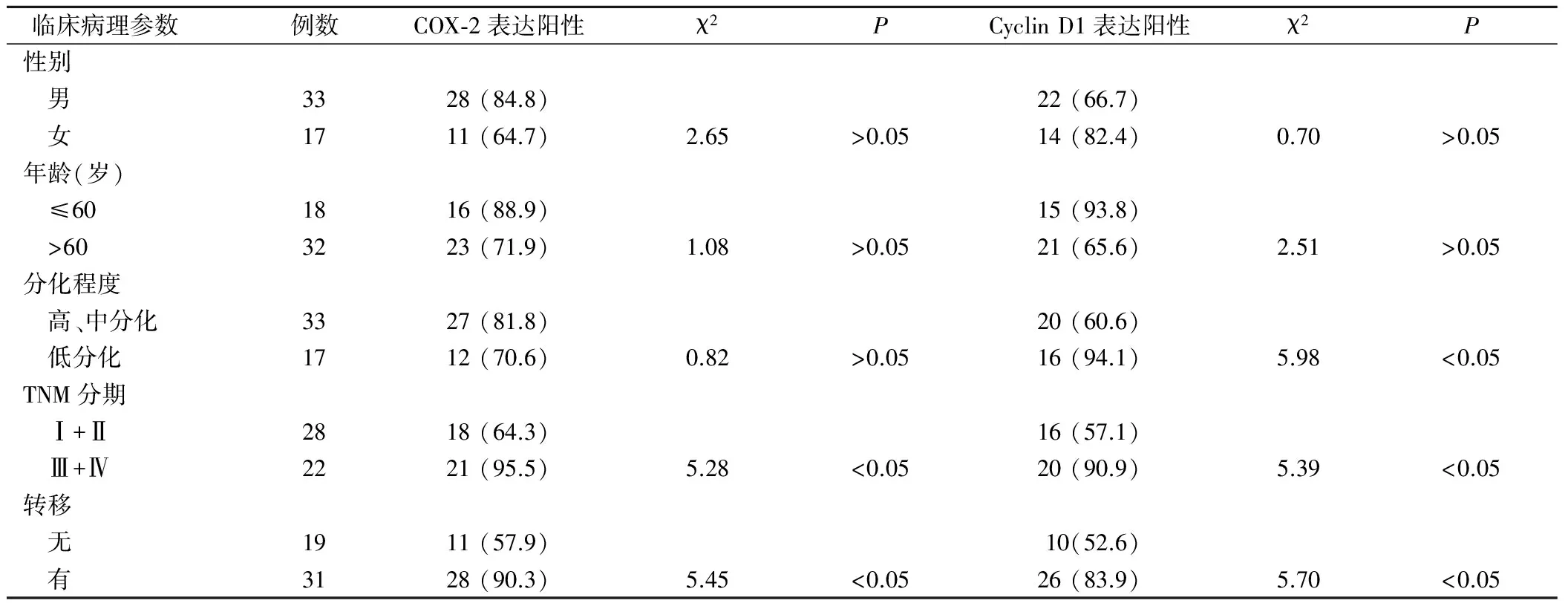
表1 COX-2和Cyclin D1表达与CHC临床病理参数的关系(例,%)
2.3 胆管癌中COX-2与Cyclin D1表达间的相关性
39例COX-2表达阳性CHC中,Cyclin D1阳性表达有31例(79.5%);11例COX-2阴性表达CHC中,Cyclin D1阳性表达有5例(45.5%);CHC组织中COX-2表达与Cyclin D1表达呈显著正相关(γ=0.32,P<0.05)。
3 讨论
近年来肿瘤分子生物学研究表明,恶性肿瘤的形成和转移的发生是一个多基因、多因子各自发挥或相互协同作用的结果。因此,寻找、研究和揭示肿瘤的相关抗原或标志物与肿瘤的关系,对肿瘤诊断、有效防治、预测预后及术后辅助治疗提供依据具有十分重要意义。环氧合酶(cyclooxygenase,COX)又称前列腺素内过氧化物酶,是前列腺素合成过程中一个重要的限速酶,它可将花生四烯酸代谢成各种前列腺素产物,从而参与机体的多种病理生理过程,如炎症、发热及出凝血机制等。COX是膜结合蛋白,存在于核膜和微粒体膜[1],它有2种同工酶,即结构型COX-1和诱生型COX-2。COX-2是1种诱导性即刻反应基因,在正常生理状态下,绝大多数正常组织中检测不到COX-2表达,只有当细胞受到刺激才能迅速诱导表达COX-2。近年来研究表明,COX-2除在炎症反应中起重要作用外,尚与肿瘤密切相关,它可通过刺激肿瘤细胞增殖和生长、抑制细胞凋亡、促进肿瘤血管形成、增强细胞侵袭力、抑制机体免疫功能、促进癌前病变向肿瘤转化等肿瘤的形成[2]。研究证实,包括大肠癌、胃癌、胰腺癌、前列腺癌和肺癌等肿瘤组织中COX-2表达均明显增高,并与肿瘤的转移明显相关[3~7]。本研究结果显示,在NBDT→TAC→CHC中COX-2表达阳性率逐渐递增(P<0.05),并随着CHC的TNM分期增高和器官转移其表达阳性率亦随之显著增高(P<0.05)。有关COX-2表达与CHC分化程度的关系研究,目前存在不同结论。Kim等[5]研究结果,COX-2表达与CHC分化程度无关。Wu等[8]研究结果,COX-2表达与CHC分化程度有关。本研究结果显示,COX-2表达与CHC分化程度无关。提示,COX-2在胆管上皮细胞的恶性转化、临床进展和转移过程中起着重要促进作用,可能是CHC发生的早期事件,而对于判断CHC的恶性程度方面意义不大。
Cyclin D1基因是1种原癌基因,定位于染色体11q13,为细胞周期的正性调控因子,与CDK4/CDK6结合并使之激活,活化的CDK4/CDK6使pRb在G1-S转换期发生磷酸化,释放出E2F,进一步激活S期相关基因的转录,推动细胞从G1期进入S期,该基因编码蛋白质的表达失控有可能引起细胞异常增殖而发生肿瘤。目前已发现Cyclin D1蛋白在人类许多恶性肿瘤如乳腺癌、食管癌、胃癌、胆囊癌、胰腺癌等组织中有过表达出现[9~11]。有关Cyclin D1基因在CHC中的研究文献报道甚少,刘三光等[12]联合应用流式细胞分析术和逆转录-聚合酶链反应(RT-PCR)技术,检测了CHC、TAC 和 NBDT中的Cyclin D1蛋白和mRNA表达水平,结果显示在CHC、TAC 和 NBDT中,Cyclin D1蛋白和mRNA表达水平均呈现上升趋势(P<0.05),认为Cyclin D1基因转录和蛋白可能参与了CHC的发生发展过程。本研究结果表明Cyclin D1基因的改变在CHC发生发展过程中起着重要作用,检测Cyclin D1蛋白表达可作为判断CHC恶性程度和生物学行为的参考指标之一。
现代医学研究认为肿瘤的发生是分子事件,是一个涉及多基因、多分子水平变化的多阶段过程。本结果显示,在CHC中COX-2和Cyclin D1表达呈正相关。提示在CHC的发生发展、临床进展和转移的病理过程中,COX-2和Cyclin D1可能发挥着协同作用,共同参与了CHC的演化过程。因此,在临床病理活检中检测CHC中COX-2和Cyclin D1蛋白表达,从不同侧面更有助于深入了解肿瘤的发生发展,并可为诊断、预后判断和临床基因治疗提供重要依据。
[1] Sano H,Kawahito Y,Wilder RL,et al.Expression of cyclooxygenase-1 and -2 in human colorectal cancer〔J〕.Cancer Res,1995,55(12):3785.
[2] Cao Y,Prescott SM.Many actions of cyclooxygenase-2 in cellular dynamics and in cancer〔J〕.J Cell Physiol,2002,190(3):279.
[3] 邬黎青.大肠癌组织VEGF-C、COX-2、Fit-4及nm23表达与淋巴管生成及淋巴结转移的关系〔J〕.细胞与分子免疫学杂志,2012,26(6):5972.
[4] 张 蓉,高维娇,张 询,等.p53、COX2、CD44v6在早期宫颈鳞癌脉管瘤栓阳性、阴性中的表达及与预后的关系〔J〕.中华医学杂志,2009,89(47):3341.
[5] Kim H J,Lee KT,Kim EK,et al.Expression of cyclooxygenase-2 in cholangiocarcinoma correlation with clinicopathological featuers and prognosis〔J〕.J Gastroenterol Hepatol,2004,19(5):582.
[6] 谷化平,尚培中.COX2和Survivin蛋白表达与老年胃癌转移和预后的关系〔J〕.国际肿瘤学杂志,2012,39(5):387.
[7] 周 玮,魏海云,牛佳木.COX-2、CD4及CD8在胃癌组织中的表达及其意义〔J〕.实用癌症杂志,2012 27(3):250.
[8] Wu GS,Wang JH,Liu ZR,et al.Expression of cyclooxygenase-1and-2 in extra-hepatic cholangiocarcinoma〔J〕.Hepatobiliary Pancrest Dis Int,2002,1(3):429.
[9] Witzel II,Koh LF,Perkins ND.Regulation of cyclin D1 gene expression〔J〕.Biochem Soc Trans,2010,38(1):217.
[10] 王朝晖,张雪梅.大肠癌中转化生长因子βⅡ型受体及细胞周期素D1表达关系的研究〔J〕.中国中西医结合消化杂志,2011,19(2):94.
[11] 陈干涛,陈干红,白少华,等.黏蛋白MUC1和Cyclin D1在胰腺癌组织中的表达意〔J〕.实用癌症杂志,2011,26(1):7.
[12] 刘三光,穆宏凌,边 伟,等.细胞周期素D1蛋白和mRNA在胆管癌中的表达意义〔J〕.中华实验外科杂志,2011,28(6):938.

