甘氨双唑钠对离体乏氧喉癌细胞放射增敏作用的实验研究
李 响 梁健刚 关 中 徐志坚 彭解人
喉癌是近年来发病率逐渐提高的1种头颈部常见的恶性肿瘤。放射治疗可保留喉功能,提高患者生存质量,在喉癌的综合治疗中起着重要的作用,但是肿瘤细胞的乏氧状态可导致放射耐受、放疗失败[1,2]。研究表明,乏氧不仅影响放疗效果,还是影响手术治疗[3]及某些化疗药物治疗效果[4]的不良因素。放射增敏法为解决乏氧耐受的1种重要方法,甘氨双唑钠是1种具有良好的放疗增敏效应且不良反应较低的放射增敏剂。临床研究表明其可提高头颈部肿瘤的疗效,但主要入选病例为鼻咽癌及口咽癌患者,尚无针对喉癌的基础研究及临床随机双盲试验研究。本研究观察甘氨双唑钠对离体乏氧人喉癌细胞株(Hep-2)的放射增敏作用,并初步探讨其放射增敏机制,以期为喉癌的临床放射增敏治疗提供基础研究资料。
1 材料与方法
1.1 材料与试剂
喉癌细胞株Hep-2购自中南大学中心实验室,放射增敏剂甘氨双唑钠(商品名希美纳)购自山东绿叶制药有限公司,99.99%氮气购自广州气体厂,培养基RPMI 1640购自GIBCO公司。德国西门子PRIMUS直线加速器。
1.2 细胞培养
喉癌细胞株Hep-2采用RPMI 1640培养液(含10%新生牛血清),置于25 cm2培养瓶中,于37℃、5%CO2恒温箱中培养。
1.3 乏氧细胞建立方法
实验组为乏氧照射组,对照组为常氧照射组。实验组选择处于对数生长期的喉癌细胞(Hep-2),向培养瓶内通入99.99%的高纯氮(流量0.5 L/min,时间45 min)进行乏氧,两组均予0 Gy、2 Gy、4 Gy、8 Gy、12 Gy、16 Gy照射剂量,分别单次照射后,接种6孔板,通过克隆形成试验,验证乏氧模型的建立。
1.4 照射方法
6MV直线加速器,照射剂量为200 cGy/min,X线照射,源皮距为100 cm,射野大小为20 cm×20 cm。
1.5 MTT法检测细胞增殖抑制及活性差异
实验组为加药乏氧照射组,并根据CMNa的不同浓度(0.1 mmol/L、0.5 mmol/L、1.0 mmol/L)分为3组;不加药单纯乏氧照射组为对照组。照射剂量为4 Gy、8 Gy。将处于对数生长期的细胞制备成单细胞悬液,接种于25 cm2培养瓶中,调整细胞数,使每瓶为5×105个。实验组及对照组均先进行乏氧,然后加入药物进行照射。照射后以每孔约2 000个细胞接种于96孔板,培养24 h 后应用酶标仪在490 nm处测定各孔吸光度OD值,计算肿瘤细胞抑制率。肿瘤细胞存活率(%)=(加药孔细胞OD值/对照孔细胞OD值)×100%。肿瘤细胞抑制率(%)=1-肿瘤细胞存活率。
1.6 克隆形成试验检测CMNa对乏氧Hep-2细胞的放射增敏作用
实验分组同1.5。按上述方法进行乏氧、加药及放射处理(0、2 、4 、8 、12 及16 Gy照射剂量)2 h后,分别梯度接种细胞于6孔板中,每组重复3次。7~10天后肉眼可见细胞克隆时,停止培养,结晶紫染色。光镜下观察,计数大于50个细胞的集落数。克隆接种率(PE)=(对照组克隆数/接种细胞数)×100%;存活分数(SF)=克隆数/(接种细胞数×PE) ;应用多靶单击模型S=1-(1-e-D/D0)n拟合剂量存活曲线,得出N、D0、Dq和SF2等放射生物学参数;根据D0、Dq值,按公式增敏比(SER)=单纯乏氧对照组D0/增敏乏氧实验组D0,计算CMNa的放射增敏比。
1.7 流式细胞仪检测细胞周期变化
将实验各组照射2 h后的细胞样品处理后,应用流式细胞仪进行细胞周期分析。
1.8 统计学处理
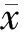
2 结果
2.1 乏氧细胞的建立
根据数据(表1),应用多靶单击模型S=1-(1-e-D/D0)n拟合剂量存活曲线,计算常氧状态D0为0.71,乏氧状态D0为1.88,氧增比OER为2.63,其值介于2.5~3.0时,认为达到乏氧条件。
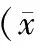
表1 乏氧组与常氧对照组克隆平均数±s)
2.2 MTT法检测细胞增殖抑制及活性的差异
MTT实验结果显示同一放射剂量下,乏氧细胞的OD值随甘氨双唑钠浓度的增高而减少,不同放射剂量下,细胞生长抑制曲线随剂量增大而增陡(表2)。由单因素方差分析得F4 Gy=19.6,F8 Gy=21.5,P4 Gy=0.023,P8 Gy=0.029,P<0.05,进一步经Dunnett-t检验,同一照射剂量下任意实验组与对照组在细胞生长情况上均具有统计学差异,初步判断甘氨双唑钠对离体乏氧细胞具有放射增敏作用。
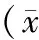
表2 4 Gy及8 Gy剂量照射后不同浓度甘氨双唑钠的放射增敏作用±s)
2.3 克隆形成试验检测CMNa的放射增敏作用
加入不同浓度CMNa的乏氧放射组和单纯乏氧放射组的细胞剂量存活曲线见图1,其SER、D0、Dq及SF2的值见表3。表明在不同放射剂量下,CMNa的SER值随浓度增大而增加,D0、Dq及SF2值随浓度增大而减小。
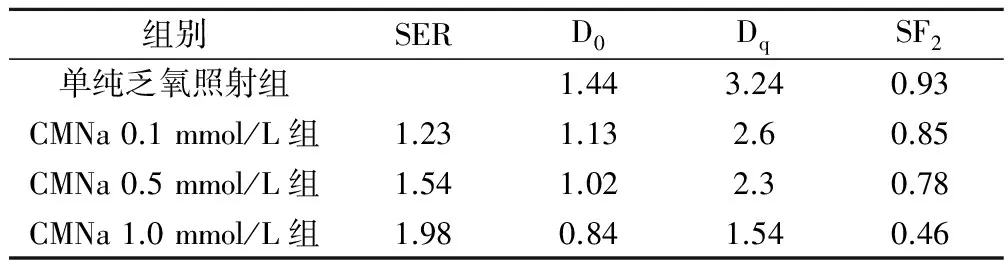
表3 不同浓度甘氨双唑钠放射增敏作用的放射生物学参数
2.4 CMNa联合放疗对乏氧Hep-2细胞周期的影响
流式细胞仪检测甘氨双唑钠作用于乏氧喉癌细胞后,检测细胞周期的改变见表4和图2。结果显示在同一剂量照射下,与单纯乏氧对照组比较,甘氨双唑钠作用于乏氧喉癌细胞后,使G2/M期细胞比例上升,G1/S期细胞比例下降。单因素方差分析及Dunnett-t检验结果显示:同一照射剂量、不同浓度甘氨双唑钠作用乏氧细胞后,G2/M期细胞比例呈上升趋势(F=4.41,P=0.004<0.05),G1/S期细胞比例呈下降趋势(F=7.93,P=0.012<0.05),呈浓度依赖性。
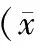
表4 不同照射剂量各组细胞周期的改变±s)
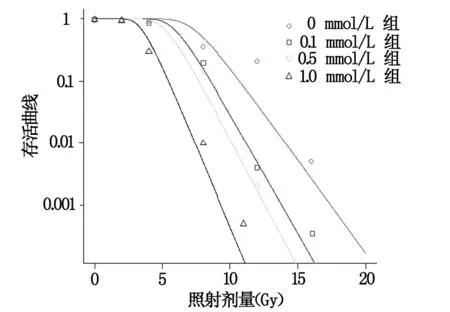
图1 各组照射后乏氧喉癌细胞生存曲线图
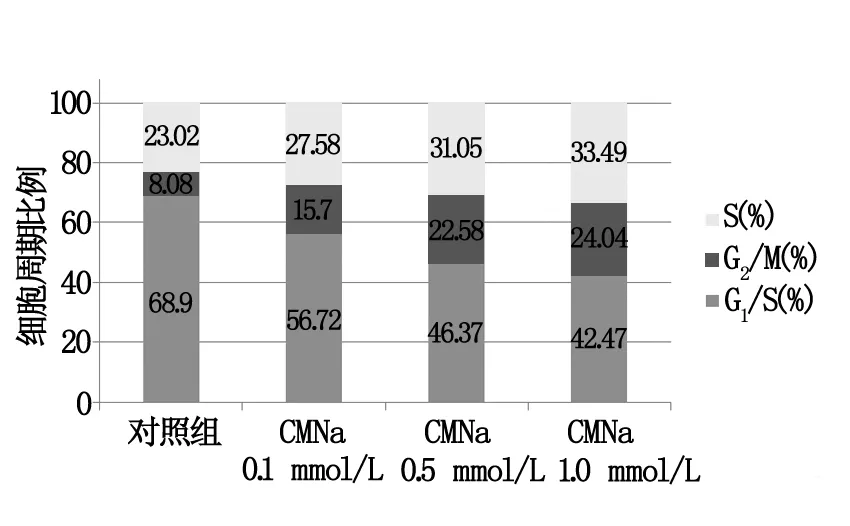
图2 4 Gy照射剂量下各组细胞周期的改变
3 讨论
喉癌作为1种对放射中度敏感的恶性实体肿瘤,肿瘤内存在相当一部分的乏氧细胞是其产生放射抗拒的主要原因[5,6]。甘氨双唑钠是1种新型的乏氧细胞增敏剂,但目前基础实验报道多为甘氨双唑钠对常氧状态下肿瘤细胞的影响[7],尚未对乏氧喉癌细胞的研究。临床研究报道中,Ⅰ、Ⅱ、Ⅲ期试验[8,9]表明甘氨双唑钠可提高头颈部肿瘤、食管癌[10]、肺癌的CR,但主要入选病例为鼻咽癌及口咽癌患者。因此,本实验探索CMNa对乏氧Hep细胞是否有放射增敏作用。
根据文献报道[11],CMNa对乏氧细胞的IC50分别为35.7 mmo1/L和23.50 mmo1/L,可采用 0.1~1.38 mmo1/L对离体细胞进行增敏。本实验选择CMNa浓度为0.1 mmo1/L、0.5 mmo1/L和1.0 mmo1/L,远小于IC50的低细胞毒性(20%IC50以下3~4个浓度)的有效浓度进行增敏试验。
乏氧方法目前已有专门的乏氧细胞培养箱,但受限于实验设备条件,本实验根据传统乏氧方法[12]进行乏氧并验证模型成立。
MTT实验结果显示,CMNa组存活率(OD值)均显著低于不加药的对照组,且随CMNa浓度的增加而下降,初步验证CMNa的放射增敏作用。但该方法具有一定局限性,即MTT结晶物形成的量与活细胞数成正比,但无法衡量肿瘤细胞的无限增殖活性。
克隆形成实验是评估照射杀伤效果的经典方法,照射之后能够形成克隆的被认为是有无限分裂能力的肿瘤细胞,可弥补MTT法的不足。克隆形成实验结果表明CMNa对离体乏氧喉癌细胞具有明显的放射增敏作用。在不同药物浓度下,CMNa的SER值随浓度增大而增加,D0、Dq及SF2值随浓度增大而减小,说明CMNa对乏氧细胞的放射增敏性随浓度增大而增强,放射抵抗性随浓度增大而减弱,呈浓度依赖关系。
在增敏机制方面,1963年Adams提出的“亲电子理论”指出放射增敏剂可使受放射损失的靶分子自由基不能重获电子而影响修复,增加射线对肿瘤细胞的原发性损伤。随着分子生物学的发展,更多的放射增敏机制被揭示出来,如通过分子靶向药物及细胞信号通路传导途径[13]、细胞周期调控[14]、促进凋亡[15]、抑制DNA双链断裂修复[16]等。
细胞周期调控理论指出处于细胞周期不同时相的细胞其放射敏感性具有很大差异。其中,G2/M期放射敏感性最高,G1/S期次之,S后期及G1期具有很强的放射抵抗性[17]。因此,促使肿瘤细胞由放射抵抗的G1/S期进入并阻滞在G2/M期,是提高肿瘤放射敏感性、改善放疗效果的重要途径。本实验发现甘氨双唑钠放射增敏机制除增加对DNA原发性损伤外,还与细胞周期调控有关。不同浓度甘氨双唑钠作用后,乏氧喉癌细胞G2/M期细胞比例有上升趋势,而G1/S期细胞比例具有下降趋势,统计分析表明甘氨双唑钠可以促进细胞进入并阻滞在放射敏感的G2/M期,具有统计学差异,呈剂量依赖关系。
综上所述,甘氨双唑钠对乏氧喉癌Hep-2肿瘤细胞具有放射增敏性,其机制可能与促进细胞进入放射敏感的G2/M期有关,但对于喉癌患者的放射增敏作用还有待专门针对喉癌的临床随机实验研究。
[1] Brizel DM,Dodge RK,Clough RW,et al.Oxygenation of head and neck cancer:changes during radiotherapy and impact on theatment outcome〔J〕.Radiother Oncol,1999,53(2):113.
[2] Nordsmark M,Bentzen SM,Rudat V,et al.Prognostic value of tumor oxygenation in 397 head and neck tumors after primary radiation therapy.An international multi-center study〔J〕.Radiother Oncol,2005,77(1):18.
[3] Janssen HL,Haustermans KM,Balm AJ,et al.Hypoxia in head and neck cancer:how much,how important〔J〕? Head Neck,2005,27(7):622.
[4] Sa AY,Ward TH,West CML,et al.Hypoxia in head and neck cancer〔J〕.Bri J Radio,2006,79:791.
[5] Brizel DM,Sibley GS,Prosnitz LR,et al.Tumor hypoxia adversely affects the prognosis of carcinoma of the head and neck〔J〕.Int J Radiat Oncol Biol Phys,1997,38(2):285.
[6] Rasey JS,Koh WJ,Evans ML,et al.Quantifying regional hypoxia in human tumors with positron emission tomography of [18F]fluoromisonidazole:a pretherapy stude of 37 patients〔J〕.Int J Radiat Oncol Biol Phys,1996,36(2):417.
[7] 冯 蕊,国晋菘,何津祥,等.甘氨双唑钠对Tca-8113细胞体外放射增敏及黏附作用的影响〔J〕.中国癌症杂志,2011,21(1):17.
[8] 付良青,郭军华,高洪志,等.肿瘤放疗增敏药甘氨双唑钠(CMNa)的Ⅰ期临床药代动力学研究〔J〕.中国临床药理学杂志,2000,16(5):187.
[9] 申 戈,鲍云华.针剂甘氨双唑钠放射治疗增敏的随机双盲II期临床试验〔J〕.中华放射肿瘤学杂志,2003,12(4):254.
[10] 赵 军,牟妍舒.甘胺双唑钠配合放射治疗食管癌的近期疗效观察〔J〕.实用癌症杂志,2007,22(2):207.
[11] Henk JM,Bishop K,Shepherd SF.Treatment of head and neck cancer with CHART and nimorazole:phase Ⅱ study〔J〕.Radiother Oncol,2003,66(1):65.
[12] 郑秀龙,高建国,张 洪,等.甘氨双唑钠对离体V79细胞的放射增敏作用〔J〕.辐射研究与辐射工艺学报,1995,13(4):213.
[13] Fokas E,Yoshimura M,Prevo R,et al.NVP-BEZ235 and NVP-BGT226 dual phosphatidylinositol 3-kinase/Mammalian target of rapamycin inhibitors enhance tumor and endothelial cell radiosensitivity〔J〕.Radiat Oncol,2012,7(1):48.
[14] Mohapatra S,Kawahara M,Khan IS,et al.Restoration of G1chemo/radioresistance and double-strand-break repair proficiency by wild-type but not endonuclease-deficient Artemis〔J〕.Nucleic Acids Res,2011,39(15):6500.
[15] Nair S,Ram RR,Srinivas P,et al.Radiosensitizing effects of plumbagin in cervical cancer cells is through modulation of apoptotic pathway〔J〕.Mol Carcinoq,2008,47(1):22.
[16] Takaqi M,Sakata K,Someya M,et al.Gimeracil sensitizes cells to radiation via inhibition of homologous recombination〔J〕.Radiother Oncol,2010,96(2):259.
[17] Williams JR,Zhang Y,Zhou H,et al.Little,genotypedependent radiosensitivity:clonogenic survival,apoptosis and cellcycle redistribution〔J〕.Int J Radiat Biol,2008,84:151.

