江汉平原地区初治鼻咽癌患者调强适形放疗的疗效及预后因素分析
杜 伟 杨继元 徐云华 雷 勇 黄 敏 柯庆华 罗 斐 李晶晶 罗海峰
鼻咽癌是头颈部常见的恶性肿瘤之一,在我国尤其在南方发病率较高,占头颈部肿瘤的78.1%。根治性放射治疗是鼻咽癌最有效的治疗手段,早期病变局部控制率可达到70%~90%,T3~T4期者为50%,5年总生存率在40%~70%[1]。鼻咽癌行放疗时,因鼻咽部解剖复杂,周围正常组织或危重器官不可避免的受到照射,随着计算机技术的提高,调强适形放疗(IMRT)技术得到了较好的发展,从而提高肿瘤靶区的照射剂量同时能根据需要调节其剂量要求,尽量保护正常组织或危及器官。本文旨在分析应用调强适形放疗技术治疗江汉平原地区鼻咽癌患者的临床疗效。
1 资料与方法
1.1 临床资料
2008年8月~2011年3月我科收治85例鼻咽癌患者,均为江汉平原地区人群,均经鼻咽部活检确诊,男性63例,女性22例;≤60岁75例,>60岁10例;病理类型按WHO分为Ⅰ型10例,Ⅱ型71例,Ⅲ型4例;按鼻咽癌2008年分期标准:T1期 8例,T2期29例,T3期28例,T4期20例;N0期11例,N1期12例,N2期51例,N3期11 例;M0期84例,M1期1例;Ⅰ期2例,Ⅱ期8例,Ⅲ期46例,Ⅳ期29例。
1.2 观察指标
口腔黏膜急性反应、放疗野内皮肤急性反应、口干症,均按照RTOG/EORTC放射损伤分级标准评定。
1.3 治疗方法
1.3.1 治疗定位 患者均于治疗前行鼻咽部及颈部MRI扫描,CT增强扫描模拟定位,患者取仰卧位,双肩及头颈垫枕,用头颈肩热塑固定,三维激光标记3个同一层面参考点,进行薄层CT扫描3 mm,扫描体位与治疗体位相同(使用平板床),把扫描标记(直径1 mm的铅珠)黏贴于事先标记的3个参考点上(基本位于瘤体中心附近),采用螺旋CT行断层模式扫描,层距以3 mm薄层扫描,行CT增强,图像数据同步传到放疗计划系统工作站。
1.3.2 计划设计 患者CT定位图像经光缆输入VARIAN治疗计划系统,结合MRI图像勾画靶区及敏感器官,并依据国际放射单位与测量委员会50号报告确定肿瘤及瘤床靶体积概念,初治鼻咽癌靶区包括GTVnx(鼻咽癌原发灶肿瘤靶区)、GTVnd (转移淋巴结靶区)、CTV1(高危预防区域)、CTV2(低危预防区域)、PTV1及PTV2。T1~T2处方剂量为,PTVnx=GTVnd=69.96 Gy/33F,PTV1=60.96 Gy/33F,PTV2=50.96 Gy/28F;T3~T4处方剂量为,GTVnx=73.92 Gy/33F,PTVnx=GTVnd=69.96 Gy/33F,PTV1=60.96 Gy/33F,PTV2=50.96 Gy/28F;根据靶区剂量和敏感器官剂量以及可接受的范围,同时选择运算模式及治疗模式,系统将自动进行逆向设计运算。
1.3.3 治疗计划确认 根据处方剂量要求及危及器官的剂量限制,查看每一层面的剂量曲线图及DVH情况,选择最优的计划。
1.3.4 验证及复位 上述最佳三维放疗计划确定后,还需再次验证及复位,让患者重复定位CT扫描的体位及固定,在NOMOS系统扫描的三维假体计划层面上,随意抽出一个层面,与CT机扫描患者这一层面相比,如果完全吻合,则表明该计划及体位固定完美,如有误差则尚需调整,直到完全吻合为止。
1.3.5 治疗计划实施 计划验证达到要求,则开始摆位进行放疗,放疗过程中每周验证1次。
1.4 疗效评价标准
疗效评价按世界卫生组织(WHO)统一标准评定,放射治疗不良反应按美国肿瘤放射治疗协作组(RTOG)标准评定。
1.5 统计学方法
应用SPSS13.0软件,对相关生存率采用Kaplan-Meier法计算及单因素预后分析。
2 结果
2.1 随访情况
截止2011年12月,85例患者随诊时间为9~40个月,随访率达95.3%,其中单纯放疗6例,放化疗综合治疗79例,诱导化疗79例,同步化疗11例,辅助化疗51例。
2.2 生存分析
全组患者3年总生存率为94.9%,局部无复发控制率为92.4%,无远处转移生存率为92.4 %,无区域淋巴结转移生存率为96.2%;单因素分析肿瘤T分期与患者总生存率无关(χ2=7.487,P=0.058),N分期与总生存率有关(χ2=8.780,P=0.032),临床分期与总生存率有关(χ2=8.085,P=0.044),治疗方式与总生存率无关(χ2=1.827,P=0.176)(图1~图4),患者年龄及性别也与总生存率无关(χ2=0.320,P=0.572;χ2=0.608,P=0.436)。
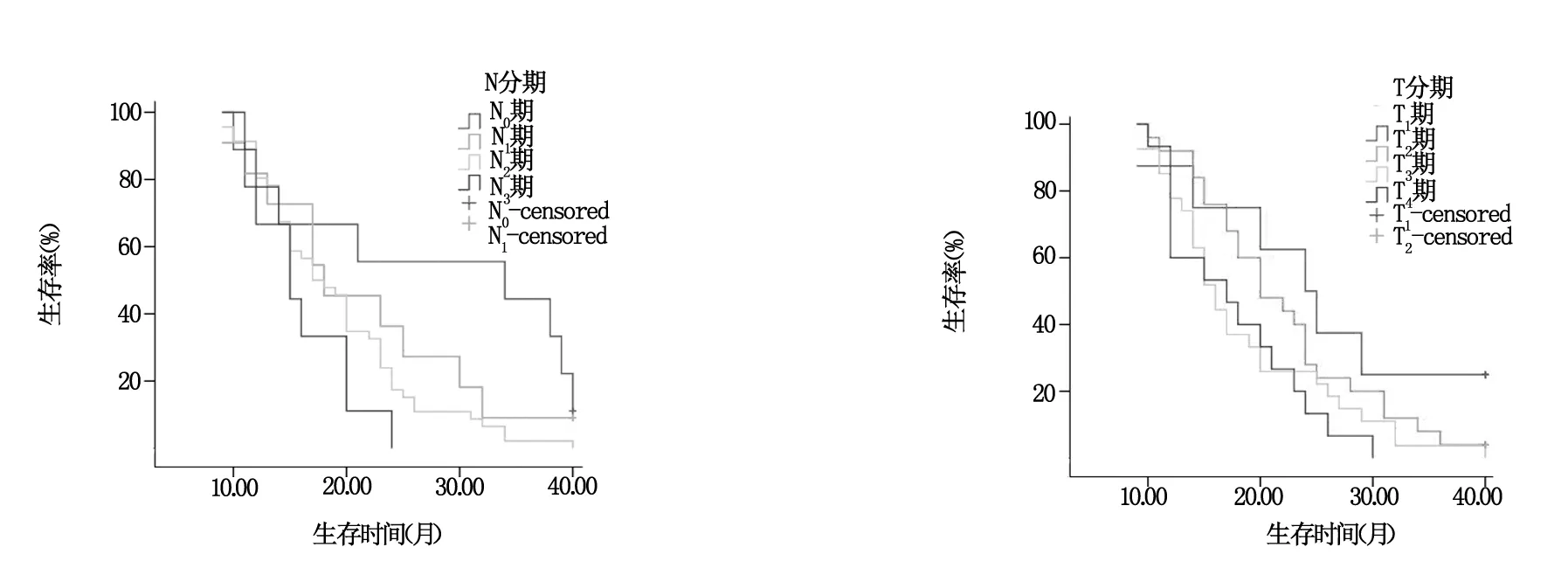
图1 N分期鼻咽癌患者生存曲线 图2 T分期鼻咽癌患者生存曲线

图3 不同临床分期鼻咽癌患者生存曲线 图4 单纯放疗与放化疗综合治疗鼻咽癌患者生存曲线
2.3 不良反应
皮肤反应:多为Ⅰ~Ⅱ度,Ⅰ度发生率为85.9%,Ⅱ度为12.9%,Ⅲ度为1.2%,未出现Ⅳ度皮肤反应或损伤。口腔黏膜反应:Ⅱ~Ⅲ度多见,Ⅰ度发生率为2.4%,Ⅱ度发生率为67.1%,Ⅲ度为30.6%,Ⅳ度未见。晚期不良反应:口干症多为Ⅰ~Ⅱ度口腔干燥,Ⅰ度发生率为91.8%,Ⅱ度发生率为8.2%,Ⅲ度未见。
3 讨论
鼻咽癌是头颈部常见的恶性肿瘤,鼻咽部位及解剖特殊,决定了放射治疗是鼻咽癌根治的主要治疗方法。常规放射治疗已应用了多年,为了提高治疗增益比,应采用新技术尽量提高肿瘤区域剂量同时要保护周围正常组织及危重器官。随着计算机技术的发展,调强适形放疗新技术也得到了较好的发展。这项技术已在我国较大的肿瘤治疗中心得到很好地应用,其疗效高于常规放疗而不良反应低于常规放疗。我院作为江汉平原地区三甲医院,每年有一定的鼻咽癌患者需要诊治,这些患者必须得到较好的规范治疗。我院于2008年开始开展调强适形放射治疗。
复习文献显示,IMRT与常规放疗相比,有较高的局部控制率和总生存率,并同时减轻了严重晚期不良反应。廖瑜露等[2]报告41例初治鼻咽癌患者经IMRT治疗后获得较好的临床疗效,并减轻了不良反应,很好地保护了唾液腺的功能。Kam 等[3]认为调强放疗较常规放疗降低了Ⅱ~Ⅳ度级口干发生率(39.3%v82.1%,P=0.01)。Lee等[4]报道68例鼻咽癌患者调强放疗2年局控率、区域控制率、局部区域控制率、无远处转移率分别为92.6%、90.8%、89.3%、84.7%,2年总生存率为80.2%,放疗1年后仅13.5%患者发生Ⅱ度口干。易俊林等[5]报道147例鼻咽癌患者调强放疗后3年局控率、总生存率、无病生存率、无远处转移生存率分别为93.2%、93.5%、72.6%、74.4%,放疗后仅5例出现了Ⅱ度口干和皮下组织纤维化。Xiao等[6]报道了81例局部晚期鼻咽癌患者行IMRT后,5年局控率为94.9%,无疾病生存率为76.7%,总生存率为74.5%,最常见晚期不良反应多为Ⅰ~Ⅱ度口干症、听力下降、皮下组织纤维化,未出现Ⅳ度不良反应。
Han 等[7]报道,调强放疗后3年局控率、区域控制率、无远处转移生存率、无疾病生存率及总生存率分别为94.3%、97.7%、86.1%、80.3%、89.1%,主要严重急性不良反应主要包括Ⅲ级口腔黏膜炎(6.5%),Ⅲ级皮肤放射反应(29.5%),IMRT后2年仅有7%出现Ⅱ级口腔干燥,未发现Ⅲ、Ⅳ级;多因素分析显示T分期对局控率和生存率无明显意义,而N分期是总生存率(P<0.001)、无远处转移生存率(P<0.001)、无疾病生存率(P=0.003)的重要预后因子;Ⅲ~Ⅳ期者同步化疗和辅助化疗未影响预后。Lin 等[8]报道370例局部区域晚期鼻咽癌患者序贯化疗结合IMRT治疗结果,3年局控率、区域控制率、MFS、DFS及OS 分别为95%、97%、86%、81%、89%;多因素分析结果显示年龄(<60,≥60)和N分期是OS的重要预后因素;而且N分期是MFS仅有的预后因子;T分期和同步化疗对局控率、区域控制率、MFS、DFS或OS 无明显影响;亚组分析显示同步化疗在局部区域晚期鼻咽癌患者IMRT中无明显获益。冯梅等[9]报道582例鼻咽癌患者调强放疗5年后局控率、区域控制率、无远处转移率、无瘤生存率、疾病特异生存率和总生存率分别为89.8%、95.2%、74.1%、69.6%、83.2%和77.1%;主要急慢性不良反应多为Ⅰ~Ⅱ度,多因素分析表明影响总生存率的独立预后因素有临床分期及N分期。
本组调强放疗后结果基本与文献报道的一致,治疗后3年总生存率为94.9% ,本组患者治疗中最影响患者的急性不良反应为口腔黏膜糜烂和溃疡,Ⅱ~Ⅲ度黏膜反应发生率较高为97.7%,考虑其原因为调强适形放疗为7~9野照射,虽然IMRT高剂量照射范围小但低剂量照射范围广,而常规放疗为两野对穿照射,有一部分口腔在照射范围之外,IMRT导致其口腔黏膜反应较常规放疗重。有几例出现Ⅲ度黏膜反应考虑与患者临床分期较晚及放疗前进行了诱导化疗有关,但经对症处理患者均完成了放疗计划。皮肤急性放疗反应多为Ⅰ~Ⅱ度,较常规放疗组反应轻,考虑为IMRT为多野多叶光栅旋转照射,不存在野间衔接,皮肤及其软组织不存在高剂量重叠区域。本组IMRT放疗口干多为Ⅰ~Ⅱ度,而常规放疗口干多为Ⅲ度,因IMRT患者有部分腮腺得到保护,保留了部分唾液分泌功能,在放疗结束后,随着时间变长,口干程度还得到了一定的恢复,均较放疗结束时好转。本组结果中单因素分析T分期与总生存率无明显关系,而N分期和临床分期与患者总生存率有关。放疗与化疗综合治疗对总生存率未显示明显获益。
总之,本地区初诊的鼻咽癌患者行调强适形放疗疗效较好,且不良反应轻患者能耐受,尤其在远期口干方面发生程度低,提高了患者的长期生存质量。
[1] 殷蔚伯,谷铣之,余子豪,等.肿瘤放射治疗学〔M〕.第4版.北京,中国协和医科大学出版社,2008:480~481.
[2] 廖瑜露,宋小敏,敖 帆,等.41例初治鼻咽癌调强放疗近期临床观察〔J〕.实用癌症杂志,2007,22(6):632.
[3] Kam MK,Leung SF,Zee B,et al.Prospective randomized s-tudy of intensity-modulated radiatherapy on salivary gland function in early-stage nasopharyngeal carcinoma patients〔J〕.J Clin Oncol,2007,25:4873.
[4] Lee N,Harris J,Garden AS,et al.Intensity-modulated radiation therapy with or without chemotherapy for nasopharyngeal carcinoma:radiation therapy oncology group phase II trial 0225〔J〕.J Clin Oncol,2009,27:3684.
[5] 易俊林,高 黎,徐国镇,等.147例鼻咽癌调强放疗结果分析〔J〕.中华放射肿瘤学杂志,2008,17:329.
[6] Xiao WW,Huang SW,Han F,et al.Local control,survival,and late toxicities of locally advanced nasopharyngeal carcinoma treated by simultaneous modulated accelerated radiotherapy combined with cisplatin cocurrent chemotherapy:long-term results of phase 2 study〔J〕.Cancer,2011,117(9):1874.
[7] Han L,Lin SJ,Pan JJ,et al.Prognostic factors of 305 nasopharyngeal carcinoma patients treated with intensity-modulated radiotherapy〔J〕.Chin J Cancer,2010,29:145.
[8] Lin S,Lu JJ,Han J,et al.Sequential chemotherapy and IMRT in management of locoregionally advanced nasopharyngeal carcinoma:experience of 370 consecutive cases〔J〕.BMC Cancer,2010 ,10:39.
[9] 冯 梅,范子煊,黎 杰,等.582例鼻咽癌调强放疗5年远期疗效及预后分析〔J〕.中华放射肿瘤学杂志,2011,20(5):369.

