抗肿瘤光敏剂的研究进展
蔡良知(综述),黄明东,陈 卓(审校)
2.中国科学院 福建物质结构研究所结构化学国家重点实验室、中丹肿瘤与蛋白水解酶研究中心,福州350002;
3.中国科学院 研究生院,北京 100049
光动力学疗法(Photodynamic therapy,PDT)是目前最具前途的非侵入性治疗恶性肿瘤的方法之一。该疗法主要通过光敏剂在特定波长光源的激发下发生光动力学反应,产生单线态氧而发挥其破坏肿瘤细胞的作用。与传统的三大肿瘤治疗手段(手术、放疗和化疗)不同,PDT对靶组织及损伤程度均具有选择性,从而减少了对正常组织的损伤。目前,继美国之后,日本、荷兰和加拿大等国的卫生部门已相继确认了这一肿瘤新疗法的合法性,尤其是近年来随着一些光敏剂、光激活装置以及导光系统的发展,PDT在肿瘤方面的治疗应用愈加受到人们关注[1-2]。
PDT的两个关键因素是光敏剂和与之相匹配的特定波长的照射光。光敏剂的光动力活性、光吸收特性及其靶向特性,决定了其临床的可用性和适用范围。照射光的波长必须与光敏剂相匹配才能产生强烈的光动力效应,而且,照射光输出的稳定性和投照的可靠性也是决定PDT治疗效果的重要可控因素。因此,光动力效应是否可用于疾病治疗有两个前提条件:一是特定病变组织对光敏剂的摄取和存留;二是靶部位较易受到光的照射。通常,实体恶性肿瘤、某些癌前病变及一些良性病变可较多摄取和存留光敏剂,只要这些病灶处于激光光纤的照射范围,光动力效应就能发挥其治疗功效。
关于PDT的作用机制,目前普遍认为PDT所致细胞死亡涉及细胞凋亡(apoptosis)、坏死(necrosis)和自噬(autophagic cell death),其中凋亡被认为是其导致细胞死亡的主要途径[3-4]。通常认为,细胞凋亡的发生受凋亡相关基因的调控,但研究者发现,PDT导致细胞死亡不在染色体水平,而是在亚细胞水平,如细胞膜、线粒体等。因此,光动力效应对分子基因的影响是否存在尚有争议。此外,PDT还可直接或间接诱发一系列免疫应答反应[5],由此带来的生物效应及抗肿瘤作用也是其研究的一个重要课题。
光敏剂的选择与使用是PDT的核心问题。在光敏剂的发展过程中,迄今只有少数几种光敏剂得到官方批准。笔者对近年来光敏剂在抗肿瘤应用中的研究进展进行归纳和总结,旨在为研发更稳定且更具有靶向性的抗肿瘤光敏剂分子提供理论依据。
1 第一代光敏剂
最早用于PDT的光敏剂是HpD,其有效成分主要是双血卟啉醚或酯(Dihaematoporphyrin ethers and esters,DHE)。HpD经精制、提纯后的产物光敏素Ⅱ(PhotofrinⅡ,化学结构见图1)中DHE等有效成分的含量在80%以上。光敏素Ⅱ在人体内的半衰期高达100h以上,在最大的肿瘤与正常组织的浓度比出现在给药后24~72h。1993年,光敏素Ⅱ由加拿大QLT公司(Quadra Logic Technologies Phototherapeutics Inc)正式投产,商品名为卟非姆钠(Porfimer Sodium),1994-1997年该药先后在美国、加拿大、法国、日本、荷兰、意大利、西班牙和德国等国注册上市。这是迄今为止唯一获准在临床上正式用于多种实体恶性肿瘤治疗的光敏药物。我国曾在1980年代先后研制成功3种临床试用的混合卟啉制剂:癌卟啉(HpD,北京)、癌光啉(PsD-007,上海)和光卟啉(HpD,扬州)。北京HpD(商品名为血卟啉钠)中DHE等有效成分的含量在25%左右;癌光啉制剂中光敏活性成分包括血卟啉单甲醚(hematoporphyrin monomethyl ether,HMME)、甲氧基乙基乙烯基次卟啉和血卟啉二甲醚等,含量在80%以上,与卟非姆钠近似。
上述这些以HpD为代表的混合卟啉类光敏剂均属于第一代光敏剂,它们在临床上虽疗效肯定,但有许多不足之处:组分复杂,各成分在PDT中的作用至今不明确;对肿瘤的组织选择性和光动力学活性的稳定性较差;易引起皮肤光过敏反应,需要的避光时间长;其最大吸收波长(380~420nm)不在对人体组织透过率较佳的红外波长区(650~750 nm),治疗深度仅0.5cm,对大而深的肿瘤疗效不理想。
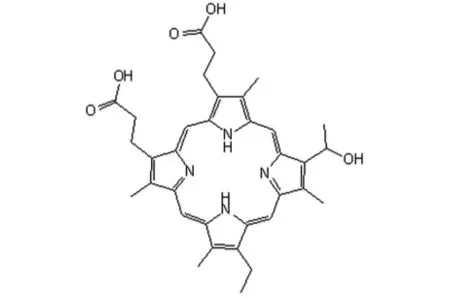
图1 PhotofrinⅡ化学结构示意图Fig 1 Chemical structure diagram of PhotofrinⅡ
2 第二代光敏剂
第二代光敏剂大多是卟啉类化合物的衍生物,包括卟啉、卟吩、红紫素、内源性卟啉,以及金属酞菁、稠环醌类化合物等,它们在光动力活性、吸收光谱和对组织的选择性方面均比第一代光敏剂有了很大改进[6]。目前有些第二代光敏剂已进入临床实验,其商品化和临床应用前景较为乐观。
2.1 血卟啉单甲醚(HMME) HMME是我国首创的一种单体卟啉,具有成分单一、结构稳定明确、肿瘤摄取率高、对体内外癌细胞具明显杀伤作用且药物消除较快、毒副反应小等优点[7],其化学结构见图2。它对消化道恶性肿瘤疗效较好,对移植静脉内膜增生也有抑制作用,可用于延缓静脉桥再狭窄进程。此外,HMME可在巨噬细胞内聚集,其介导的PDT可诱导巨噬细胞凋亡[8]。有证据表明,HMME的光动力效应是其对线粒体跨膜电位和钙离子通道的干扰所致[9]。
2.2 氢化卟啉 氢化卟啉因其卟啉双键的释放使其在红光区的吸收系数增高,适于对组织具有较强穿透性的光源。较具代表性的光敏剂间-四羟基二氢卟吩(m-THPC,化学结构见图3)所介导的PDT可用于恶性间皮瘤和复发乳癌的治疗:其单线态氧产率高,在652nm和514nm的光敏化杀伤作用分别是HpD及PhotofrinⅡ的100倍和10倍;对肿瘤选择性高,经肿瘤组织选择性摄取后,浓度可达正常组织的14倍;在体内代谢快、副作用小,皮肤光敏性低,只需避光10d左右。
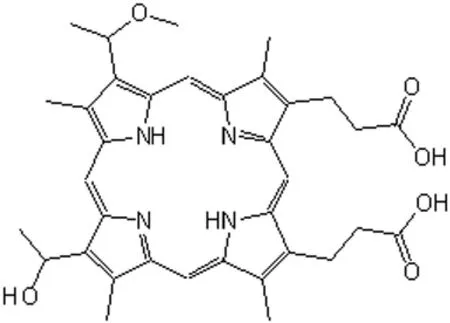
图2 血卟啉单甲醚化学结构示意图Fig 2 Chemical structure diagram of hematoporphyrin monomethyl ether(HMME)

图3 间-四羟基二氢卟吩化学结构示意图Fig 3 Chemical structure diagram of meta-tetra-(m-hydroxyphenyl)chlorin(m-THPC)
2.3 酞菁类 酞菁类光敏剂(化学结构见图4)被认为是目前最具潜力的第二代光敏剂之一。酞菁的组成结构与血卟啉相似,其最大吸收波长位于易透过人体组织的红外区域,具有良好的光催化、光敏化性能[10-14];对波长400~600nm 的光没有强吸收,故其皮肤光敏反应小;经体内注射给药后1~3h即可在肿瘤组织中达高峰,产生光动力学作用快。
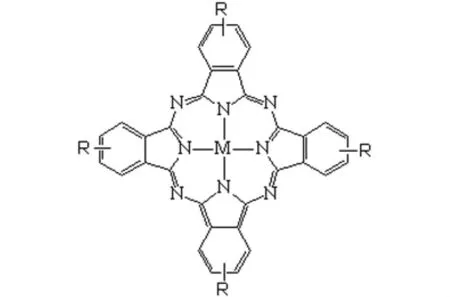
图4 酞菁类光敏剂化学结构示意图Fig 4 Chemical structure diagram of phthalocyanine photosensitizers
2.4 叶绿素降解衍生物 叶绿素(化学结构见图5)降解衍生物包括二氢卟吩e6(chlorin e6)、二氢卟吩e4(chlorin e4)、二氢卟吩P6(chlorin P6)、脱镁叶绿酸a(pheophorbide a)、紫红素-18(purpurin-18)等及其衍生物。其中,二氢卟吩e6衍生物单天 冬 氨 酸 酰 胺基二氢 卟 吩 (mono-L-aspartyl chlorine e6,NPe6)对肺部浅表鳞状细胞癌疗效显著,现已进入二期临床试用:最大吸收波长664nm处的吸收系数是HpD的10倍;在体内存留时间短,清除快,几乎不引起皮肤光敏反应。二氢卟吩P6具有良好的溶解度和单线态氧产率,在非极性溶剂中的最大吸收波长为674nm,比二氢卟吩e6作为PDT光敏剂更具优异性。此外,多在650~670nm处有强吸收峰的紫红素家族,包括初红紫素(ET2)、八乙基红紫素(NT2)等,由于紫红素不溶于水,常以脂制体、油乳剂或其它包裹复合物的形式存在。紫红素-18具有理想的可见光695nm吸收波长以及高单线态氧产率,对深处肿瘤组织独具优势。目前认为,其主要通过与DNA结合而发挥抗肿瘤疗效。

图5 叶绿素化学结构示意图Fig 5 Chemical structure diagram of chlorophyll
2.5 苯并卟啉衍生物(benzoporphyrin derivative,BpD) BpD既有与HpD相似的卟啉母核,又有与二氢卟吩类似的红光区高吸收系数,因此,被认为是PDT抗肿瘤较理想的光敏剂之一。BpD单酸环A (benzoporphrin derivative monoacid ring A,BpD-MA)于2000年被美国食品与药物管理局(FDA)批准试用于肿瘤和视网膜黄斑变性的临床治疗,是目前唯一被批准应用于临床的第二代光敏剂,其化学结构见图6。BpD-MA具有较高的三线态氧产率(φr=0.68)和单线态氧产率(φΔ=0.78),对肿瘤细胞及异常增生细胞具有较强的杀伤作用;其最大吸收峰在690nm,可用于治疗人体内位置较深且较大的肿瘤组织;在靶组织处能快速集中,药物进入体内5min后即可进行光照,而不象用HpD那样要有2d等待时间;在正常组织处能被快速清除等优点。但是,BpD-MA是源自天然产物的半合成产物,合成过程较复杂,总体产率低,故原料合成的成本高,同时其成品药物Verteporfin的制剂成本也很高,极大限制了其临床应用。目前该药还未在我国注册上市。

图6 苯并卟啉衍生物单酸环A化学结构示意图Fig 6 Chemical structure diagram of benzoporphrin derivative monoacid ring A
2.6 5-氨基酮戊酸 5-氨基酮戊酸(5-aminolevulinic acid,5-ALA)是一种内源性光敏剂,是甘氨酸合成原卟啉Ⅸ(ProtoporphyrinⅨ,PpⅨ)进而转化成亚铁血红素过程中的一种中间产物,其化学结构见图7。PpⅨ是细胞的正常成份,毒性低、代谢快,在很多肿瘤细胞内选择性聚集,在胃肠道肿瘤内比周围组织浓度高8~15倍,在皮肤乳腺肿瘤内比周围正常组织高10倍左右。5-ALA的最佳激发波长为635nm,自1990年试用于临床以来,治疗皮肤癌、食管癌、胃肠道肿、膀胱癌及肺癌的效果得到了肯定。
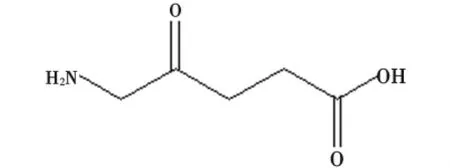
图7 5-ALA化学结构示意图Fig 7 Chemical structure diagram of 5-aminolevulinic acid(5-ALA)
2.7 竹红菌素 竹红菌素(Hypocrellin,化学结构见图8)分为竹红菌素甲素、竹红菌乙素和竹红菌丙素,是从我国云南的一种箭竹的竹果中提取出的天然产物。该类化合物光毒性强而暗毒性低,结构明确、分离纯化和结构修饰相对简单。目前,利用竹红菌素的母体分子合成的部分衍生物的理化特性和光动力效率已达到或优于国外最新光敏剂。

图8 竹红菌素化学结构示意图Fig 8 Chemical structure diagram of hypocrellin
2.8 二苯基卟吩 和上述提及的HMME、竹红菌素类一样,二苯基卟吩(Diphenyl-2,3-dihydroxychlorin,DPCOH)也是我国正在研发的具有独立知识产权的第二代光敏剂,其化学结构见图9。该卟吩类光敏剂具有较高的光动力活性(其光毒性是HpD的200倍以上)和单线态氧量子产率(ΦΔ=0.70)。
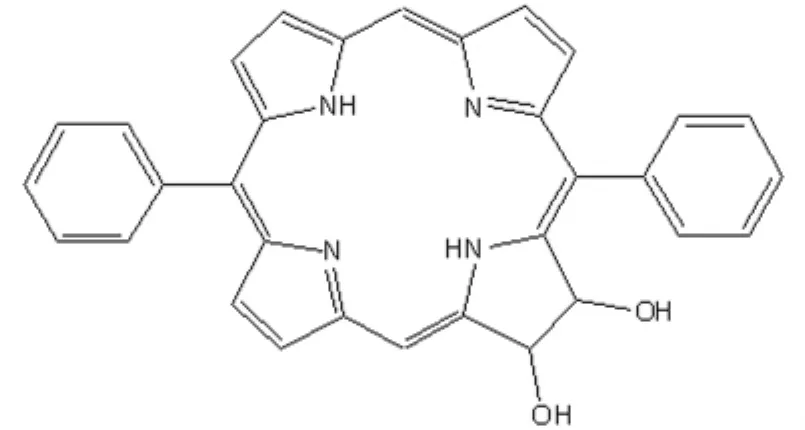
图9 二苯基卟吩的结构示意图Fig 9 Chemical structure diagram of diphenyl-2,3-dihydroxychlorin
3 第三代光敏剂
不论是临床医生还是化学家,大家都一致认为进入临床PDT的理想光敏剂应具备以下条件:化学纯品;暗毒性低而光毒性高;对靶细胞选择性高;长波长处吸收;在体内清除快;可通过多种途径输入体内等。目前,正在研发的第三代光敏剂主要是在卟啉类及其衍生物、叶绿素降解产物衍生物、以及酞菁类等第二代光敏剂的基础上,偶联具有靶向性的特殊化学物质(即靶向基团),以提高光敏剂对肿瘤组织的识别和靶向功能[5]。这些靶向基团包括多聚体(Polymers)、脂质体(Liposomes)、肿瘤组织表达的抗原或受体的相应抗体和配体等。近年来,多肽在众多靶向光敏剂中的应用研究十分活跃,这主要缘于其细胞毒性低,渗透性和选择性好,在合成和修饰方面相对简单,对一些在肿瘤组织中过量表达的受体具有靶向性等特点[14]。
关于多肽在光敏剂抗肿瘤应用研究方面的进展主要有以下3个方面。
3.1 带正电荷的透膜多肽 大部分肿瘤细胞表面带净负电荷,而赖氨酸和精氨酸因所含氨基酸在生理pH下带正电荷而易于富集在肿瘤细胞表面,并能穿过细胞膜进入肿瘤细胞。光敏剂所偶合多肽的带电量、性质、氨基酸序列、螯合金属离子的存在以及多肽链的C端(-OH或-NH2)等都是影响细胞摄取光敏剂的因素。Chen等报道,带有正电荷的五聚赖氨酸和酞菁锌的偶合物(Pentalysine beta-carbonyl phthalocyanine zinc,ZnPc-5K,化学结构见图10)在肿瘤细胞中的摄取及对肿瘤细胞的光毒性作用均比带负电荷的酞菁同类衍生物强(可高达20倍)[16];S180荷瘤小鼠的药代动力学研究也显示,ZnPc-5K具有一定的肿瘤靶向性。Li等合成了一系列含有不同数目赖氨酸的酞菁锌偶合物,通过对它们单线态氧的量子产率、细胞摄取率及光动力学效应等进行比较研究发现,带有正电荷的七聚赖氨酸和酞菁锌的偶合物因其良好的两亲性而具有最佳的抗肿瘤疗效[17]。

图10 酞菁锌与五聚赖氨酸偶合物的结构示意图Fig 10 Chemical structure diagram of ZnPc-5K
3.2 血管靶向多肽 大量血管生成是肿瘤的一大特点。目前,以血管为靶点的光敏剂主要是利用具有靶向性的多肽分子特异性结合到肿瘤组织的微血管上,从而使所偶联的光敏剂分子直接发挥其光动力学效应,造成血管封闭,进而导致肿瘤组织因缺乏营养而枯竭死亡。Tirand等报道,对内皮细胞受体具有专一性结合的七肽ATWLPPR与光敏剂TPC偶合后,尽管降低了该多肽与内皮细胞受体的亲和力,但偶合物在人体内皮细胞的摄取及其光动力活性均比未偶合多肽的光敏剂显著增强(增强倍数约分别为25倍和10倍)[18]。在对移植了神经胶质瘤细胞的裸鼠进行的相关药代动力学研究发现,静脉注射TPC-Ahx-ATWLPPR后,在不同器官中该偶合物的降解速率不同,且其主要代谢产物为TPC-Ahx-A,即体内降解主要发生在多肽部分。
3.3 细胞受体靶向多肽 某些特定序列的肽链对肿瘤细胞具有一定识别功能,将其作为侧基引入光敏剂分子后,可引导光敏剂的靶向给药。如αVβ3-整合素这种跨膜糖蛋白受体在许多肿瘤细胞或内皮细胞中过量表达,其配体三肽 RGD(H-Arg-Gly-Asp-OH)对某些肿瘤和肿瘤内皮细胞具有一定靶向作用。以叶酸受体(folate receptor,FR)为靶向的光敏剂脱镁叶绿酸 A-多肽-叶酸(Pyro-peptide-Folate,PPF)是通过靶向识别表达FR的肿瘤细胞而发挥抗肿瘤作用[19]。连接该光敏剂和叶酸的多肽(序列为GDEVDGSGK)提高了该偶合物的水溶性,也提高了药物分子靶向肿瘤细胞的输送效率。Xu等利用在某些肿瘤细胞表面存在过量表达的促性腺激素释放素(GnRH)受体,将光敏剂酞菁锌与GnRH类似物偶合后形成的ZnPc-GnRH偶合物(化学结构见图11)可产生理想的光动力学疗效,该实验结果也证实了在光敏剂上偶联生物分子不仅能增强光敏剂的水溶性,并且能有效地增加其对肿瘤细胞的选择性[20]。

图11 酞菁锌与促性腺激素释放素类似物的偶合物的结构示意图Fig 11 Chemical structure diagram of ZnPc-GnRH
此外,一些通过介导抗肿瘤药物的光敏剂也受到人们的关注,如4-对羟基苯卟啉(Zn2+)甲氰蝶呤衍生物,这是一个以具有多种生物效应并对肿瘤细胞有一定亲和作用的卟啉类光敏剂m-THPP为导向剂,与抗肿瘤药物甲氨蝶呤经化学偶联而成的化合物[21]。由于光敏剂本身具有在病变组织上选择性聚集的功能,在其发挥光动力疗效的同时加强对肿瘤的靶向性介导,使抗肿瘤药物更加有效到达肿瘤组织。这种治疗策略将有望从根本上改变现有抗肿瘤药物存在的不良反应严重、靶向性差、需配合手术治疗等现状。
4 展 望
近几十年来,PDT抗肿瘤光敏剂的研究开发取得了令人瞩目的成就,相信随着研究的深入,更稳定且更具有靶向性的抗肿瘤光敏剂分子将不断涌现。针对目前抗肿瘤光敏剂的研究现状,笔者认为:首先,目前国外卫生部门批准用于临床的光敏剂只有光敏素Ⅱ,在我国临床使用的除光敏素Ⅱ外,还有HpD和PsD-007,这些都属于第一代光敏剂,有诸多不足之处。建议尽快将一些光物理和光化学性能优良且具有良好光动力疗效的光敏剂如Npe6、BpD-MA等投入到临床应用中。第二,设计合成对肿瘤组织具有高识别功能的新一代光敏剂,如利用偶联多聚体、脂质体和抗体等提高光敏剂对肿瘤组织的亲和力,增强光敏剂的光敏效应并同时降低副作用。第三,设计合成偶联上抗肿瘤药物的光敏剂,利用光敏剂本身在病变组织的定向功能,介导抗肿瘤药物高效到达靶组织,发挥光敏剂与抗肿瘤药物的双重作用。第四,PDT在治疗肿瘤方面已取得一定成果,希望不久的将来PDT也能成为治疗非肿瘤疾病,如老年失明、冠心病、艾滋病、自身免疫系统疾病和白血病等顽疾的有效手段。
[1]Plaetzer K,Krammer B,Berlanda J,etal.Photophysics and photochemistry of photodynamic therapy:fundamental aspects[J].LasersinMedicalScience,2009,24:259-268.
[2]Robertson C A,Evans D H,Abrahamse H.Photodynamic therapy(PDT):a short review on cellular mechanisms and cancer research applications for PDT[J].JPhotochemPhotobiolB,2009,96:1-8.
[3]Zhou F,Xing D,Wu S,etal.Intravital imaging of tumor apoptosis with FRET probes during tumor therapy[J].MolImagingBiol,2010,12:63-70.
[4]Banihashemi B,Vlad R,Debeljevic B,etal.Ultrasound imaging of apoptosis in tumor response:novel preclinical monitoring of photodynamic therapy effects[J].CancerRes,2008,68:8590-8596.
[5]Garg A D,Nowis D,Golab J,etal.Photodynamic therapy:illuminating the road from cell death towards anti-tumour immunity[J].Apoptosis,2010,15:1050-1071.
[6]Josefsen L B,Boyle R W.Photodynamic therapy:novel thirdgeneration photosensitizers one step closer[J]?BritishJournalofPharmacology,2008,154:1-3.
[7]Pu Y,Chen W,Yu Z.Research progress of Hemoporfin-part one:preclinical study[J].PhotodiagnosisPhotodynTher,2012,9:180-185.
[8]Cheng J,Li Q,Liang H,etal.Hematoporphyrin monomethyl ether-mediated photodynamic effects on THP-1cell-derived macrophages[J].ChineseJournalofArteriosclerosis,2012:393-396.
[9]Jin H,Zhong X,Wang Z,etal.Sonodynamic effects of hematoporphyrin monomethyl ether on CNE-2cells detected by atomic force microscopy[J].JournalofCellularBiochemistry,2011,112:169-178.
[10]Vittar N B R,Awruch J,Azizuddin K,etal.Caspase-independent apoptosis,in human MCF-7c3breast cancer cells,following photodynamic therapy,with a novel water-soluble phthalocyanine[J].InternationalJournalofBiochemistry &CellBiology,2010,42:1123-1131.
[11]Machado A H A,Moraes K C M,Soares C P,etal.Cellular Changes after photodynamic therapy on HEp-2cells using the new ZnPcBr8phthalocyanine[J].PhotomedLaserSurg,2010,28:143-149.
[12]Lopez T,Ortiz E,Alvarez M,etal.Study of the stabilization of zinc phthalocyanine in sol-gel TiO2for photodynamic therapy applications[J].Nanomed-NanotechnolBiolMed,2010,6:777-785.
[13]Gupta S,Dwarakanath B S,Muralidhar K,etal.Non-monotonic changes in clonogenic cell survival induced by disulphonated aluminum phthalocyanine photodynamic treatment in a human glioma cell line[J].JournalofTranslationalMedicine,2010,8:1-14.
[14]Suchan A,Nackiewicz J,Hnatejko Z,etal.Spectral studies of zinc octacarboxyphthalocyanine aggregation[J].Dyesand Pigments,2009,80:239-244.
[15]Chen H,Chen J,Chen N,etal.Applications of peptide conjugated photosensitizers in photodynamic therapy[J].Prog BiochemBiophys,2009,36:1106-1113.
[16]Chen Z,Zhou S,Chen J,etal.Pentalysine beta-carbonylphthalocyanine zinc:an effective tumor-targeting photosensitizer for photodynamic therapy[J].Chemmedchem,2010,5:890-898.
[17]Li L,Luo Z,Chen Z,etal.Enhanced photodynamic efficacy of zinc phthalocyanine by conjugating to heptalysine[J].BioconjugChem,2012,23:2168-2172.
[18]Tirand L,Frochot C,Vanderesse R,etal.A peptide competing with VEGF165binding on neuropilin-1mediates targeting of a chlorin-type photosensitizer and potentiates its photodynamic activity in human endothelial cells[J].JControl Release,2006,111:153-164.
[19]Stefflova K,Chen J,Marotta D,etal.Photodynamic therapy agent with a built-in apoptosis sensor for evaluating its own therapeutic outcome in situ[J].JMedChem,2006,49:3850-3856.
[20]Xu P,Chen J,Chen Z,etal.Receptor-targeting phthalocyanine photosensitizer for improving antitumor photocytotoxicity[J].PloSone,2012,7:e37051.
[21]Yan X,Wu F,Lu L,etal.Studies on porphyrin mediated anticancer drug[J].ActaChimicaSinca,2003,61:721-723.

