生物土壤结皮对荒漠土壤线虫群落的影响
刘艳梅,李新荣,赵 昕,张 鹏,回 嵘
(1.天水师范学院生命科学与化学学院,天水 741001;2.中国科学院寒区旱区环境与工程研究所沙坡头沙漠试验研究站,兰州 730000)
生物土壤结皮(Biological Soil Crusts,BSCs)是由隐花植物如蓝藻、地衣、苔藓和土壤微生物,以及相关的其它生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,是干旱半干旱荒漠地表景观的重要组成之一[1-2]。在全世界范围内,干旱的荒漠地区约占整个陆地面积的40%[3]。在这些地区由于各种自然因素的限制,高等植物分布稀疏且单调,呈现斑块状分布格局,而这些植物群落斑块状的分布为生物土壤结皮的拓殖和覆盖提供了空间和适宜的生态位,使生物土壤结皮广泛分布于干旱的荒漠地区。已有的研究表明,生物土壤结皮不仅能够有效地固定沙面,减少风蚀和地面风沙活动,而且还可促进土壤发育和植被恢复,促进沙地的物质循环和能量流动,对固定流沙及土壤改良等均具有重要意义[4]。
线虫是土壤中最丰富的后生动物,广泛存在于各种生境,在土壤生态系统腐屑食物网中占有重要地位[5]。线虫不仅在维持土壤生态系统稳定,促进物质循环和能量流动等方面发挥着重要作用。同时,由于线虫具有生存和适应能力强,营养类群多样,对环境变化敏感,提取与鉴定比较简单,实验周期短等诸多优点。目前已被广泛用作揭示土壤污染状况和评价土壤环境质量的模式生物[6-7]。Belnap等报道了生物土壤结皮为土壤线虫的生存提供食物来源和适宜的居住场所[2]。Darby等研究表明:生物土壤结皮的发育阶段影响土壤线虫的群落,即相对于早期阶段的结皮,发育晚期的结皮下土壤线虫群落更成熟、更复杂[8]。近年来,关于生物土壤结皮与土壤生物之间的研究已引起了人们广泛的关注,但在结皮广泛分布的荒漠生态系统中关于生物土壤结皮与线虫之间的研究仅见少量报道。因此,在腾格里沙漠东南缘的植被固沙区研究生物土壤结皮对土壤线虫的影响来指示生物土壤结皮对土壤质量的影响,从而揭示生物土壤结皮在生态系统重建中的作用,为退化生态系统的恢复和管理提供一些参考依据。
1 材料与方法
1.1 试验区概况
中国科学院沙波头沙漠研究试验站地处宁夏中卫市境内,位于腾格里沙漠东南缘(37°32'N,105°02'E),是荒漠化草原向草原化荒漠的过渡地带,也是沙漠与绿洲的过渡区。该区海拔高度约为1339 m,格状新月形沙丘由西北向东南倾斜,呈阶梯状分布。受蒙古高气压的影响,寒冷、干燥、多西北风,年平均风速2.9 m/s,夏秋降雨集中,兼有大陆性气候和季风降雨的特点;该区平均气温为10.6℃,全年日照时数为3264 h,年均降水量仅为186 mm,年潜在蒸发量高达3000 mm。地下水埋深达80 m,不能为植物直接利用,降雨成为该区植物生长主要的水分来源。
为了确保包兰铁路沙坡头沙漠地段的畅通无阻,我国沙漠科学工作者于1956年相继建立了“以固为主,固阻结合”的植被固沙防护体系;首先在流动沙丘上垂直于主风的方向扎设阻沙栅栏,然后在阻沙栅栏扎设1 m2的麦草方格作为固沙屏障,在无灌溉条件下栽植柠条(Caragana korshinskii)、油蒿(Artemisia ordosica)、花棒(Hedysarum scoparium)、中间锦鸡儿(Caragana intermedia)、沙拐枣(Calligonum arborescens)和沙木蓼(Atraphaxis bracteata)等为主的旱生灌木,其株柜与行距分别为1 m×2 m与2 m×3 m。逐年实施,50多年来在铁路北侧和南侧建立了宽度分别为500 m与200 m的人工植被固沙带,该带全长约16 km。本研究所选样地位于铁路北侧1956、1964、1981和1991年的人工植被固沙区,该区样地和对照区土壤理化性状的详细描述见表 1[9]。
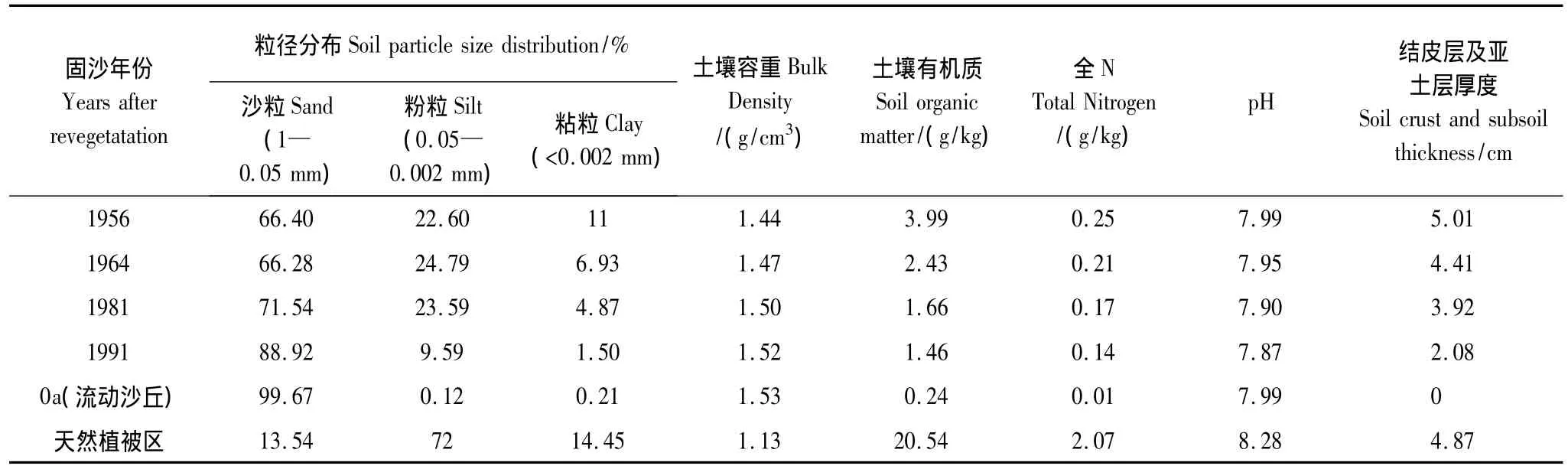
表1 人工植被固沙区、天然植被区和流沙区表层土壤理化性状详细描述Table 1 The description of physic-chemical properties of topsoil(depth 0—20 cm)in artificially stabilized sand dune areas,natural vegetation areas and mobile sand dune areas
1.2 试验方法
在2010年7月上旬,以1956、1964、1981和1991年建立的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,采集藻结皮和藓类结皮下0—10、10—20和20—30 cm的土壤样品,共采集结皮下土样72个和9个流沙对照,分别统计土样中线虫的种类与数量;在2011年4、7、9、12月分别采集人工植被固沙区藻结皮和藓类结皮下0—10、10—20和20—30 cm的土壤样品,以沙坡头地区的红卫天然植被区为参照,4次共采集土样114个,分析结皮下土壤线虫群落的季节变化。具体采样方法:每一植被区选择3个具有代表性的地段,面积为10 m×10 m,在每块样地内随机选取5个点,去除地表的凋落物层,然后用直径为4 cm土钻进行采样,同种结皮下相同土层的土壤组成一个混合土样,去掉土壤中可见植物根系和残体。将混合的土样用封口袋装好,带回实验室处理,每个处理3个重复。
将采集的每个土壤样品分别称取100 g,采用改良的Baermann漏斗法进行分离[10];每个样品在光学显微镜下进行线虫鉴定和统计,分类检索参见《中国土壤动物检索图鉴》[11]及《植物线虫志》[12]。依据土壤湿度,将土壤线虫数量折算成每100 g干土含有土壤线虫的条数。根据土壤线虫的头部形态学特征和取食生境,将土壤线虫分成4个营养类群:即食细菌线虫(Bacteriovores)、食真菌线虫(Fungivores)、植物寄生线虫(Plantparasites)及捕食-杂食性线虫(Omnivore-predators)[13-14]。
1.3 分析方法
线虫生态指数按以下公式进行计算:

式中,pi为第 i个分类单元中个体所占的比例[15];
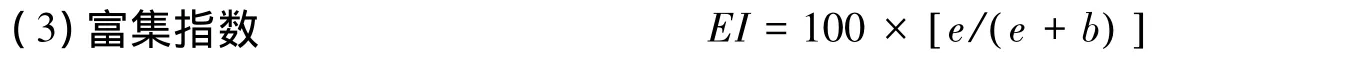
式中,b=∑kb×nb,b为食物网中的基础成分,主要指Ba2和Fu2这两个类群;e=∑ke×ne,e为食物网中的富集成分,主要指Ba1和Fu2这两个类群;kb和ke为各类群所对应的加权数;nb和ne则为各类群的丰度[16]。

式中,a=∑ka×na,a代表食物网中的结构成分,包括Ba3-Ba5,Fu3-Fu5,O3-O5和H2-H5类群(其中Ba,Fu,O和H各自代表食细菌、食真菌、杂食性和捕食性线虫);ka为各类群所对应的加权数;na为各类群的丰度。b=∑kb×nb,b为食物网中的基础成分,主要指Ba2和Fu2这两个类群[16]。
数据经Excel整理后,采用SPSS 16.0软件进行Duncan多重比较,显著性水平为0.05。方差分析用于分析生物土壤结皮、结皮类型和季节变化对土壤线虫群落的影响,Spearman相关性分析用于分析土壤线虫群落和固沙年限的相关关系。
2 结果与分析
2.1 生物土壤结皮对土壤线虫群落的影响
本研究对腾格里沙漠东南缘的人工植被固沙区藻结皮和藓类结皮下土壤线虫进行调查,共鉴定出28属,隶属2纲7目19科,包括食细菌线虫9属,其次为食真菌线虫共7属,再次为捕食-杂食性线虫和植物寄生线虫均为6属。藻结皮下土壤线虫共鉴定出20属,隶属2纲6目14科,包括食细菌线虫7属,其所占比例最大,占总数的53.46%;其次为食真菌线虫共4属,占总数27.08%,再次为捕食-杂食性线虫共6属,占总数18.44%;植物寄生线虫仅3属,其所占比例最小,占总数0.09%。藓类结皮下土壤线虫鉴定出24属,隶属2纲7目15科,包括食细菌线虫9属,所占比例最大,占总数的61.56%;其次为食真菌线虫共6属,占总数17.92%,再次为捕食-杂食性线虫共5属,占总数20.08%;植物寄生线虫仅4属,其所占比例最小,占总数0.43%。藻结皮和藓类结皮下土壤线虫的优势类群为丽突属(Acrobeles),拟丽突属(Acrobeloides),鹿角唇属(Cervidellus),滑刃属(Aphelenchoides)和穿咽属(Nygolaimus)。
由图1可以看出,藻结皮和藓类结皮下0—10、10—20和20—30 cm土层线虫多度的变化规律为,1956和1964年人工固沙区的两种结皮下土壤线虫多度最大,1981和1991年人工固沙区的两种结皮下土壤线虫多度次之,它们均与流沙对照差异显著(P<0.05)。因此,藻结皮和藓类结皮均对土壤线虫多度有显著影响,即结皮覆盖的土壤线虫多度显著高于流沙对照(P<0.05)。固沙年限与结皮下土壤线虫多度存在显著的正相关关系,其相关系数为r=0.963(P<0.05);而且,藻结皮和藓类结皮均可显著影响0—10、10—20和20—30 cm土层线虫多度,但随着土层的增加,土壤线虫的多度逐渐降低。

图1 两种结皮对土壤线虫多度(平均值±标准误)的影响Fig.1 Impact of two crusts on soil nematode abundances(mean±S.E)
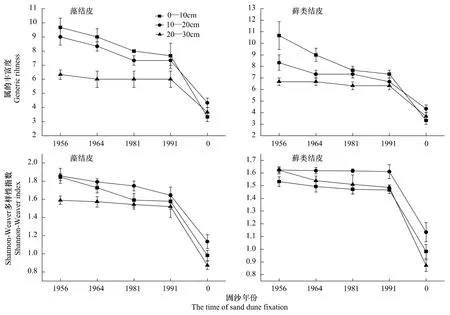
图2 两种结皮对土壤线虫属的丰富度和Shannon-Weaver多样性指数(平均值±标准误)的影响Fig.2 Impact of two crusts on generic richness and Shannon-Weaver index(H')of soil nematodes(mean±S.E)
由图2可以看出,藻结皮和藓类结皮下0—10、10—20和20—30cm土层线虫属的丰富度的变化规律为:1956和1964年人工固沙区的两种结皮下土壤线虫属的丰富度最大,1981和1991年人工固沙区的两种结皮下土壤线虫属的丰富度次之,它们均与流沙对照差异显著(P<0.05)。因此,藻结皮和藓类结皮均对土壤线虫属的丰富度有显著影响,即结皮覆盖的土壤线虫属的丰富度显著高于流沙对照(P<0.05)。固沙年限与结皮下土壤线虫属的丰富度存在显著的正相关关系,其相关系数为 r=0.936(P<0.05);而且,藻结皮和藓类结皮均可显著影响0—10、10—20和20—30 cm土层线虫属的丰富度,但随着土层的增加,土壤线虫属的丰富度逐渐降低。
由图2可以看出,藻结皮和藓类结皮下0—10、10—20和20—30 cm土层线虫Shannon-Weaver多样性指数的变化规律为:1956和1964年人工固沙区的两种结皮下土壤Shannon-Weaver多样性指数最大,1981和1991年人工固沙区的两种结皮下土壤线虫Shannon-Weaver多样性指数次之,它们均与流沙对照差异显著(P<0.05)。因此,藻结皮和藓类结皮均对土壤线虫Shannon-Weaver多样性有显著影响,即结皮覆盖的土壤线虫Shannon-Weaver多样性显著高于流沙对照(P<0.05)。固沙年限与结皮下土壤线虫Shannon-Weaver多样性存在显著的正相关关系,其相关系数为r=0.864(P<0.05)。
由表2可以看出,藻结皮和藓类结皮下0—10、10—20和20—30 cm土层线虫富集指数和结构指数的变化规律为:1956和1964年人工固沙区的两种结皮下土壤线虫富集指数和结构指数最大,1981和1991年人工固沙区的两种结皮下土壤线虫富集指数和结构指数次之,它们均大于流沙对照。无论是藻结皮还是藓类结皮均对土壤线虫富集指数和结构指数有明显影响,即结皮覆盖可提高土壤线虫富集指数和结构指数,它们均大于流沙对照,这说明人工植被固沙区生物土壤结皮的存在可提高土壤的健康状态。由图3可以看出,人工植被固沙区藻结皮和藓类结皮下土壤线虫的富集指数和结构指数虽高于流沙对照,但它们的值均小于50,位于Ⅳ区,表明目前该人工植被固沙区的土壤线虫受干扰程度高,土壤处于营养相对低的状况,土壤的恢复还需要更长的时间。固沙年限与结皮下土壤线虫的富集指数和结构指数存在显著的正相关关系,其相关系数分别是r=0.964 和 r=0.929(P<0.05)。
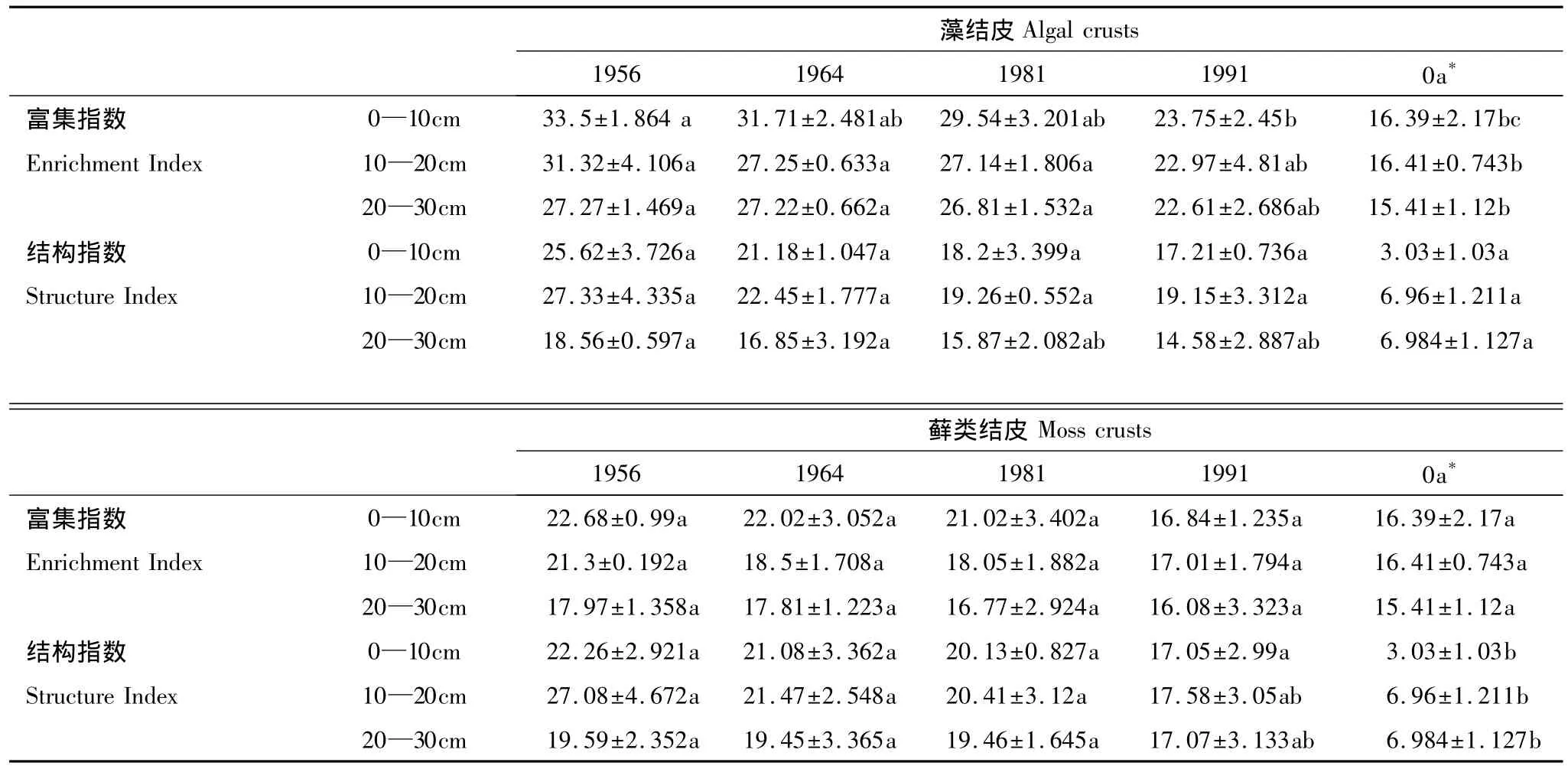
表2 两种结皮对土壤线虫结构指数(SI)与富集指数(EI)的影响Table 2 Impact of two crusts on structure index(SI)and enrichment index(EI)of soil nematodes(mean±S.E)
2.2 生物土壤结皮下土壤线虫群落季节动态的影响
由图4可以看出,天然植被区和人工植被固沙区藻结皮下0—10 cm土层线虫多度的季节变化规律为:秋季土壤线虫多度最高,分别为238.67个/100g和277.67个/100g,与冬季差异显著(P<0.05);夏季土壤线虫多度次之,分别为179.67个/100g和246.00个/100g,春季土壤线虫多度再次之,但它们之间差异不显著(P>0.05);冬季土壤线虫多度最低。同样,藻结皮下10—20和20—30 cm土层线虫多度的季节变化规律也基本类似,秋季土壤线虫多度最高,夏季次之,春季和冬季最低。因此,天然植被区和人工植被固沙区藻结皮下0—10、10—20和20—30 cm土层,土壤线虫多度存在明显的季节变化,基本表现为秋季>夏季>春季>冬季,冬季土壤线虫多度低于其它季节。
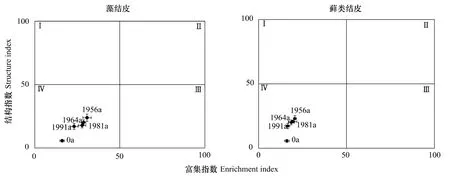
图3 人工植被固沙区两种结皮下土壤线虫的结构指数与富集指数Fig.3 The structure index(SI)and enrichment index(EI)of soil nematodes under two crusts in the artificially revegetated desert areas
由图4可见,天然植被区和人工植被固沙区藓类结皮下0—10 cm土层线虫多度的季节变化规律为:秋季土壤线虫多度最高,分别为341.67个/100g和1040.33个/100g,与春季和冬季差异显著(P<0.05);夏季土壤线虫多度次之,分别为298.67个/100g和774.33个/100g,与冬季差异显著(P<0.05);春季土壤线虫多度再次之,冬季土壤线虫多度最低。同样,藓类结皮下10—20和20—30 cm土层线虫多度变化规律也基本类似,秋季土壤线虫多度最高,与春季和冬季差异显著(P<0.05);夏季次之,春季再次之,冬季最低,但它们之间差异变小。因此,天然植被区和人工植被固沙区藓类结皮下0—10、10—20和20—30 cm土层,土壤线虫多度均存在季节变化,表现为秋季>夏季>春季>冬季,冬季的土壤线虫多度低于其它季节。
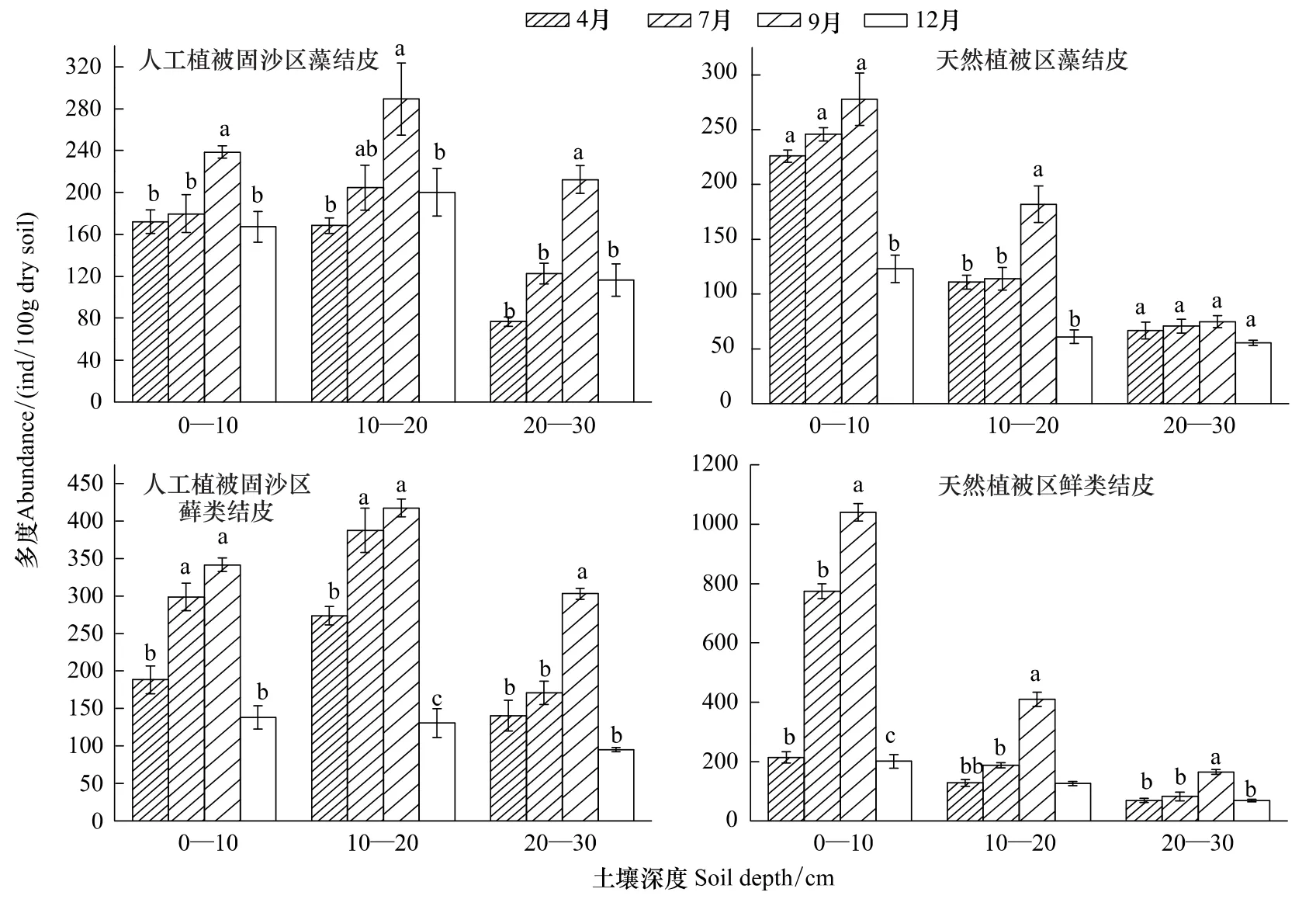
图4 两种结皮下土壤线虫多度(平均值±标准误)的季节变化Fig.4 Seasonal changes of soil nematode abundances(mean±S.E)under two crusts
可见,天然植被区和人工植被固沙区藓类结皮和藻结皮下土壤线虫多度均存在明显的季节变化,基本表现为秋季>夏季>春季>冬季。而且,土壤线虫多度的季节变化也受土壤深度的影响,表层土壤线虫多度季节变化明显,随着土层的加深这种季节变化趋势明显变弱。
3 讨论
大量的研究表明,土壤线虫可以指示重金属[14]、有机污染物[17]、农业措施及环境因子[18-19]等对土壤质量和土壤肥力及相应生态系统的影响。本研究表明,藻结皮和藓类结皮均对土壤线虫多度和属的丰富度有显著影响(P<0.05),指示沙区生物土壤结皮的存在可提高土壤质量,从而促进沙区生态系统的恢复。其主要的原因是生物土壤结皮的存在为线虫提供了重要的食物来源和适宜的生存环境。相对于藻结皮而言,藓类结皮下土壤线虫多度与属的丰富度更高,说明藓类结皮更有利于土壤线虫的生存,这个结论与Darby等的报道相一致[8]。主要的原因可能是,相对于演替早期的藻结皮,演替晚期的藓类结皮由于生长慢、结皮层较厚,能为土壤线虫提供更多、更丰富的食物来源、更适宜的土壤温度、更高的土壤湿度和有机质含量和更稳定的食物网结构。
相关分析结果显示,固沙年限与结皮下土壤线虫多度、属的丰富度、Shannon-Weaver多样性指数、富集指数和结构指数存在显著的正相关关系,也就是说,固沙年限越长,其上结皮形成的越早,结皮层越厚,其下土壤线虫数量越多、多样性程度越高、食物网越复杂,这表明,随着人工植被栽植年代的增加,线虫数量和多样性增加,食物网趋于复杂化发展,土壤趋于健康化发展。
研究表明,藻结皮和藓类结皮可显著增加土壤线虫多度、属的丰富度和多样性指数,但随着土层的加深,其影响逐渐减弱;这表明:随着土层的增加,线虫的数量、种类和多样性减少,食物网趋于简单化发展。其主要原因是,表层土壤线虫可从生物土壤结皮获得充足营养的同时,结皮的存在还改善了表层土壤的理化性质,这包括有机质含量的增加[2]、土壤养分含量和有效性[20]、土壤持水量的增加[21]、土壤稳定性的增加[22]、土壤pH值的改变[20]等等,这些都为线虫的生存提供了适宜的条件。
土壤线虫对季节变化的响应主要是由植被下形成的微环境中的温度、湿度、食物供应、种群内竞争以及捕食等综合作用所决定的[23]。水热不均是抑制线虫多度的重要因素。本研究表明:该植被固沙区藓类结皮和藻结皮下土壤线虫多度存在明显的季节变化,基本表现为秋季>夏季>春季>冬季,可能与该地区秋季温度和土壤含水量的特征相关联。外界环境因素影响结皮下土壤线虫是通过影响结皮性质而实现的。该地区,秋季降雨量丰富,温度适中,一方面促进了结皮的生长,其生物量、盖度、种类组成等相应的增加,为线虫的繁衍提供了充足的食物来源。另一方面,旺盛生长的结皮能很好的调控土壤温湿度等环境因子,改善土壤环境,为线虫的繁衍创造适宜的生存条件。夏季降雨量比较丰富,但温度偏高,结皮生长减缓,其生物量、盖度、种类组成等相对较低,结皮对土壤温湿度等环境因子的调节能力也有所降低,导致结皮下线虫多度减少。春季和冬季干旱少雨,温度低,对结皮的生长形成了双重抑制,导致结皮生物量、盖度、种类组成等急剧下降,降低了结皮对土壤环境因子的调节能力,最终导致线虫多度在春冬季的陡降。
4 结论
本研究对腾格里沙漠东南缘的人工植被固沙区藻结皮和藓类结皮下的土壤线虫进行调查,共鉴定出28属,隶属2纲7目19科。该区生物土壤结皮明显改善了土壤线虫群落,即增加了线虫多度和属的丰富度。而且,生物土壤结皮的存在也增加了土壤线虫Shannon-Weaver多样性指数(H')、富集指数(EI)和结构指数(SI)。相对于藻结皮而言,藓类结皮下土壤线虫多度与属的丰富度更高,这说明演替后期的藓类结皮比演替早期的藻结皮更有利于土壤线虫的生存。两种结皮下土壤线虫多度和属的丰富度均随着土层的增加而降低,其间接地说明了生物土壤结皮存在有益于浅层土壤线虫多样性的维持。此外,藻结皮和藓类结皮下土壤线虫多度也存在明显的季节变化,表现为秋季>夏季>春季>冬季,这种季节变化反映了生物土壤结皮的生物量、盖度和种类组成随季节变化而变化。因此,生物土壤结皮明显影响线虫群落,其主要的原因是生物土壤结皮的存在为土壤线虫创造了适宜的居住场所和重要的食物来源。
[1] West N E.Structure and function of microphytic soil crusts in wildland ecosystems of arid to semi-arid regions.Advances in ecological Research,1990,20:179-223.
[2] Belnap J,Lange O L.Biological Soil Crust:Structure,Function and Management.Berlin:Springer-Verlag,2003.
[3] Bowker M A,Belnap J,Davidson D W,Phillips S L.Evidence for micronutrient limitation of biological soil crusts:importance to arid-lands restoration.Ecological Applications,2005,15(6):1941-1951.
[4] Zhao H L,Guo Y R,Zhou R L,Zhao X Y.Effects of vegetation cover on physical and chemical properties of bio-crust and under-layer soil in Horqin Sand Land.Chinese Journal of Applied Ecology,2009,20(7):1657-1663.
[5] Xiao N W,Xie D Y,Wang X X,Yan C H,Hu L L,Li J S.Effect of oil exploitation on soil nematode communities in Daqing Oilfield.Acta Ecologica Sinica,2011,31(13):3736-3744.
[6] Yeates G W,Bongers T,de Goede R G M,Freckman D W,Georgieva S S.Feeding habits in soil nematode families and genera an outline for soil ecologists.Journal of Nematology,1993,25(3):315-331.
[7] Ling B,Xiao Q M,Ge F,Xiao N W,Liu X H.Composition and diversity of soil nematode community in Gaoligong mountains in Yunnan province.Journal of Hunan Agricultural University:Natural Sciences,2008,34(3):341-346.
[8] Darby B J,Neher D A,Belnap J.Soil nematode communities are ecologically more mature beneath late-than early-successional stage biological soil crusts.Applied Soil Ecology,2007,35(1):203-212.
[9] Li X R,He M Z,Duan Z H,Xiao H L,Jia X H.Recovery of topsoil physicochemical properties in revegetated sites in the sand-burial ecosystems of the Tengger Dersert,northern China.Gemorphology,2007,88(3/4):254-265.
[10] Carins E J.Methods in nematology//Sasser J N,Jenkins W R,eds.Nematology,Fundamentals and Recent Advances with Emphasis on Plant Parasitic and Soil Forms.Chapel Hill:University of North Carolina Press,1960:33-84.
[11] Yi W Y.Identification Manual for Soil Animal in China.Beijing:Science Press,1998.
[12] Liu W Z.Plant Nematode Sinica.Beijing:China Agriculture Press,2004.
[13] Yeates G W,King K L.Soil nematodes as indicators of the effect of management on grasslands in the New England Tablelands(NSW):Comparison of native and improved grasslands.Pedobiologia,1997,41:526-536.
[14] Shukurov N,Pen-Mouratov S,Steinberger Y.The influence of soil pollution on soil microbial biomass and nematode community structure in Navoiy Industrial Park,Uzbekistan.Environment International,2006,32(1):1-11.
[15] Shannon C E,Weaver W.The Mathematical Theory of Communication.Urbana:University of Illinois Press,1949:144-144.
[16] Ferris H,Bongers T,de Goede R G M.A framework for soil food web diagnostics:extension of the nematode faunal analysis concept.Applied Soil Ecology,2001,18(1):13-29.
[17] Wang K H,McSorley R,Kokalis-Burelle N.Effects of cover cropping,solarization,and soil fumigation on nematode communities.Plant and Soil,2006,286(1/2):229-243.
[18] Bakonyi G,Nagy P,Kovács-Láng E,Kovács E,Barabás S,Répási V,Seres A.Soil nematode community structure as affected by temperature and moisture in a temperate semiarid shrubland.Applied Soil Ecology,2007,37(1/2):31-40.
[19] Liang W J,Lou Y L,Li Q,Zhong S,Zhang X K,Wang J K.Nematode faunal response to long-term application of nitrogen fertilizer and organic manure in Northeast China.Soil Biology and Biochemistry,2009,41(5):883-890.
[20] Li X R,Zhang Y M,Zhao Y G.A study of biological soil crusts:recent development,trend and prospect.Advances in Earth Science,2009,24(1):11-24.
[21] Jia R L,Li X R,Liu L C,Gao Y H,Zhang X T.Responses of biological soil crusts to sand burial in a revegetated area of the Tengger Desert,northern China.Soil Biology and Biochemistry,2008,40(11):2827-2834.
[22] Patrick E.Researching crusting soils:themes,trends,recent developments and implications for managing soil and water resources in dry areas.Progress in Physical Geography,2002,26(3):442-461.
[23] Freckman D W,Baldwin J G.Nematode//Dindal D L,ed.Soil Biology Guide.New York:John Wiley and Sons Inc,1990:155-200.
参考文献:
[4] 赵哈林,郭轶瑞,周瑞莲,赵学勇.植被覆盖对科尔沁沙地土壤生物结皮及其下层土壤理化特性的影响.应用生态学报,2009,20(7):1657-1663.
[5] 肖能文,谢德燕,王学霞,闫春红,胡理乐,李俊生.大庆油田石油开采对土壤线虫群落的影响.生态学报,2011,31(13):3736-3744.
[7] 凌斌,肖启明,戈峰,肖能文,刘向辉.云南省高黎贡山土壤线虫群落结构及多样性.湖南农业大学学报:自然科学版,2008,34(3):341-346.
[11] 尹文英.中国土壤动物检索图鉴.北京:科学出版社,1998.
[12] 刘维志.植物线虫志.北京:中国农业出版社,2004.
[20] 李新荣,张元明,赵允格.生物土壤结皮研究:进展、前沿与展望.地球科学进展,2009,24(1):11-24.

