金刚石粉体对Ni电结晶初期行为的影响
王美娟,王日初,彭超群,冯 艳,张 纯
(中南大学 材料科学与工程学院,长沙 410083)
复合电镀是指向普通镀液中加入不溶性固体微粒,在镀液金属离子阴极还原时,将微粒包覆进入镀层的方法[1]。复合电镀作为一种制备具有良好耐磨性、耐腐蚀性和润滑性的金属基复合材料的新技术,因其操作简单、易于控制、生产成本低和原材料利用率高,受到研究者的广泛关注。由金刚石微粉与 Ni共同沉积所形成的复合镀层具有较优的耐磨性,可以制备多种钻磨工具,如线锯、砂轮、金刚石钻头、油石及金刚石滚轮等。复合电镀过程中的金属电结晶初始阶段,即晶体形核/生长,影响整个镀层的质量与性能,因此,分析粉体对金属电结晶形核/生长过程的影响,明确金属电结晶形核模型和生长机理,可以为生产实践提供重要的理论指导[2]。随着现代表面分析设备的发明,循环伏安(Cyclic voltammetry,CV)和恒电位阶跃(Chronoamperometry,CA)等电化学技术,隧道扫描电镜(Scanning tunneling microscope,STM)、电子扫描电镜(Scanning electronic microscope,SEM)和原子力显微镜(Atomic force microscope,AFM)等显微技术,均已应用于研究电沉积的初始阶段[3-5]。采用循环伏安和恒电位阶跃技术可以获得金属电结晶形核/生长过程的信息,且一系列理论公式已用于区分不同形核特征,如吸附原子的表面扩散或迁移、二维或三维形核模型等[6]。目前,国内外关于粉体对金属电结晶行为影响的研究主要集中在SiC[7]、Al2O3[8]和SiO2[9];对于金刚石粉体,在复合镀工艺方面已进行了大量研究[10-12],LEEA和 CHOI[13]仅通过极化曲线研究电流密度和搅拌速率对金刚石复合量的影响,而利用电化学测试手段研究金刚石粉体对Ni电结晶的影响尚未见报道。为此,本文作者采用开路电位、循环伏安和恒电位阶跃技术研究阴极表面金刚石粉体的吸附状态,比较 Ni-金刚石镀层与纯Ni镀层的Ni电结晶行为,利用扫描电镜观察 Ni-金刚石复合镀层的表面形貌,分析金刚石粉体对Ni电结晶形核/生长过程的影响。
1 实验
工作电极采用直径为 10 mm的不锈钢截面作为工作面,其余部分用环氧树脂固封,参比电极为 232型饱和甘汞电极,辅助电极为面积为4 cm2的光亮铂片。将研究电极的工作面依次经 400#、600#、800#、1 000#和1 200#砂纸打磨光亮后,放入10%NaOH(质量分数)溶液中超声除油,于二次蒸馏水中超声去酸,再放入 10%HCl(质量分数)溶液中超声去除氧化皮和锈蚀并活化金属表面,最后在二次蒸馏水中超声处理,超声处理时间均为2 min,风干待用。金刚石粉体(粒径为 40 μm)须进行预处理,步骤主要如下:在10%NaOH(质量分数)溶液中煮沸10 min除油后,用去离子水漂洗至中性,再在10%HNO3(质量分数)中煮沸10 min活化粉体表面,并用去离子水漂洗至中性,最后烘干。将含金刚石粉体的复合镀液在CJJ-6磁力搅拌机上搅拌12 h使之润湿,并在固定搅拌速度下进行电化学测试和电镀,使金刚石粉体充分悬浮在镀液中。Watts镀液组成为 280 g/L NiSO4、30 g/L H2BO3、15 g/L NiCl2和 50 g/L金刚石粉体,其中镀液的 pH值为3~3.5,镀液温度为(50±1)℃。采用CHI660C电化学工作站测量试样电极的开路电位和循环伏安曲线(扫描速度为-0.06 V/s)。根据测得的循环伏安曲线,选择电势在-0.75~ -1.14 V区间进行恒电位阶跃测量,阶跃步长为-0.03 V。将所得Ⅰ—t曲线转化为无因次曲线(Ⅰ/Ⅰmax)2—(t/tmax),根据 Scharifker-Hill模型进行拟合,比较Ni在Ni-金刚石复合镀液与纯Ni电镀液中的电结晶行为。采用Quanta-200环境扫描电镜观察Ni-金刚石镀层的表面形貌。
2 结果与讨论
2.1 金刚石粉体在Ni电结晶初期的吸附状态
图1所示为纯Ni镀液和Ni-金刚石复合镀液的开路电位。从图1可以看出,与纯Ni镀液相比,Ni-金刚石镀液的开路电位明显正移。根据双电层理论,由于金属电极表面的自身溶解和镀液中Ni2+、H+等阳离子的吸附,阴极表面带正电,镀液中大量阴离子受阳离子的特性吸附作用,富集在外Helmhotz面[14]。镀液中部分离子(如H+和Ni2+)等物理或化学吸附在粉体表面,使粉体表面处于带电状态[15]。在前期工作中,将金刚石粉体浸入镀液中搅拌24 h后发现镀液pH值增大,表明金刚石粉体吸附H+,LEEA和CHOI[13]发现金刚石粉体也吸附Ni2+。因此,在Ni-金刚石镀液中,带阳离子的金刚石粉体受电场作用力附着在阴极表面,影响双电层的电荷分布;金刚石粉体粘附在阴极表面,可能形成基体-金刚石“复合”电极,最终使复合镀液的开路电位较正。从图1还可以看出,随着时间的延长,Ni-金刚石复合镀液的开路电位逐渐负移,表明金刚石粉体在阴极表面受到同性电荷之间的静电力大于分子间力、憎水作用力、结构力、渗透力和化学力等吸引力[1],脱离阴极表面产生沉降;纯Ni镀液中的开路电位逐渐正移,可能是与 Ni溶解过程中所形成的中间产物羟基氧化镍等有关。

图1 纯Ni镀液和Ni-金刚石复合镀液的开路电位Fig.1 Open circuit potentials for pure Ni and Ni-diamond electroplating solutions
根据“两步吸附原理”,在微粒共沉积过程中,机械碰撞吸附和静电吸附同时存在,微粒停留在镀层,依次发生弱吸附与强吸附,当微粒弱吸附量达到一定值后,一小部分微粒将不可逆地处于强吸附状态,随后被嵌入镀层中[16]。图2所示为电镀10 s 后Ni-金刚石复合镀层的表面形貌。由图2可以看出,基质金属表面出现大量的黑色小坑(如箭头所示),表明金刚石粉体粒径较大,短时间内在阴极表面处于弱吸附状态,在金刚石粉体与镀液切向力的共同冲刷作用下,金刚石粉体脱离阴极表面并重新进入镀液中。

图2 电镀10 s后Ni-金刚石复合镀层的SEM像Fig.2 SEM image of Ni-diamond composite coating after electroplating for 10 s
2.2 循环伏安分析
图3所示为Ni在纯Ni镀液和Ni-金刚石复合镀液的循环伏安曲线,扫描速率为-0.06 V/s。从图3可以看出,当电位负于-0.85 V时,两曲线的阴极电流均显著增大,表明Ni开始在阴极表面形核/生长。同时,该起峰电位明显低于赵旭山[14]在 SO42-环境下计算得出的理论沉积电位(-0.538 V),可见,Ni在异质基体上形核需要一定的过电位。另外,Ni-金刚石镀液中 Ni的沉积电流在整个负向扫描过程中略低于纯Ni镀液中Ni的沉积电流,这可能是由于金刚石粉体吸附在阴极表面,减小了Ni2+的有效放电面积,从而阻碍电荷转移。从图3还可以看出,两曲线均表现为交叉曲线,表明在整个扫描过程中一直存在典型的形核过程[17]。正向扫描时,纯Ni镀液的曲线在-0.2~0.1 V区间内出现两个 Ni的溶解峰,这与曹经倩[18]的研究结果类似,表明纯Ni镀液中Ni的溶解分两步进行,即依次氧化为 Ni+和 Ni2+;Ni-金刚石镀液的曲线在-0.3 V左右出现一个Ni的溶解峰,可能是由于金刚石粉体促进Ni的溶解。
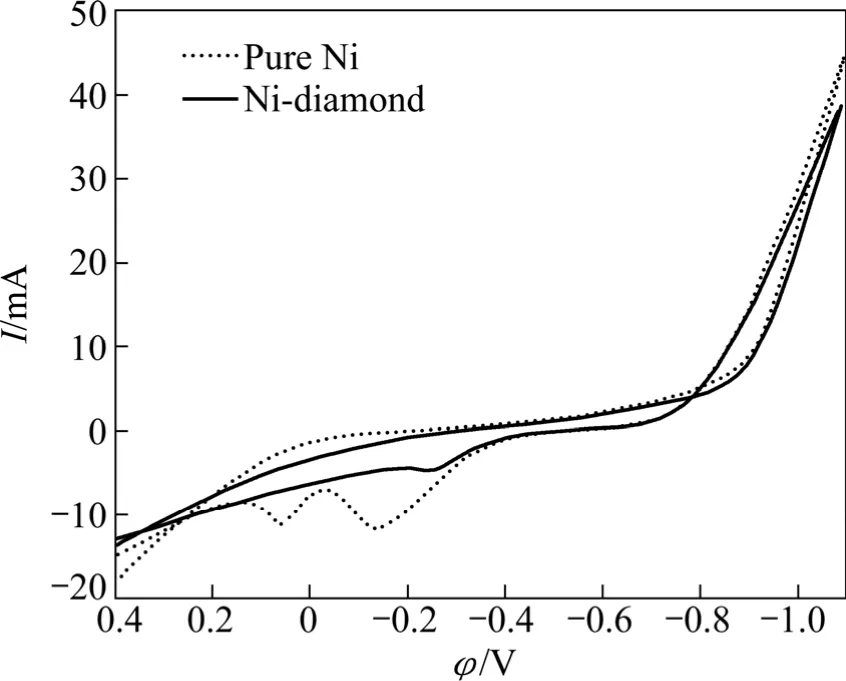
图3 纯Ni镀液和Ni-金刚石复合镀液中Ni电沉积循环伏安曲线Fig.3 Cyclic voltammetry curves of Ni in pure Ni and Ni-diamond electroplating solutions
2.3 电结晶特征
图4(a)和(b)所示分别为阶跃电位在-0.75~ -0.87 V和-0.93~ -1.02 V区间内纯Ni镀液Ni电沉积的暂电流—时间曲线。在电位为-0.75~ -0.87 V区间内,由于阴极双电层充电而使阴极暂态电流迅速下降,Ni电结晶形核/生长引起电流明显上升,如图4(a)所示。当阶跃电位负于-0.93 V时,暂态电流逐渐上升并达到最大值,如图4(b)所示,表明Ni在基体表面开始形核/生长,且形核区域不断扩大,该过程受Ni2+等离子向阴极表面迁移速率控制,随后电流衰减,此时表现为扩散控制。比较图4(b)中的不同阶跃电位可以看出,阶跃电位越负,峰值电流Ⅰmax越大,形核弛豫时间tmax越短,表明提高过电位可以提高形核速率,加快 Ni电沉积速度。
图4(c)和(d)所示分别为 Ni-金刚石复合镀液 Ni电沉积在不同阶跃电位下的暂态电流—时间曲线。从图4(c)可以看出,阶跃电位在-0.75~ -0.81 V区间内时,暂态电流—时间曲线呈先下降后明显上升的趋势,其过程依次发生阴极双电层充放电、Ni的形核/生长;当阶跃电位为-0.84V时,Ni开始形核/生长,暂态电流达到最大值,随后由于扩散过程引起电流衰减,与纯Ni镀液的形核电位(-0.93 V)相比,形核电位明显提前。与图4(b)比较,图4(d)呈现相同的规律,即阶跃电位越负,Ni电沉积越快。比较Ni-金刚石复合镀液和纯Ni镀液在相同阶跃电位区间(-0.93~ -1.02 V)内的形核弛豫时间tmax可以看出,Ni-金刚石复合镀液的Ni电沉积提前形成电流峰,表明金刚石粉体附着在阴极表面,为Ni电沉积提供合适的形核场所,使形核过电位降低,形核速率提高。这与赵旭山等[19]关于 SiC粉体对Ni电结晶行为影响的研究结果类似。

图4 两种镀液体系中Ni电沉积的暂态电流—时间曲线Fig.4 Instantaneous Ⅰ—t curves for electro-crystallization Ni in two electroplating solutions: (a), (b)Pure Ni; (c), (d)Ni-diamond composite
图5所示为 Ni-金刚石复合镀层在阴极电位为-1.0 V和不同电镀时间下的表面形貌。与图5(a)中其他区域的Ni电结晶形貌比较可知,箭头所指区域出现大量晶粒,这可能是由于有一小部分金刚石粉体暂时吸附在该区域,对Ni电结晶起促进形核作用,使该区域出现大量晶核。电镀 30 s后,大部分基体表面被Ni结晶层覆盖,晶核数目明显增多,电结晶层为粗大条状,基体表面仍有小部分区域未出现电结晶层,如图5(b)所示。随着电镀时间的延长,镀层粗糙度明显增加,如图5(c)和(d)所示。Ni2+在已结晶的Ni层上进行电结晶,形核所需能量较低,可能使Ni的电沉积速度远大于金刚石粉体被嵌入阴极表面的速度,镀层的金刚石复合量减少,金刚石粉体的空间位阻效应降低,从而影响镀层的表面粗糙度。
2.4 形核模型
金属电结晶分为二维电结晶的形核/生长、三维核心的形核/生长和多晶沉积的形核/生长。二维电结晶沉积的生长所涉及形核的核心为一个原子或一个分子厚的盘,基体一般要求为惰性或无位错的单晶表面[20]。在三维核心的形核/生长中,当晶格组合决定晶体生长步骤时,仅考虑生长核心为简单几何形状的直立圆锥体,即BFT(Bewick-Fleshmann-Thrisk)模型。在短时间内,瞬时形核和连续形核表达式依据核心生长相互独立的假定推导,且不考虑“交叠”问题。瞬时形核暂态电流表达式近似为[19]

连续形核暂态电流表达式近似为

式中:Ⅰ为电流;n为电荷数;F为法拉第常数;K3为平行于表面的生长速率;K3′为垂直于表面的生长速率;M为分子摩尔质量;N0为最大晶核数密度或表面活性位点数;A3为单位时间内的连续形核数目;t为时间;ρ为沉积物的密度。

图5 在阴极电位为-1.0 V和不同电镀时间下Ni-金刚石复合镀层的SEM像Fig.5 SEM images of Ni-diamond composite coatings at cathode potential of -1.0 V and different electroplating times: (a)10 s; (b)30 s; (c)3 min; (d)10 min
当扩散决定晶体生长步骤时,大量生长核心都在基体表面上形成,其扩散场的相互作用比较复杂,在短时间内,假设忽略扩散场之间的相互作用,暂态电流正比于t1/2时为瞬时形核,正比于t3/2时为连续形核。双电层充电和吸附原子形成所产生的电流可能导致暂态效应发生畸变,该形核机理分析不准确。SCHARIFKER和HILL[21]考虑生长核心为无规则排列产生的扩散场重叠效应,提出 Scharifker-Hill三维形核模型,并推导出式(3)~(6):
瞬时形核时,

连续形核时,

式中:Ⅰmax为暂态电流峰值;为扩散系数;c为摩尔浓度;tmax为形核弛豫时间;A为形核速率常数。在Ni电结晶的形核初期,暂态电流近似具有无相互作用中心生长所预示的特性,在长时间后接近平面的半无限扩散。该模型在电化学形核中应用最为广泛;尽管该理论模型基于纯金属的形核/生长[6],但目前也广泛用于合金的形核/生长[17,22]。因此,Scharifker-Hill三维形核模型已广泛用于描述纯金属或合金的电结晶过程[23]。暂态电流—时间曲线的尖峰部分涉及晶体形核过程,故将这部分曲线的无因次曲线分别与式(4)和(6)所得的无因次理论曲线进行拟合,分析电结晶形核模型。
图6(a)和(b)所示分别为纯Ni镀液与Ni-金刚石复合镀液的 Ni电沉积无因次(Ⅰ/Ⅰmax)2—(t/tmax)曲线和拟合结果。从图6(a)和(b)可以看出,两种镀液的无因次曲线相似,表明金刚石粉体在Ni的电沉积过程中并没有改变其动力学历程,即 Ni的电结晶机制没有发生改变;在低电位下均接近 Scharifker-Hill理论模型瞬时形核,而当电位较负时,无因次曲线明显偏离Scharifker-Hill理论模型。同时,将这两种镀液的无因次曲线与BFT理论模型进行数据拟合,均发现无因次曲线明显偏离BFT理论模型。GRUJICIC和PESIC[24]研究了Cu在玻碳电极上的电沉积行为,发现当pH=2或3时,由于溶液电阻增大Cu的电沉积行为不符合Scharifker-Hill理论模型;本实验中当pH=3~3.5时Ni的电沉积也不符合Scharifker-Hill理论模型。刘宇等[25]发现低电位形核模型均不符合 Scharifker-Hill理论模型连续形核或瞬时形核,而是介于两者之间。事实上,任何理论模型都是某种理想状态在多方面限制条件下推导出来的,如二维电结晶瞬时形核和连续形核模型均依据核心生长是相互独立的假定而推导出来的,且未考虑“交叠”问题;但在实际条件下,电极表面发生的反应一般较为复杂,三维生长核心扩张可能受阻,不同生长形式与电镀槽组成、温度、镀液对流和微粒等条件有关,各种因素的相互作用较为复杂,尚不能建立合适的机制,本实验结果证明了这一点。
表1所列为纯Ni镀液和Ni-金刚石复合镀液Ni电沉积的实验结果。从表1可以看出,纯Ni镀液和Ni-金刚石复合镀液的Ⅰmax2tmax随过电位的增大明显发生改变,而满足三维形核最基本的要求是过电位不明显改变Ⅰmax2tmax的值[4],这表明Ni在这两种镀液中电结晶形核不满足三维形核特征,即可能为多晶沉积。比较表1这两种镀液体系中的电流峰值Ⅰmax可以看出,Ⅰmax呈无规律变化,可能与金刚石吸附在阴极表面的时间有关。当处于强吸附状态的金刚石粉体较多时,镀层金刚石含量较高,对阴极表面产生屏蔽作用,使Ni2+的有效放电面积减小,阻碍电荷转移,从而使有效电流降低;反之,有效电流增大。
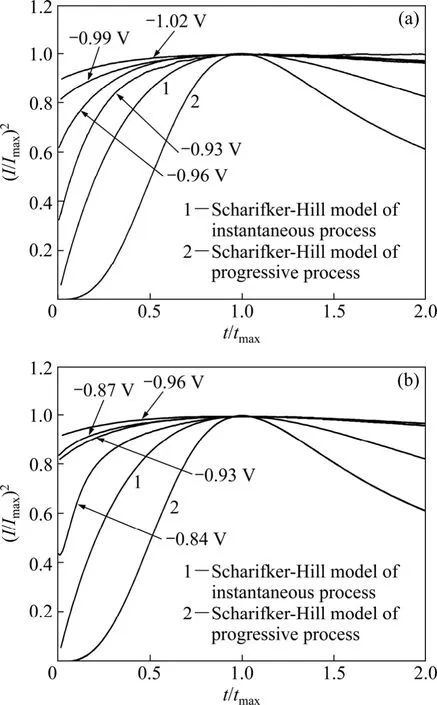
图6 不同镀液体系中 Ni电沉积的无因次(Ⅰ/Ⅰmax)2—(t/tmax)曲线Fig.6 Non-dimensional (Ⅰ/Ⅰmax)2 — (t/tmax)plots for electrodeposition of Ni in different electroplating solutions:(a)Pure Ni; (b)Ni-diamond composite

表1 纯Ni镀液和Ni-金刚石复合镀液中Ni电沉积的实验结果Table 1 Experimental results for electrodeposition of Ni in pure Ni and Ni-diamond composite electroplating solutions
3 结论
1)金刚石粉体吸附于阴极表面,短时间内处于弱吸附状态,对阴极表面产生屏蔽作用,使Ni2+的有效放电面积减小,阻碍电荷转移,从而使Ni2+在循环伏安沉积过程中的还原电流降低。
2)金刚石粉体使 Ni电结晶的形核弛豫时间缩短,形核过电位正移,促进Ni电结晶形核,且随着电镀时间的延长,金刚石的复合量减小,使镀层表面粗糙度增大。
3)在Ni-金刚石复合镀液和纯Ni镀液中,阶跃电位越负,形核弛豫时间越短,形核速率越快,阴极暂态电流越高,电结晶形核可能为多晶沉积。
[1]郭鹤桐, 张三元.复合电镀技术[M].北京: 化学工业出版社,2007: 4-119.GUO He-tong, ZHANG San-yuan.Composite plating technology[M].Beijing: Chemical Industry Press, 2007: 4-119.
[2]杨绮琴.应用电化学[M].广州: 中山大学出版社, 2005: 162.YANG Qi-qin.Applied electrochemistry[M].Guangzhou: SUN Yat-sen University Press, 2005: 162.
[3]SAHARI A, AZIZI A, SCHMERBER G, ABES M, BUCHER J P,DINIA A.Electrochemical nucleation and growth of Co and Co-Fe alloys on Pt/Si substrates[J].Catalysis Today, 2006, 113(3/4):257-262.
[4]MIN Gu.Initial stages of the electrocrystallization of Co-Cu alloys on GCE from the Co-rich electrolytes[J].Electrochemical Acta, 2007,52(13): 4443-4448.
[5]GRUJICIC D, PESIC B.Electrochemical and AFM study of cobalt nucleation mechanisms on glassy carbon from ammonium sulfate solutions[J].Electrochimica Acta, 2004, 49: 4719-4732.
[6]LI Jing-feng, ZHANG Zhao, YIN Jun-ying, YU Geng-hua, CAI Chao, ZHANG Jian-qing. Electrodeposition behavior of nanocrystalline CoNiFe soft magnetic thin film[J].Transactions of Nonferrous Metals Society of China, 2006, 16(3): 659-665.
[7]谭澄宇, 刘 宇, 胡 炜, 崔 航.Ni-SiC电结晶沉积层的阻抗谱及SiC颗粒对Ni沉积的影响[J].材料保护, 2009, 42(5): 11-16.TAN Cheng-yu, LIU Yu, HU Wei, CUI Hang.Impedance spectroscopy of electrocrystallization of Ni-SiC and effect of SiC powder on Ni electrodeposition[J].Journal of Materials Protection,2009, 42(5): 11-16.
[8]TU Wei-yi, XU Bin-shi, DU Ling-zhong.Effect ofα-Al2O3on electrochemical nucleation and chemical binding interaction in nickel electrodeposition[J].Transactions of Nonferrous Metals Society of China, 2005, 15(4): 889-896.
[9]NOWAK P, SOCHA R P, KAISHEVA M, FRANSAER J, CELIS J P,TOINOV Z.Electrochemical investigation of the codeposition of SiC and SiO2particles with nickel[J]. Journal of Applied Electrochemistry, 2000, 30(4): 429-437.
[10]王立平, 高 燕, 薛群基, 刘惠文, 徐 洮.纳米金刚石对电沉积Ni基复合镀层微观结构及抗磨性能的影响[J].摩擦学学报, 2004,24(6): 488-492.WANG Li-ping, GAO Yan, XUE Qun-ji, LIU Hui-wen, XU Tao.Effect of nanodiamond on the microstructure and abrasive resistance of Ni-based compound coating[J].Tribology, 2004, 24(6): 488-492.
[11]杜 楠, 周海飞, 赵 晴, 廖 强.Ni-金刚石复合电沉积的界面作用力及其对复合量的影响[J].材料工程, 2008(2): 23-30.DU Nan, ZHOU Hai-fei, ZHAO Qing, LIAO Qiang.Interfacial force in nickel-diamond composite electrodeposition and its effect on diamond content in composite plating[J].Materials Engineering,2008(2): 23-30.
[12]曹学功.Ni-金刚石复合镀层耐磨性能研究[J].华侨大学学报: 自然科学版, 2000, 21(2): 141-143.CAO Xue-gong.Research on abrasive resistance property of nickel-diamond composite electrodeposition[J].Journal of Huaqiao University: Natural Science, 2000, 21(2): 141-143.
[13]LEEA E C, CHOI J W.A study on the mechanism of formation of electrocodeposited Ni-diamond coatings[J].Surface and Coatings Technology, 2001, 148(2/3): 234-240.
[14]赵旭山.Ni-SiC复合沉积电极过程动力学及镀层电化学腐蚀行为研究[D].长沙: 中南大学, 2008: 37.ZHAO Xu-shan.Research on nucleation kinetics during early electrocrystallization processes and corrosion properties of Ni-SiC composite film[D].Changsha: Central South University, 2008: 37.
[15]LEE H K, LEE H Y, JEON J M.Codeposition of micro- and nano-sized SiC particles in the nickel matrix composite coatings obtained by electroplating[J].Surface and Coatings Technology,2007, 201(8): 4711-4717.
[16]楚 广, 刘生长.新型 Ni-Cu复合镀层的制备[J].中南大学学报:自然科学版, 2007, 38(3): 474-479.CHU Guang, LIU Sheng-zhang.Preparation of Ni-Cu composite coating by composite electroplating[J].Journal of Central South University: Science and Technology, 2007, 38(3): 474-479.
[17]ETERSSON I, AHLBERG E.Kinetics of the electrodeposition of Pb circle divide Sn alloys (Part I): At glassy carbon electrodes[J].Journal of Electroanalytical Chemistry, 2000, 485: 166-177.
[18]曹经倩.Cr(VI)对镍沉淀的影响[J].南昌航空工业学院学报,1994(1): 14-19.CAO Jing-qian.Effect of Cr(VI)on the deposition of nickel[J].Journal of Nanchang Institute of Aeronautical Technology, 1994(1):14-19.
[19]赵旭山, 谭澄宇, 陈文敬, 刘 宇, 李劲风,郑子樵.Ni-SiC复合镀层电结晶初期动力学分[J].中国有色金属学报, 2008, 18(5):823-828.ZHAO Xu-shan, TAN Cheng-yu, CHEN Wen-jing, LIU Yu, LI Jin-feng, ZHENG Zi-qiao.Nucleation kinetics analysis of Ni-SiC composite film during early electrocrystallization processes[J].The Chinese Journal of Nonferrous Metals, 2008, 18(5): 823-828.
[20]GREEF R, PEAT R, PETER L M, PLETCHER L M, PLETCGER D,ROBINSON J.电化学中的仪器方法[M].柳厚田, 徐品弟, 译.上海: 复旦大学出版社, 1992: 310.GREEF R, PEAT R, PETER L M, PLETCHER L M, PLETCGER D,ROBINSON J.Instrumental methods in electrochemistry[M].LIU Hou-tian, XU Pin-di, transl.Shanghai: Fudan University Press, 1992:310.
[21]SCHARIFKER B, HILLS G.Theoretical and experimental studies of multiple nucleation[J].Electrochimica Acta, 1983, 28(7): 879-889.
[22]AFSHR A, DOLATI A G, GHORBANI M.Electrochemical characterization of the Ni-Fe alloy electrodeposition from chloride-citrate-glycolic acid solution[J].Materials Chemistry and Physics, 2002, 77(2): 352-358.
[23]TAN Cheng-yu, CUI Hang, HU Wei, LIU Yu, ZHENG Zi-qiao.Influence of nano-Al2O3particles on nickel electrocrystallization at initial stage[J].Rare Metal Materials and Engineering, 2010, 39(1):10-16.
[24]GRUJICIC D, PESIC B.Electrodeposition of copper: The nucleation mechanisms[J].Electrochimica Acta, 2002, 47(18): 2901-2912.
[25]刘 宇, 谭澄宇, 贾志强, 胡 炜.铜离子对 Ni在玻碳电极上电结晶行为的影响[J].中南大学学报: 自然科学版, 2010, 41(1):144-149.LIU Yu, TAN Cheng-yu, JIA Zhi-qiang, HU Wei.Effect of copper ions on behavior of nickel electrocrystallization on glassy carbon electrode[J].Journal of Central South University: Science and Technology, 2010, 41(1): 144-149.

