传代对残耳软骨细胞体内软骨形成能力的影响
康宁 刘霞 曹谊林 肖苒
先天性小耳畸形表现为耳廓发育不全,即正常轮廓缺失,遗留小团软骨块或皮赘。该类患者的残耳软骨取材简便,不损伤正常生理结构,在基于组织工程技术的耳廓再造中具有重要的应用价值。我们在前期研究中已明确体外构建成人大小耳廓软骨所需要的残耳软骨细胞总量、代次及其与表型的关系。但是,细胞在体外的生物学特性会受到体内微环境的影响,体外扩增的残耳软骨细胞最终在体内的软骨形成能力仍不清楚。本实验通过比较第3~8代残耳软骨细胞与材料复合在体内形成的组织工程化软骨,明确体外传代对残耳软骨细胞体内软骨形成能力的影响,为临床应用提供理论基础与技术参数。
1 材料和方法
1.1 样本来源
经本院伦理委员会批准,样本取自3例Ⅲ期耳廓再造术患者废弃的残耳软骨,患者年龄7~13岁,均已知情同意。
1.2 主要试剂和材料
无纺聚羟基乙酸(PGA,组织工程国家工程中心),聚乳酸(PLA,Sigma 公司,USA),碱性成纤维细胞生长因子(Peprotech公司,美国),兔抗人Ⅱ型胶原多克隆抗体、三步法免疫组化检测试剂盒SP-9001、浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司)。
1.3 残耳软骨细胞的分离培养
将残耳软骨剥离软骨膜,切成2 mm×2 mm×2 mm小块,以0.25%胰蛋白酶消化20min,PBS冲洗3次,0.2%Ⅳ型胶原酶37℃摇床消化8~12 h,200目滤网过滤,2000 r/min离心8min,锥虫蓝染色检查细胞活力并计数,以 1.5×104cells/cm2的密度接种,加入培养基(10 ng/mL bFGF,DMEM-LG,10%胎牛血清,100 U/mL青霉素,0.1 mg/mL链霉素),置于37℃、5%CO2、100%饱和湿度的培养箱内,4 d传代1次。分别收集第3~8代残耳软骨细胞用于组织工程软骨构建。
1.4 生物支架的制备
将PGA均匀嵌入预制的圆柱状(直径5 mm,厚度1.5 mm)硅胶模具内,滴加0.1%的聚乳酸(Polylactic acid,PLA)二氯甲烷溶液约 50μL,自然干燥后,75%乙醇消毒,PBS洗涤3次,培养基预培养过夜,准备接种细胞。
1.5 细胞-支架复合物的体外培养和体内植入
收集第3~8代细胞,分别以6.0×107cells/mL浓度接种至PGA/PLA支架材料。根据细胞代次设为6组(n=10),以普通培养基培养(DMEM-LG,10%胎牛血清,100 U/mL 青霉素,0.1 mg/mL 链霉素),1 周换液3次;体外培养4周后,部分取材行软骨相关检测,其余的植入裸鼠体内观察8周。
1.6 相关检测
1.6.1 大体观察
观察各代细胞-材料复合物在体外培养4周后及植入体内8周后的大小、形状、质地和色泽。
1.6.2 组织学检测
对各组标本进行HE、番红O、维多利亚蓝染色及Ⅱ型胶原免疫组化染色。
1.6.3 Real-time PCR检测
留取体外培养4周各代复合物标本进行总RNA提取、逆转录和Real-time PCR反应,检测的基因、引物序列如下所示。GAPDH:5'-CGTCAAAGGTGGAGGAGTG-3',5'-GAAGCTCACTGGCATGGC-3';COL2A1:5'-AGGTCACAGAGGTTATCCAG-3',5'-GTCCGTCCTCTTTCACCAG-3';SOX9:5'-TCTACACACAGCTCAC-3',5'-TGGGTTCGAGTTGCCTTTAG-3';DLK1:5'-CGAGCACCGTATCCTGAAG-3', 5'-AGGATGGTAAAGCAGATGGC-3'。
1.6.4 生物力学检测
对体内8周的各组标本进行弹性模量检测。
1.7 统计学分析
所得数据以均数±标准差表示,SPSS17.0软件进行统计,应用One way-ANOVA进行分析,P<0.05为差异具有显著性。
2 结果
2.1 体外培养4周
2.1.1 大体及组织学
第3~8代细胞-支架复合物均未形成基质饱满的类软骨组织。复合物接种后的早期生长阶段,仅有少量新生基质分泌,且随代次的增高,细胞-材料复合物的新生基质越疏松(图 1,A~F)。
HE染色结果与大体表现吻合,只见细胞与稀少的新生基质,以及大量未降解的PGA纤维(图1,A1~F1)。番红O染色结果仅表现为淡染的红色背景(图1,A2~F2)。Ⅱ型胶原免疫组化染色结果与番红O 染色结果一致(图 1,A3~F3)。
2.1.2 软骨相关基因的表达
第3~8代复合物体外培养4周后,COL 2A1的表达水平在第5代后明显下调(P<0.05)(图2,A)。SOX 9在第3、4代的表达水平显著高于第5~8代(P<0.05)(图 2,B)。 DLK 1 的检测结果与 SOX 9 相似,第3、4代残耳软骨细胞构建的组织中DLK 1维持较高水平的表达,但只在第3代和其他代次之间检测到统计学差异(P<0.05)(图 2,C)。
2.2 体内植入8周
2.2.1 大体及组织学
第3~6代细胞-支架复合物经体内8周重塑后,形成了与原支架等大的类软骨组织,色微黄且触之有弹性(图3,A~D),而第7、8代残耳软骨细胞构建的复合物萎缩成一小团纤维组织(图3,E~F)。
HE染色结果显示,第3~6代残耳软骨细胞构建的复合物中均能见到典型的软骨结构,第3、4代复合物形成的软骨结构较多(图 3,A1、B1),随代次增高软骨结构减少,纤维组织增多(图 3,C1、D1),且第7代复合物中只有极少数的岛状软骨形成(图3,E1),至第 8 代仅有纤维组织(图 3,F1)。 番红 O染色结果示,第3、4代复合物阳性着色较为均一(图3,A2、B2),第5~7代细胞构建的复合物其软骨结构红染,纤维组织呈阴性(图3,C2~E2),第8代的全部组织均呈阴性染色(图3,F2)。Ⅱ型胶原免疫组化染色和维多利亚蓝染色结果与番红O结果一致(图3,A3~F3,A4~F4)。
2.2.2 生物力学性能
体内植入8周后,各组复合物的弹性模量随代次增加逐渐降低,第3~6代复合物的弹性模量明显高于第 7、8 代(P<0.05)(图 4)。
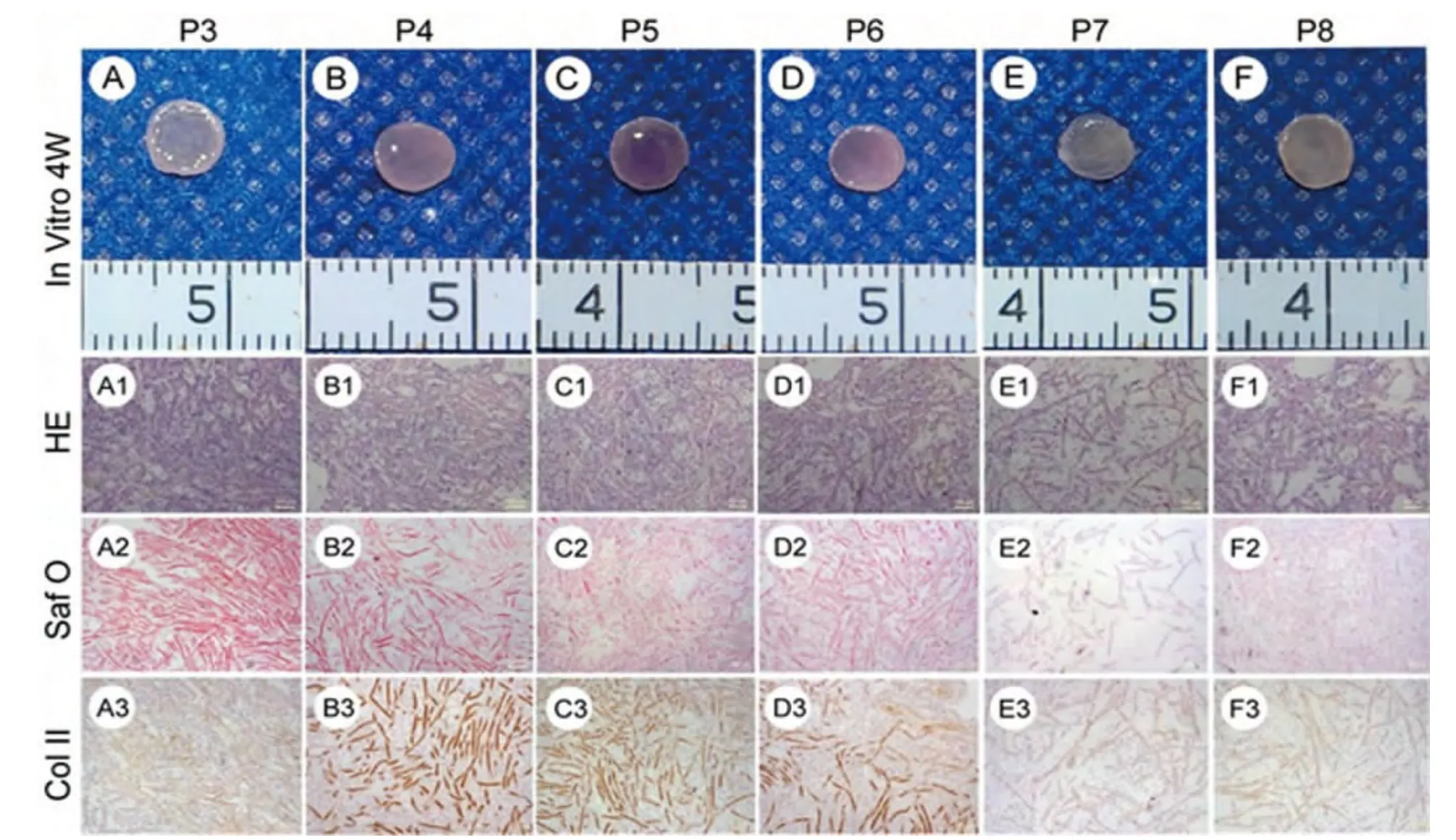
图1 各组复合物体外培养4周大体及组织学观察(标尺:100 μm)Fig.1 Gross and histological observation of each group after cultured for 4 weeks in vitro(Scale:100 μm)
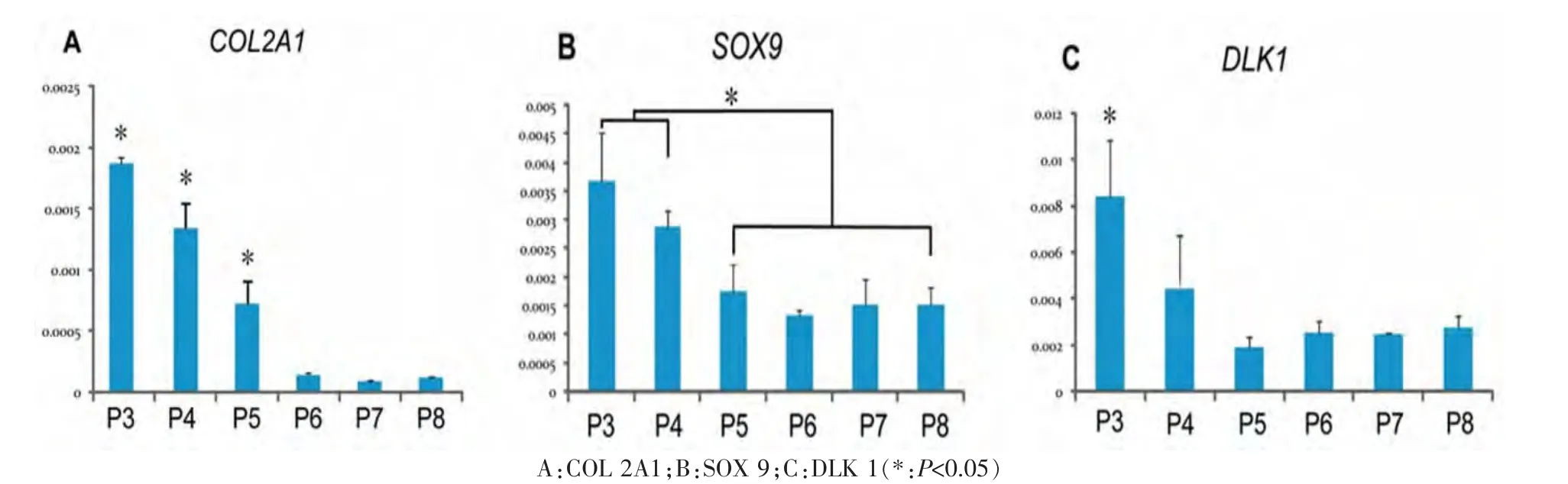
图2 各组复合物体外培养4周后软骨相关基因的表达Fig.2 The expression of chondrocyte specific genes in each group after cultured for 4 weeks in vitro
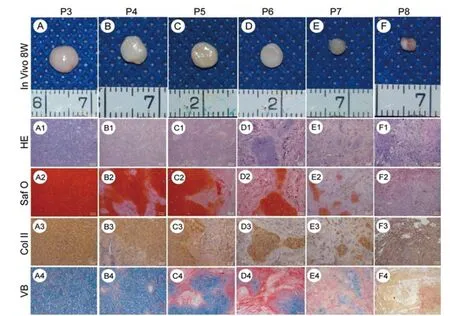
图3 各组复合物体内植入8周后大体及组织学观察(标尺:100 μm)Fig.3 Gross and histological observation of each group after cultured for 8 weeks in vivo(Scale:100 μm)
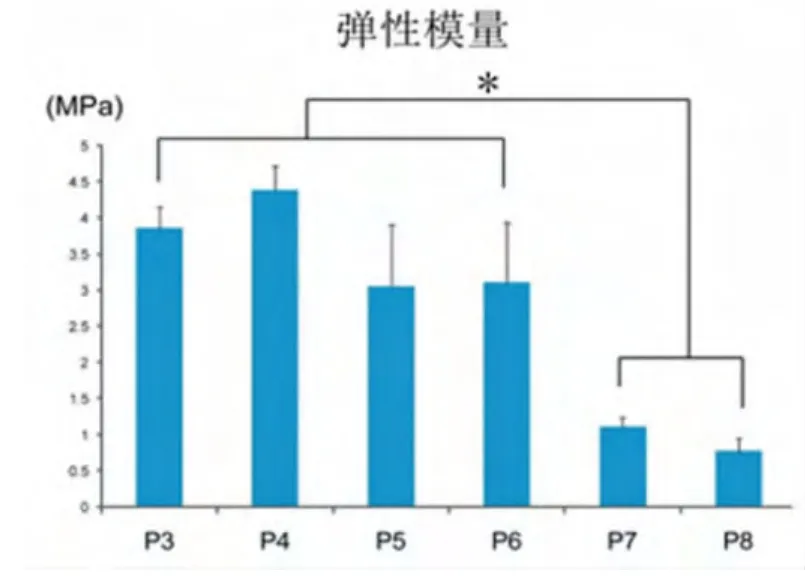
图4 各组复合物体内培养8周后的弹性模量(*:P<0.05)Fig.4 The elastic modulus in each group after cultured for 8 weeks in vivo(*:P<0.05)
3 讨论
残耳软骨细胞是耳廓软骨组织工程极具研究及应用价值的种子细胞[1-2]。我们在前期研究中发现,残耳软骨细胞和正常耳软骨细胞一样在体外传代过程中极易发生去分化,细胞传至第3代时软骨表型已十分微弱,到第4代已基本消失。衡量软骨细胞临床意义的重要指标是体内的成软骨能力。因此,本实验将残耳软骨细胞从第3代连续扩增至第8代,将各代细胞分别接种于PGA/PLA三维支架上,在体外培养4周后植入体内,研究传代对残耳软骨细胞体内成软骨能力的影响。我们发现,虽然第3~8代细胞-材料复合物在体外培养4周后均不能形成软骨组织,但植入体内8周后,第3~6代复合物均有不同程度的软骨结构形成,说明适当的微环境的确能改善软骨细胞的去分化现象[3-6]。
虽然体外4周时,各组在组织学水平上未能形成典型的软骨结构,但软骨转录因子SOX 9在第3、4代显著高于其他代次。DLK 1是决定细胞分化的关键基因,并与软骨分化关系密切[7-9]。Harkness[10]证实,DLK 1可作为有软骨分化潜能的软骨祖细胞的标记。我们检测了DLK 1在不同代次细胞-材料复合物中的表达情况,发现其与SOX 9表达基本一致,在第3、4代中表达水平较高。另外,体内重塑8周后,组织学染色可见第3、4代复合物中均有大量软骨结构形成,且随代次增高而减少,纤维组织逐渐增多。我们推测,SOX 9和DLK 1可作为检测传代过程中软骨细胞是否保留体内成软骨潜能的标志分子。此外,第3~6代软骨组织的弹性模量显著高于第7、8代复合物,说明即使组织中混杂不同程度的纤维组织,但只要有一定量的软骨结构,整个组织便可维持一定水平的生物力学特性。
综上所述,我们认为残耳软骨细胞体外扩增至第4代时,仍能保持良好的体内成软骨能力;第7、8代残耳软骨细胞复合物在体内8周后只形成了纤维组织,表明软骨细胞已丧失了成软骨能力,提示扩增传代对残耳软骨细胞软骨表型去分化的影响在第7代后已无法逆转。
[1]Kamil SH,Vacanti MP,Vacanti CA,et al.Microtia chondrocytes as a donor source for tissue-engineered cartilage[J].Laryngoscope,2004,114(12):2187-2190.
[2]Yanaga H,Imai K,Fujimoto T,et al.Generating ears from cultured autologous auricular chondrocytes by using two-stage implantation in treatment of microtia[J].Plast Reconstr Surg,2009,124(3):817-825.
[3]Chen GP,Takashi S,Takashi U,et al.Redifferentiation of dedifferentiated bovine chondrocytes when cultured in vitro in a PLGA-collagen hybrid mesh[J].FEBS Letters,2003,542(1-3):95-99.
[4]Ando K,Imai S,Isoya E,et al.Effect of dynamic compressive loading and its combination with a growth factor on the chondrocytic phenotype of 3-dimensional scaffold-embedded chondrocytes[J].Acta Orthop,2009,80(6):724-733.
[5]Caron MM,Emans PJ,Coolsen MM,et al.Redifferentiation of dedifferentiated human articular chondrocytes:comparison of 2D and 3D cultures[J].Osteoarthritis Cartilage,2012,20(10):1170-1178.
[6]Schuh E,Hofmann S,Stok K,et al.Chondrocyte redifferentiation in 3D:the effect of adhesion site density and substrate elasticity[J].J Biomed Mater Res A,2012,100(1):38-47.
[7]Wang Y,Sul HS.Pref-1 regulates mesenchymal cell commitment and differentiation through Sox9[J].Cell Metab,2009,9(3):287-302.
[8]Taipaleenmaki H,Harkness L,Chen L,et al.The crosstalk between transforming growth factor-beta1 and delta like-1 mediates early chondrogenesis during embryonic endochondral ossification[J].Stem Cells,2012,30(2):304-313.
[9]Chen L,Qanie D,Jafari A,et al.Delta-like 1/fetal antigen-1(Dlk1/FA1)is a novel regulator of chondrogenic cell differentiation via inhibition of the Akt kinase-dependent pathway[J].J Biol Chem,2011,286(37):32140-32149.
[10]Harkness L,Taipaleenmaki H,Mahmood A,et al.Isolation and differentiation of chondrocytic cells derived from human embryonic stem cells using dlk1/FA1 as a novel surface marker[J].Stem Cell Rev,2009,5(4):353-368.

