自体颅骨粉末移植和膜引导再生技术修复兔颅骨缺损的组织学研究
陈敏建 陆婷 陈平
应用自体颅骨粉末移植和膜引导性再生技术修复颅骨缺损,在之前的动物实验研究中已被证实是一种快速有效的方法,但其组织学演变过程并不清楚。本实验旨在对该问题进行探讨,以更好地指导临床应用。
1 材料与方法
1.1 主要材料与实验动物
1.1.1 主要材料
聚-DL-乳酸(PDLLA)可吸收生物膜,厚0.2 mm,大小1.5 mm×1.5 mm (成都迪康中科生物医学材料有限公司);医用生物蛋白胶(广州倍绣生物技术有限公司)。
1.1.2 实验动物
新西兰大白兔50只,普通级 (许可证号:SCXK2007-0001),体质量为 2.0~2.5 Kg,雌雄不限,由福建省医学科学研究所实验动物中心提供。
1.2 缺损模型制作
手术前一天用8%Na2S溶液行手术区化学脱毛备皮。以盐酸氯胺酮30 mg/Kg加氟哌利多1 mg/Kg肌肉注射麻醉,颅顶正中切口,长约5 cm,切开皮肤、皮下组织及颅骨膜,颅骨膜下充分暴露颅顶骨,用手摇钻和颅骨钻钻孔形成1个直径为1 cm的颅骨全层缺损。同时仔细搜集颅骨钻孔时形成的骨粉备用。骨缺损处移植收集备用的骨粉,约1 mL,表面涂以适量的医用生物蛋白胶固定,移植骨粉的上面放置可吸收生物膜,切除对应部位的颅骨膜,生物膜超过缺损边缘2 mm。皮肤、皮下组织及颅骨膜0号丝线全层间断缝合,关闭切口。术后肌注青霉素抗炎5 d,单只置笼内饲养,自由活动。 术后 2、4、6、8、12周取材行组织学观察。
1.3 组织学观察
取材时沿缺损边缘0.5 cm正常颅骨处完整凿下标本,用6.8%硝酸脱钙2周,每天换液2~3次,清水持续冲洗12 h,常规脱水、包埋、切片、HE染色,镜下观察,显微摄影。
2 结果
本组实验动物共50只,其中有2只在手术过程中死亡,有8只拒食死亡,其余实验动物存活良好。在实验过程中,饮食、大小便、行为等均未发现异常,切口均无感染,愈合良好。
2.1 术后2周
缺损区周边可见大量细小的新生编织骨,编织骨之间相连或不相连,其表面可见一层成骨细胞覆盖,编织骨间见大量的毛细血管截断面,每高倍视野下约26~32个,毛细血管周围是成纤维组织;往中央方向,可见一明显的界线,该界线主要由成纤维组织形成,界线的周边侧可见成纤维组织对骨粉的包裹,巨噬细胞和破骨细胞对骨粉的吞噬,同时可见大量的岛状或不规则条状的编织骨,及其表面和周围大量的成骨细胞;界线的中央侧可见骨粉为大量的成纤维组织包裹,纤维组织内有大量的炎性细胞浸润,而纤维组织内只见少量毛细血管的截断面,每高倍视野下约8~14个。新形成编织骨与正常骨有连接,但界限非常清楚(图1)。
2.2 术后4周
术后4周时仍可见术后2周时观察到的 “界线”,该界线已明显向中央内移,留下的骨粉明显减少,形成的编织骨明显增多;在缺损的周边部形成的编织骨较为粗壮,形成了初级骨髓腔,腔内可见破骨细胞、成骨细胞、纤维间充质组织、脂肪细胞空泡和少量的毛细血管截面。由周边部向中央部观察,越靠周边部的编织骨越粗壮,联系也越紧密,其骨髓腔在成分和形态上越接近正常骨髓腔,越靠近中央部的编织骨越细,仍可见孤立性骨岛。新形成编织骨与正常骨的界限清晰可辨。
2.3 术后6周
大部分标本没有观察到移植的骨粉,在缺损的中央部可见孤立性的骨岛及其周围的成纤维组织,纤维组织内毛细血管截面较少。形成的编织骨越靠近中央部越细,彼此的联系越稀疏,骨髓腔内的成分可见破骨细胞、成骨细胞、纤维间充质组织、脂肪细胞空泡和少量的毛细血管截面;编织骨越靠近缺损周边越粗壮,彼此的联系越紧密,骨髓腔内的成分越简单,周边部编织骨骨髓腔内成分与正常骨骨髓无明显区别。新骨与正常骨的界限仍可辨别(图2)。
2.4 术后8周
缺损中央部形成单层的编织骨,没有骨髓腔,向周边逐渐形成两层的编织骨和骨髓腔,腔内可见破骨细胞和成骨细胞,间充质组织,少量毛细血管截断面,编织骨越靠近缺损周边越粗壮,并逐渐形成板状,彼此的联系越紧密,周边与正常骨完全融合。
2.5 术后12周
缺损中央部形成双层的编织骨,且编织骨有所增粗,在内外板的位置形成板状层,相对较薄,编织骨之间的连接更加紧密,形成明显的骨髓腔。高倍视野下,腔内可见大量的白细胞浸润和巨噬细胞,在骨髓腔编织骨表面可见破骨细胞和大量的成骨细胞,局部腔内仅见间充质组织。由缺损中央部向周边部延伸,编织骨逐渐粗壮,骨髓腔逐渐成熟,腔内容物逐渐与正常骨髓腔一致,形成的内外板厚度逐渐增厚,周边部与正常骨内外板一致(图3)。
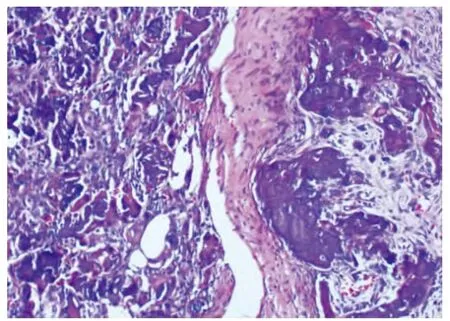
图1 术后2周骨缺损区组织学观察(HE,×20)Fig.1 Histological observation of bone defect area 2 weeks after operation(HE,×20)
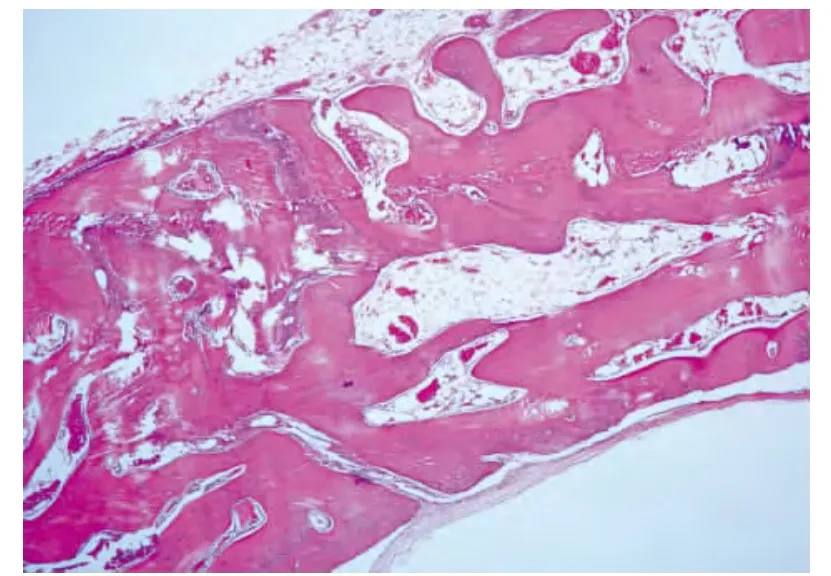
图2 术后6周骨缺损区组织学观察(HE,×10)Fig.2 Histological observation of bone defect area 6 weeks after operation(HE,×10)
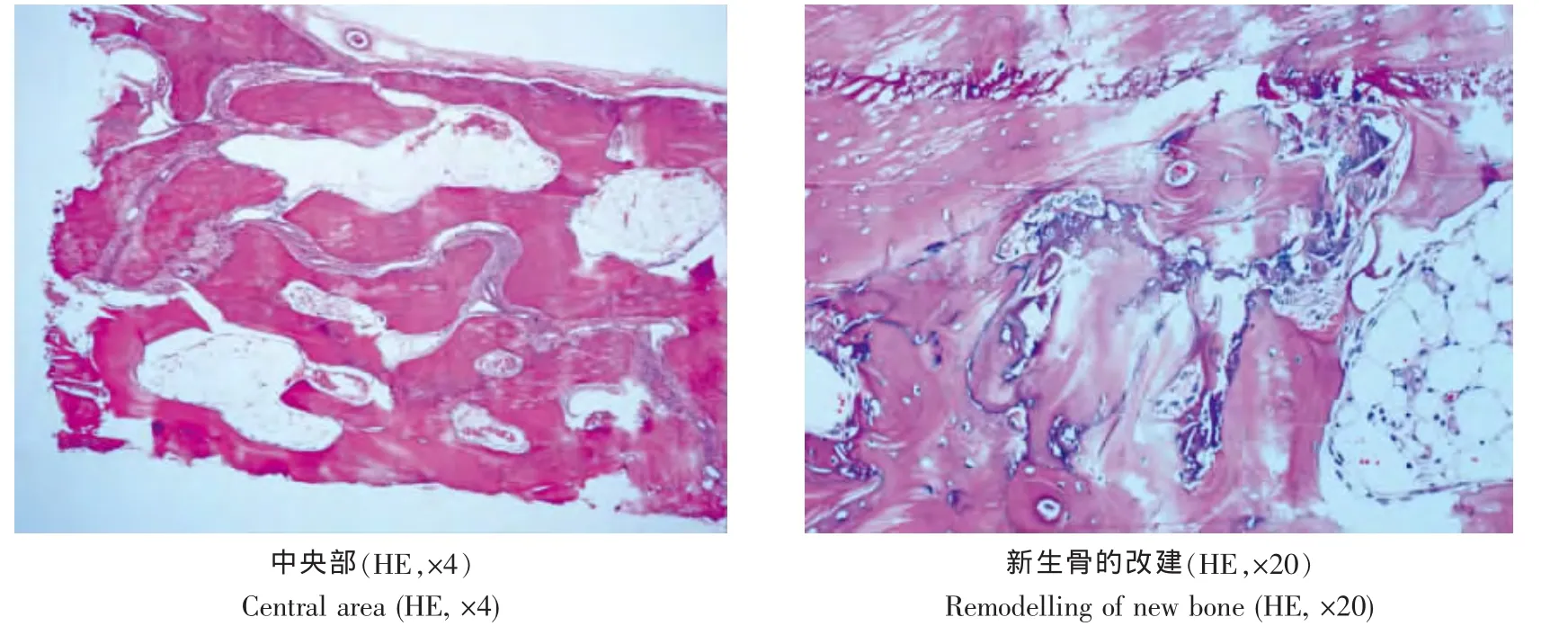
图3 术后12周骨缺损区组织学观察Fig.3 Histological observation of bone defect area 12 weeks after operation
3 讨论
骨引导再生有以下要求:有成骨细胞或具有能分化为成骨细胞的细胞;有促使未分化间充质细胞分化为破骨细胞的诱导性刺激;有组织可以长入的支架。骨诱导是在特定的生长因子作用下,使间充质细胞的聚集反应过程朝着形成软骨或骨的方向发展。诱导成骨必须具备三个条件,即:诱导刺激物,间充质细胞和有利于骨生长的血液供应环境。
本实验的组织学观察结果显示,骨粉移植后逐渐被吸收并形成新骨;新骨的形成是从缺损周边开始,逐渐向缺损中央部推进的一个过程;部分标本可以观察到生物膜下新骨形成活跃,较硬脑膜下新骨形成有明显优势;毛细血管在新骨形成区域的数量较骨粉区和新骨改建区域明显增多;炎性细胞的浸润主要存在于骨粉区域,在新骨形成区域少见。
上述结果说明,移植的骨粉是一种很强的诱导刺激物,同时具有支架作用;骨粉本身含有少量成骨细胞和间充质细胞,但新骨形成所需的成骨细胞和间充质细胞主要来源于缺损周围的骨髓腔和血液供应;生物膜的存在,一定程度上也为新骨的形成提供了支架的作用;在缺损修复的早中期,在同一时间段可以观察到新骨形成的不同阶段,说明骨诱导生长因子在同一时段不同区域和同一区域不同时段的表达是不同的。膜引导下骨粉移植修复颅骨缺损的实质就是膜引导下的引导性和诱导性骨再生的过程。
膜引导下骨粉移植修复颅骨缺损的组织学演变过程如下:骨粉移植入颅骨缺损后,作为强烈的骨再生诱导刺激物,引起血液中的炎性细胞大量向缺损区域转移浸润。在炎性细胞的作用下骨诱导因子向缺损内转移浸润,在骨诱导因子的作用下大量的毛细血管由缺损周围向缺损内增生生长,在毛细血管周围形成大量未分化的间充质细胞并包裹骨粉,和骨粉本身的间充质细胞一起[1],在骨形态发生蛋白作用下形成成骨细胞和破骨细胞[2]。在破骨细胞作用下,骨粉被逐渐吞噬吸收,同时在成骨细胞的作用下,新的编织骨形成,形成的骨小梁是不规则的,大小形态不一,相互连接成立体网状,并逐渐增粗。在骨诱导因子的调控下、破骨细胞和成骨细胞的作用下,新的编织骨进行改建,在颅骨内外板的位置形成板层骨,在板障的位置形成骨髓,并逐渐成熟。在此强调,骨粉移植修复颅骨缺损的组织学演变过程,是一个从缺损周边向缺损中央逐步推进的过程。该过程与陈敏建此前的实验研究完全一致[3-4]。生物膜有效地阻止了结缔组织向缺损内生长,同时生物膜的存在也为骨引导再生提供了一定空间,此外,生物膜有聚集骨诱导因子提高骨诱导因子浓度的作用[5]。骨粉移植修复颅骨缺损过程中,少量的间充质细胞和骨细胞转化成成骨细胞,参与新骨形成,其余全部被吞噬吸收,它的存在除了作为骨引导骨再生强烈的诱导刺激物外,还有三维充填支架的作用。
综上所述,膜引导下骨粉移植修复颅骨缺损的过程,满足了骨引导和骨诱导的条件,因此,其实质就是膜引导下的骨引导和骨诱导再生过程。移植的骨粉是骨引导和骨诱导再生强烈的诱导刺激物,生物膜是该过程得以顺利进行的重要保障。
[1]邹天彪,闫景龙,付海亮,等.自体骨粉复合骨形态蛋白修复兔桡骨缺损[J].中国修复重建外科杂志,2005,19(3):187-191.
[2]Rabie AB,Deng YM,Samman N,et al.The effect of demineralized bone matrix on the healing of intramembranous bone grafts in rabbit skull defects[J].J Dent Res,1996,75(4):1045-1051.
[3]陈敏建,庄福连,王美水,等.自体颅骨粉末修复颅骨缺损的动物实验研究[J].中华整形外科杂志,2008,24(3):203-206.
[4]陈敏建,陈平,陈春霞,等.可吸收生物膜对自体颅骨粉末修复颅骨缺损影响的大体观察和影像[J].福建医药杂志,2010,32(5):4-6.
[5]张永刚,卢世壁,王继芳,等.利用隔膜技术探讨骨折不愈合原因[J].中华骨科杂志,1998,18(11):678-681.

