PhaP-RGD融合蛋白修饰的PHBHHx与人鼻中隔软骨细胞的生物相容性研究
常会敏 高天喜 王正辉 卢晓云 吴宝俊 张向红
PhaP-RGD融合蛋白修饰的PHBHHx与人鼻中隔软骨细胞的生物相容性研究
常会敏 高天喜 王正辉 卢晓云 吴宝俊 张向红
目的观察经PhaP-RGD融合蛋白修饰的3-羟基丁酸和3-羟基己酸的共聚酯(PHBHHx)生物材料与人鼻中隔软骨细胞的生物相容性。方法体外培养人鼻中隔软骨细胞,接种于经PhaP-RGD融合蛋白修饰的PHBHHx膜性材料上进行体外培养,通过MTT比色法、DAPI染色、扫描电镜、甲苯胺蓝染色等实验方法观察在体外条件下生物修饰后的PHBHHx膜与鼻中隔软骨细胞的生物相容性。结果经PhaP-RGD融合蛋白修饰的PHBHHx膜表面接触角变小,亲水性增加;人鼻中隔软骨细胞在蛋白修饰后的生物膜材料表面能保持较高的增殖率;经蛋白修饰的PHBHHx膜表面的软骨细胞活力明显高于细胞培养板及未经蛋白修饰的PHBHHx膜上的软骨细胞;甲苯氨蓝染色发现经PhaP-RGD修饰的PHBHHx膜能促进软骨细胞分泌胞外基质糖胺多糖。结论经PhaP-RGD融合蛋白修饰的PHBHHx与软骨细胞的生物相容性良好,是一种较理想的软骨组织工程支架材料。
PhaP-RGD融合蛋白3-羟基丁酸与3-羟基己酸共聚酯人鼻中隔软骨细胞组织工程
由于软骨细胞的自我修复能力有限,因外伤、炎症或先天畸形造成的耳、鼻、咽喉或气管部的软骨损伤修复一直是临床亟待解决的难题。组织工程学的研究进展为头颈部缺损软骨的修复展示了美好的前景。人鼻中隔软骨细胞属透明软骨,较易获得,且3代以内软骨细胞特性维持良好,适合作为组织工程软骨修复的种子细胞。3-羟基丁酸与3-羟基己酸共聚酯(PHBHHx)是第三代PHA,是存在于微生物细胞中的一种天然生物材料,由大量微生物在不平衡条件下发酵产生,具有良好的生物相容性和生物降解性,具备一定的机械强度,有良好的热可塑性[1]。PhaP是存在于PHA表面的一种PHA颗粒结合蛋白,是一种小分子两性蛋白质。RGD肽被研究证明是能提高细胞与生物材料黏连的有效肽序列[2-3]。实验证实,利用蛋白工程技术表达纯化的PhaP-RGD融合蛋白,对PHBHHx三维支架材料进行生物修饰后,能够增加材料表面的亲水性,促进细胞与材料之间的贴附,并能促进人骨髓间充质干细胞向软骨细胞方向的分化[4]。
本实验将人鼻中隔软骨细胞置于经PhaP-RGD融合蛋白修饰后的PHBHHx生物膜上进行体外培养,观察细胞生长情况,探讨PhaP-RGD融合蛋白对PHBHHx亲水性的改变,及其对PHBHHx与软骨细胞生物相容性的影响。
1 材料与方法
1.1 材料
鼻中隔软骨细胞取自人鼻内镜术后废弃的软骨组织。PHBHHx(清华大学陈国教授提供),PHBHHx生物膜由本课题组制作。PhaP-RGD融合蛋白由本课题组进行表达、纯化。
1.2 方法
1.2.1 人鼻中隔软骨细胞的分离培养
取功能性鼻内镜术后废弃的软骨(经医院伦理委员会同意),剥除软骨表面的筋膜,应用“三步消化法”消化;消化停止后经筛网过滤后离心去上清,含10%胎牛血清的DMEM培养基重悬细胞,置于37℃、5%CO2及饱和湿度的培养箱中进行细胞培养。48 h后更换培养液,以后每2天换液1次。细胞生长融合达90%后,0.5%胰酶消化,按1∶2进行传代培养。
1.2.2 PhaP-RGD融合蛋白的表达纯化
通过重组大肠杆菌BL21(DE3)表达PhaP-RGD融合蛋白,即取含有重组基因PhaP-RGD质粒的E. coli BL21(DE3)100μL接种到10 mL LB培养基(氨苄青霉素浓度5 mg/mL)中,恒温摇床37℃培养12 h;之后加入100μL 24 mg/mL ITPG继续培养5 h,诱导菌种表达融合蛋白。验证融合蛋白的表达后,使用Takara公司的镍柱纯化试剂盒纯化目标蛋白,并通过SDS-PAGE和Western blot进行验证。以不含质粒的E.coli BL21(DE3)为对照(不加氨苄和诱导剂)。
1.2.3 PHBHHx膜性材料的制备
利用溶剂挥发法制备PHBHHx生物膜材料。称取5 g PHBHHx,溶解于100 mL CHCl3中,盖上保鲜膜,60℃水浴加热1 h助溶;将充分溶解的材料均匀铺至10个9 cm直径玻璃培养板中;盖上保鲜膜防止灰尘落入,针头扎孔使其自然挥发,24~48 h后可得到PHBHHx膜。
1.2.4 PhaP-RGD融合蛋白的修饰
将PHBHHx膜浸泡在浓度为3.5 mg/mL的PhaP-RGD纯化蛋白液中,4℃孵育过夜。用PBS冲洗掉膜表面未结合的蛋白。
1.2.5 接触角测量PHBHHx膜表面接触角改变
接触角测量实验分为对照组(未处理)和PhaPRGD蛋白处理组。将PHBHHx膜裁剪成小块,按上述分组并进行相应处理;处理过的膜表面用纯水冲洗,测量接触角之前膜表面的水分用滤纸吸干;将各组膜用双面胶固定在接触角测量仪的样品台上,在膜表面滴加10μL纯水,选择适当的测量区域测量并拍照。根据测量数值计算各组接触角。
1.2.6 人鼻中隔软骨细胞种植于PHBHHx膜
未修饰的PHBHHx膜于细胞培养前,以75%乙醇浸泡过夜,紫外照射正反面各1 h,PBS洗3遍。经PhaP-RGD融合蛋白修饰过的PHBHHx膜,经PBS洗3遍后用于细胞培养。48孔培养板中,软骨细胞以2×107cells/cm2的密度接种于两种PHBHHx膜上,以细胞培养板作为对照,每组3个复孔,37℃、5%CO2条件下分别培养3 d和7 d。
1.2.7 细胞增殖与活力的测定
体外培养3 d,4%多聚甲醛固定细胞30 min,PBS漂洗3次;DAPI染色5 min,PBS缓冲液漂洗3次;在洗净的玻片上滴加2μL的灭菌甘油,使两种PHBHHx膜固定在玻片上;倒置显微镜观察软骨细胞在生物膜上的增殖情况。
取培养3 d和7 d的细胞板;每孔加入200μL MTT溶液(0.5 mg/mL),继续培养2~4 h,弃去培养基;将孔板中PHBHHx膜迅速移至新的48孔板内,长有细胞的一面朝上;每孔加入200μL DMSO置摇床上震荡10 min,将每孔中液体加入标记好的96孔板中,每孔150μL,酶标仪测定492 nm波长时的A值,进行细胞活力分析。
1.2.8 甲苯胺蓝染色观察
体外培养7 d后,PBS洗2遍,4%多聚甲醛固定于6孔板中1 h或更长时间(4℃);自来水洗5 min,蒸馏水洗5 min;加1%甲苯胺蓝浸染2 h;去除多余染液,镜下观察。
1.2.9 扫描电镜观察
体外培养的细胞,经过样本的制备,喷金处理后,在扫描电镜下观察其形态结构。
1.3 统计学分析
采用软件SPSS13.0进行统计学分析,P<0.05差异具有统计学意义。
2 结果
2.1 人鼻中隔软骨细胞的形态和生长特性
相差显微镜下观察发现,原代软骨细胞呈圆形,折光性较强(图1-A);需2 d完成贴壁过程(图1-B);第3天细胞出现伸展,开始时为梭形,后呈不规则三角形或多角形,胞浆中有圆形致密颗粒(图1-C)。
2.2 表达、纯化PhaP-RGD融合蛋白
在验证目的蛋白正确的基础上,根据目标蛋白开头含His-Tag组氨酸标签,可以特异性地和镍吸附的特性,利用镍柱纯化目标蛋白,并对纯化的蛋白溶液进行SDS-PAGE电泳和Western blot验证。结果显示,经过镍柱纯化后,得到了条带均一的目标融合蛋白溶液(图2)。
2.3 接触角测量
PhaP-RGD融合蛋白与膜材料结合后测量其表面水接触角检,以检测其亲水性。结果显示,对照组PHBHHx膜接触角为98.69°;经融合蛋白处理后的PHBHHx膜表面水接触角为10.63°。表明经过融合蛋白的生物修饰作用,材料的表面接触角明显变小,证明PhaP-RGD融合蛋白可以增加膜材料表面的亲水性(图3)。
2.4 软骨细胞在经蛋白修饰后PHBHHx膜表面的活力及增殖情况
采用MTT法对生长于经PhaP-RGD蛋白修饰PHBHHx膜的软骨细胞活力进行检测。结果显示,在培养3 d后,经修饰后的PHBHHx膜表面生长的软骨细胞活力高于其他两组。培养7 d后,PHBHHx膜与修饰后PHBHHx膜表面生长的软骨细胞活力显著高于细胞培养板内的软骨细胞;而修饰后的PHBHHx膜表面的软骨细胞活力稍高于PHBHHx膜。表明PHBHHx膜对软骨细胞没有细胞毒性,并且会增加细胞的活力;另外,PhaP-RGD融合蛋白能增加PHBHHx膜表面软骨细胞的活力(图4)。
采用DPAI法观察细胞增殖情况,发现与细胞培养板和未经处理的PHBHHx膜相比,经过蛋白修饰的PHBHHx膜表面细胞数目较多(图5)。
2.5 PHBHHx膜上软骨细胞形态特征
扫描电镜观察细胞形态发现,所有膜上的细胞均表现出软骨细胞的正常形态(图6-A1、A3),细胞之间形成连接,开始融合,部分细胞向膜表面的孔隙内生长,甚至跨越孔隙(图6-A2、A4)。
2.6 细胞胞外基质分泌情况
甲苯胺蓝染色显示,在没有接种细胞的膜表面未观察到异染现象(图7-A);在PHBHHx膜及经蛋白修饰PHBHHx膜表面均可见蓝色异染,经蛋白修饰的PHBHHx膜表面较未经修饰的PHBHHx染色深(图7-B、C)。表明经PhaP-RGD修饰的PHBHHx膜更能促进软骨细胞分泌胞外基质糖胺多糖。
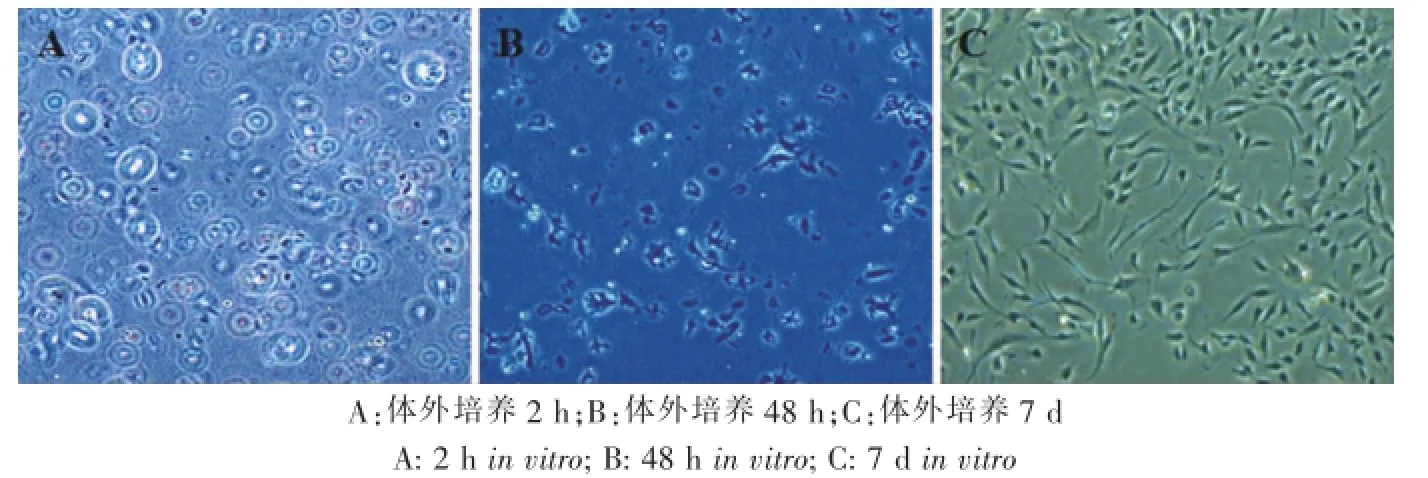
图1 原代人鼻中隔软骨细胞的形态学观察(40×)Fig.1 Histological observation of P0 human nasal septal chondrocytes(40×)

图2 Western blot验证PhaP-RGD融合蛋白的表达及纯化Fig.2 The expression and purification of PhaP-RGD fusion protein

图3 接触角测量Fig.3 The measurement of contact angle
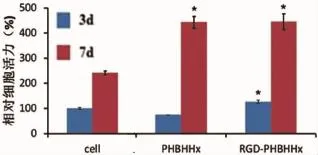
图4 MTT法测定各组软骨细胞活力(*:P<0.05)Fig.4 Cell viability of chondrocytes in each group by MTT method(P<0.05)

图6 软骨细胞在PHBHHx膜与修饰后PHBHHx膜表面培养7 d后的扫描电子显微镜观察Fig.6 SEM observation of chondrocytes on PHBHHx film and modified PHBHHx film cultured

图7 软骨细胞胞外基质的分泌情况Fig.7 The secretion of extracellular matrix of chondrocytes
3 讨论
头颈部软骨自我修复能力有限,外科手术治疗又存在许多缺陷,因此,该区域软骨组织缺损的理想修复仍是耳鼻咽喉科面临的难题之一。近年来,软骨组织工程研究取得了巨大的进步,为软骨缺损修复展现出美好的前景。软骨组织工程的一般策略是将细胞接种于生物材料上,再将这一人工复合体进行移植。理想的用于软骨移植的支架材料,除了具有无细胞毒性、生物可降解性、有一定的机械强度等组织工程对一般支架材料的要求外,还应该满足以下要求:促进软骨细胞的存活、增殖,不影响移植软骨细胞的活力以及能够维持软骨细胞正常表型[5-10]。PHBHHx因较好的生物相容性,在软骨组织工程的研究中受到重视。但是,作为高分子生物材料,其表面的强疏水性是一直存在的,因此考虑对PHBHHx膜进行表面修饰[11-14]。紫外线、等离子、臭氧等方法常被用于PHBHHx表面改性,主要是通过在材料表面形成所需的官能团,改变表面拓扑结构[15-17]。这些方法或多或少地改变了生物材料原有的性能,限制了生物材料的应用。随着组织工程的日益发展,对生物材料的表面修饰提出了更高的要求,特异性识别修饰引起了人们的注意。细胞对生物材料表面的特异性识别,在组织工程中占据重要的地位,是细胞黏附在生物材料表面并进行增殖、分化等生理活动的基础,从材料修饰的角度讲,在生物材料表面引入能促进细胞特异性识别的分子或基团,无疑是一种修饰的重要途径[18-19]。众所周知,RGD肽(细胞黏附信号肽)是提高细胞与生物材料黏连的有效肽序列。有研究将RGD引入PHBV三维支架中[20],在不干扰原有生物素结合性能的情况下,提高了材料的细胞识别性和生物相容性。另有研究将RGD肽与PHA表面颗粒结合蛋白PhaP融合,用于生物支架材料的修饰,不仅改善了细胞相容性,还促进细胞分化,维持细胞正常形态[21]。因此,将能结合材料的PhaP蛋白与能促进细胞黏附的RGD序列融合,并对高分子材料进行修饰是改善材料生物相容性的有效方法。
本实验将PhaP-RGD融合蛋白结合到PHBHHx膜表面,接触角测量结果显示经PhaP-RGD修饰的PHBHHx接触角明显减小,说明PhaP-RGD能够促进PHBHHx表面的亲水性增加。人鼻中隔软骨细胞种植于PHBHHx膜上后,体外培养3 d,细胞均能黏附于PHBHHx膜上,且修饰后的PHBHHx膜表面的软骨细胞活力高于PHBHHx膜。说明PHBHHx膜具有良好的细胞亲和性,进一步说明了PHBHHx经PhaP-RGD修饰后,其疏水性得到较大改善,有利于细胞的黏附生长。7 d后,生长在PHBHHx膜及经蛋白修饰PHBHHx膜上的细胞数量明显增多,同时细胞周围可见大量细胞外基质,而修饰后的PHBHHx膜表面的软骨细胞细胞外基质分泌更多。说明PhaP-RGD能够促进细胞的增殖,且软骨细胞的特性维持良好。
本实验结果表明,经PhaP-RGD融合蛋白生物修饰的PHBHHx作为人鼻中隔软骨细胞移植的支架材料,不仅可以为移植的软骨细胞提供物理支撑,维持细胞正常表型,还使生长在其表面的软骨细胞表现出更好的细胞活力。这为生物修饰后的PHBHHx作为软骨细胞移植的支架材料提供了有力证据,有望进一步用于体内组织工程软骨修复的研究。
[1]Chen GQ,Wu Q.The application of polyhydroxyalkanoates as tissue engineering materials[J].Biomaterials,2005,26(33):6565-6578.
[2]Yao YC,Zhan XY,Zhang J,et al.A specific drug targeting system based on polyhydroxyalkanoate granule binding protein PhaP fused with targeted cellligands[J].Biomaterials,2008,29(36):4823-4830.
[3]Salinas CN,Cole BB,Kasko AM,et al.Chondrogenic differentiation potential of human mesenchymal stem cells photoencapsulated within poly(ethylene glycol)-arginine-glycine-aspartic acidserine thiol-methacrylate mixed-mode networks[J].Tissue Eng, 2007,13(5):1025-1034.
[4]You M,Peng G,Li J,et al.Chondrogenic differentiation of human bone marrow mesenchymal stem cells on polyhydroxyalkanoate (PHA)scaffolds coated with PHA granule binding protein PhaP fused with RGD peptide[J].Biomaterials,2011,32(9):2305-2313.
[5]Liu L,Wu W,Tuo X,et al.Novel strategy to engineer trachea cartilage graft with marrow mesenchymal stem cell macroaggregate and hydrolyzable scaffold[J].Artif Organs,2010,34(5):426-433.
[6]Wajsfisz A,Makridis KG,Naji O,et al.An anterior ankle arthroscopic technique for retrograde osteochondral autograft transplantation ofposteromedial and centraltalar dome cartilage defects[J]. Knee Surg Sports Traumatol Arthrosc,2013[Epub ahead of print].
[7]Hangody LR,Gál T,Szucs A,et al.Osteochondral allograft transplantation from a living donor[J].Arthroscopy,2012,28(8):1180-1183.
[8]Hutmacher DW.Scaffolds in tissue engineering bone and cartilage [J].Biomaterials,2000,21(24):2529-2543.
[9]Lavik E,Langer R.Tissue engineering:current state and perspectives [J].Appl Microbiol Biotechnol,2004,65(1):1-8.
[10]Hollister SJ.Porous scaffold design for tissue engineering[J].Nat Mater,2005,4(7):518-524.
[11]Liu J,Zhao B,Zhang Y,et al.PHBV and predifferentiated human adipose-derived stem cells for cartilage tissue engineering[J].J Biomed Mater Res Part A,2010,94(2):603-610.
[12]Zhao K,Deng Y,Chen JC,et al.Polyhydroxyalkanoate(PHA) scaffolds with good mechanical properties and biocompatibility [J].Biomaterials,2003,24(6):1041-1045.
[13]Deng Y,Zhao K,Zhang XF,et al.Study on the three-dimensional proliferation of rabbit articular cartilage-derived chondrocytes on polyhydroxyalkanoate scaffolds[J].Biomaterials,2002,23(20):4049-4056.
[14]Ye C,Hu P,Ma MX,et al.PHB/PHBHHx scaffolds and human adipose-derived stem cells for cartilage tissue engineering[J]. Biomaterials,2009,30(26):4401-4406.
[15]Jacobs T,Morent R,Geyter ND,et al.Plasma surface modification of biomedical polymers:influence on cell-material interaction[J]. Plasma Chem Plasma Process,2012,32(5):1039-1073.
[16]Mirmohammadi SA,Khorasani MT,Mirzadeh H,etal.Investigation of plasma treatment on poly(3-hydroxybutyrate)film surface:characterization and invitro assay[J].Poly Plast Technol Eng, 2012,51(13):1319-1326.
[17]Mei N,Zhou P,Pan LF,et al.Biocompatibility of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate)modified by silk fibroin [J].J Mater Sci Mater Med,2006,17(8):749-758.
[18]杨大志,郝杰,郑启新.多肽对生物材料表面修饰的研究现状[J].国外医学:生物医学工程分册,2004,27(2):65-68.
[19]葛泉波,何淑兰,毛津淑,等.生物材料与细胞相互作用及表面修饰[J].化学通报,2005(1):43-48.
[20]Shin YM,Shin H,Lim YM.Surface modification of electrospun poly(L-lactide-co-?-caprolactone)fibrous meshes with a RGD peptide for the controlof adhesion,proliferation and differentiation ofthe preosteoblastic cells[J].Macromol Res,2010,18(5):472-481.
[21]Salinas CN,Cole BB,Kasko AM,et al.Chondrogenic differentiation potential of human mesenchymal stem cells photoencapsulated within poly(ethylene glycol)-arginine-glycine-aspartic acidserine thiol-methacrylate mixed-mode networks[J].Tissue Eng, 2007,13(5):1025-1034.
Biocompatibility of Human Nasal Septal Chondrocytes on PHBHHx Coated with PhaP-RGD Fusion Peptide
CHANG Huimin1,GAO Tianxi2,WANG Zhenghui2,LU Xiaoyun3,WU Baojun2,ZHANG Xianghong2.1 Department of Otolaryngology,Affiliated Hospital of Xi'an Medical University,Xi'an 710077,China;2 Department of Otolaryngology& Head and Neck Surgery,The Second Affiliated Hospital of Xi'an Jiaotong University,Xi'an 710004,China;3 Xi'an Jiaotong University School of Life Science&Technology,Xi'an 710049,China.Corresponding author:WANG Zhenghui(E-mail: ehui4298@163.com).
ObjectiveTo explore the biocompatibility of PHBHHx biomaterial coated with PhaP-RGD fusion protein on human nasal septal chondrocytes.MethodsThe human nasal septal chondrocytes were cultured and seeded onto the PHBHHx biomaterials modified with PhaP-RGD fusion protein in vitro.The biocompatibility of modified PHBHHx on human nasal septal chondrocytes was detected by MTT assay,DAPI staining,scanning electron microscopy and toluidine blue staining.ResultsThe contact angle of modified PHBHHx was smaller and the surface hydrophilicity increased;The human nasal septal chondrocytes on modified maintained a high proliferation rate.The viability of chondrocytes on modified PHBHHx film was significantly higher than that on PHBHHx film and cell culture plate.It is discovered that PHBHHx film coated with PhaP-RGD can promote the secretion of extracellular matrix of cartilage--glycosaminoglycan by toluidine blue staining.ConclusionPHBHHx coated with PhaP-RGD fusion protein has better biocompatibility on chondrocytes,and is an ideal scaffold material for cartilage tissue engineering.
PhaP-RGD fusion protein;Poly(3-hydroxybutyrate-co-3-hydroxyhexanoate); Human nasal septal chondrocytes;Tissue-engineered cartilage
Q813.1+1
A
1673-0364(2013)06-0319-05
2013年9月16日;
2013年11月5日)
10.3969/j.issn.1673-0364.2013.06.005
国家自然科学基金资助项目(81000416);中央高校基本科研业务费专项资金(西安交通大学国际合作类,交叉学科类);西安交通大学第二附属医院人才培养基金[RC(XM)201102];西安交通大学第二附属医院重点项目基金[YJ(ZD)201103]。
710077陕西省西安市西安医学院附属医院耳鼻喉科(常会敏);710004陕西省西安市西安交通大学第二附属医院耳鼻咽喉-头颈外科(高天喜,王正辉,吴宝俊,张向红);710049陕西省西安市西安交通大学生命科学与技术学院(卢晓云)。
王正辉(E-mail:ehui4298@163.com)。

