氧化石墨烯对大鼠骨髓间充质干细胞生物活性的影响
王 洁 刘加强 房 兵 王羽希 杨 志
氧化石墨烯对大鼠骨髓间充质干细胞生物活性的影响
王 洁 刘加强 房 兵 王羽希 杨 志
目的探讨氧化石墨烯对体外培养的大鼠骨髓间充质干细胞生物学活性的影响。方法采用改良Hummers法制备氧化石墨烯,将不同浓度的氧化石墨烯溶液与大鼠骨髓间充质干细胞共培养,检测其对细胞增殖和形态的影响,相关结果采用SAS V8软件进行统计学分析。结果经表征分析,改良Hummers法可以成功制备出高纯度的氧化石墨烯。在细胞密度较低时,氧化石墨烯对大鼠骨髓间充质细胞的分裂增殖有抑制作用;而在细胞密度较高,达到生长接触抑制的浓度时,氧化石墨烯具有促进细胞死亡,降低活性细胞数量的作用。连续镜下观察后发现,氧化石墨烯对细胞形态有显著影响,可使细胞伸展性下降,折光率降低。这些细胞形态的变化与氧化石墨烯的浓度呈正相关。结论氧化石墨烯可抑制大鼠骨髓间充质干细胞的生物学活性,其作用呈浓度依赖性。
氧化石墨烯大鼠骨髓间充质干细胞生物学活性
石墨烯(Graphene)是一类单原子层二维原子晶体,于2004年首次从石墨中分离获得[1],其丰富而优异的电学、力学和热学性能[2]使其成为近年来纳米材料领域的研究热点。氧化石墨烯(Graphene oxide,GO)是生物医学领域应用较多的石墨烯衍生物之一,运用Hummer方法[3],由石墨经化学氧化、过滤提纯和超声分散等步骤制备获得[4]。GO表面带有大量含氧活性基团,具有良好的生物相容性,并有利于对其表面进行化学功能化修饰。根据已有文献报道,GO具有促细胞黏附和促细胞因子聚集的作用,并能够介导干细胞定向分化,在组织工程和再生医学中具有广泛的应用前景[5]。本研究旨在探讨GO对体外培养的大鼠骨髓间充质干细胞生物学活性的影响。
1 材料与方法
1.1 材料、试剂和仪器
石墨(500目,青岛天元石墨公司);硝酸钠、高锰酸钾、过氧化氢、氯化钡、硝酸银(国药集团化学试剂有限公司);α-MEM培养基(Hyclone公司,美国);胎牛血清、胰蛋白酶(Gibco公司,美国),CCK-8试剂盒(Dojindo公司,日本);单克隆抗体CD-29PE、CD44PE、CD45PE、CD90PE(eBioscience公司,美国)。其余生化试剂都为进口分析纯试剂。
原子力显微镜(Veeco公司,美国);透射电子显微镜(JEOL公司,日本);CO2恒温孵箱(ThermoForma公司,美国);ELx800uv型酶联免疫检测仪(Bio-Tek公司,美国)。
1.2 方法
1.2.1 GO的制备与鉴定
GO由改良Hummers法制备获得。制备方法如下:将2 g石墨与50 m L浓硫酸于250 m L烧瓶中混合后强力搅拌30 min,加入5 g无水硝酸钠(NaNO3),将混合物冰浴冷却至0°C以下,继续搅拌2 h,1 h内分三次缓慢加入7.3 g高锰酸钾(KMnO4),体系温度因反应上升至35℃。反应持续2 h后,用0.2 L冰水和7 mL 30%过氧化氢(H2O2)将反应淬灭。合成的GO用3%HCl溶液清洗、过滤,直至BaCl2溶液中无BaSO4沉淀析出。用水进一步洗涤,确保氯化物检测中AgNO3显示阴性。最后,将产物放入真空干燥箱,40℃下烘24 h,得到GO样品。
1.2.2 大鼠骨髓间充质干细胞的分离培养及鉴定
将两只3周龄SD大鼠(由上海交通大学附属第九人民医院动物实验中心提供)脱颈处死后,75%乙醇浸泡15 min。于无菌条件下逐层切开皮肤、皮下组织,分离肌肉组织,取出大鼠股骨、胫骨、桡骨和肱骨,剔净肌肉组织。剪碎骨组织放入离心管,加入含双抗(100 U/m L青霉素、100μg/m L链霉素)、10% FBS的α-MEM培养基,反复吹打至骨片发白为止,用40μm细胞筛网进行过滤。所获的细胞悬液接种于T75培养瓶中,恒温孵箱(5%CO2、100%湿度、37℃恒温)中培养,每3天更换一次培养液。密切观察细胞生长情况,细胞达到80%以上融合时,用2.5 g/L的胰酶消化,按1∶3传代培养。取3~4代细胞用于后续实验。
采用流式细胞技术检测细胞表面标志抗原的表达,对大鼠BMSCs进行鉴定。取第2代BMSCs,0.25%胰酶消化,1 000 r/min离心5 min,PBS洗涤细胞3次,细胞计数,每上机样本细胞量约为5×106个。每管样品用500μL PBS重悬细胞,分别加入单克隆抗体CD29PE、CD44PE、CD45PE和CD90PE,每管样品设置同型阴性对照,室温避光孵育45 min,PBS洗涤细胞1次以去除未结合抗体,300μL PBS重悬细胞,流式细胞仪上机检测。
1.2.3 实验分组及处理
实验共分8组。将GO超声振荡溶解于去离子水,配置成浓度为10 mg/m L的储存液。实验组GO浓度为0μg/m L(对照组)、3.125μg/m L、6.25μg/m L、12.5μg/m L、25μg/m L、50μg/m L、100μg/m L的α-MEM对大鼠BMSCs进行培养。另设单纯培养基孔为空白对照。
1.2.4 GO对大鼠骨髓间充质干细胞增殖的影响(CCK-8法)
1.2.4.1 高细胞密度
取生长状态良好的第3代BMSCs,以5×103个/孔的密度接种于96孔培养板中,每孔加入100μL培养基。接种好的96孔培养板置于恒温孵箱(5%CO2、100%湿度、37℃恒温)中培养24 h,待细胞贴壁后分别加入终浓度为0μg/mL、3.125μg/mL、6.25μg/mL、12.5μg/mL、25μg/mL、50μg/mL、100μg/mL的GO培养基对大鼠BMSCs进行培养,每组设置6个复孔。分别在加药后0~4 d,随机取出一块96孔培养板进行CCK-8检测。为排除GO对吸光度可能的影响,加入CCK-8试剂前先用PBS洗涤2遍并更换新鲜培养基,再加入10μL/孔的CCK-8试剂,充分混匀。置于恒温孵箱中继续孵育2 h后,在推荐波长450 nm下测定吸光度(OD),另设波长630 nm为参考波长。以时间为横轴,OD值为纵轴绘制曲线。
1.2.4.2 低细胞密度
取生长状态良好的第3代BMSCs,以2×103个/孔的密度,按GO浓度梯度依次接种于96孔培养板中。实验方法同1.2.4.1。
1.2.5 GO对大鼠骨髓间充质干细胞形态的影响
取生长状态良好的第3代BMSCs,以1×105个/孔的密度接种于6孔板中,24 h细胞贴壁后,分别加入终浓度为3.125μg/mL、6.25μg/mL、12.5μg/mL、25μg/mL、50μg/mL和100μg/mL的含GO培养基,进行连续镜下观察。
1.2.6 统计学分析
运用SAS V8软件对所得数据进行方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 GO的检测鉴定
本实验中GO采用改良Hummers方法[3]制备,我们的前期实验已经进行了报道[6~8]。原子力显微镜照片可以看出,石墨烯纯度很高,呈片层结构。由其高度分布图可知,本实验制得的氧化石墨厚度约为1.2 nm,与文献报道的单层氧化石墨高度接近[9]。由此说明,我们通过改良Hummers法所得到的氧化石墨烯为单层结构。透射电子显微镜照片可以看出氧化石墨烯呈薄片结构,边缘有些卷曲,这种卷曲可能是由于引入了大量含氧官能团,造成边缘区域大量缺陷的存在,而边缘区域由于极大的活性需要通过卷曲来维持系统能量的稳定(图1)。
2.2 大鼠骨髓间充质干细胞的培养及鉴定
大鼠BMSCs原代细胞接种72 h后首次换液,去除部分不贴壁细胞。3 d后再次换液,非黏附细胞基本被去除。约1周后BMSCs可形成明显的细胞克隆,经分离纯化至第3~4代时,细胞形态趋于一致,呈多角形或长梭形,折光率高,且增殖活力较强。
流式细胞仪检测结果显示,培养的第2代大鼠BMSCs均一表达CD29、CD44和CD90,阳性率分别达到99.98%、99.71%和96.71%,显示间充质干细胞特性,而造血干细胞表面标志抗原CD45则接近阴性,阳性率为7.83%。传代能进一步纯化细胞,故后续实验采用第3~5代大鼠BMSCs(图2)。
2.3 不同细胞密度下GO对大鼠骨髓间充质干细胞增殖的影响
在细胞密度较高、达到接触抑制时,低浓度的GO对大鼠BMSCs数量无显著影响,细胞数量维持在稳定和缓慢增长的状态;当GO浓度增至25μg/m L,活性细胞的数量在加药1 d后即出现显著降低。当GO浓度继续增至50和100μg/mL时,其促进细胞死亡的作用更为明显,且具有时间依赖性,即随着处理时间的延长,活性细胞的数量越少。结果说明,在细胞密度较高时,低浓度GO(≤12.5μg/mL)对细胞无明显毒性,但高浓度GO(≥25μg/mL)具有较明显的细胞毒性(图3)。
在细胞密度较低时,较低浓度的GO对大鼠BMSCs的分裂增殖能够产生抑制作用,且具有浓度依赖性,即GO浓度越高,对BMSCs的增殖抑制就越明显。尽管细胞增殖受到GO抑制,但各分组(除100μg/mL浓度组)在加药2 d后均出现峰值,随后逐渐降低。以上结果说明GO抑制细胞增殖(图4)。
2.4 倒置显微镜连续观察
通过对加药后BMSCs的连续观察后发现,不同浓度的GO组镜下均可见GO颗粒,约为10~150μm不等,呈颗粒状零散分布,并可观察到部分颗粒在早期(加药后1~2 d)即在细胞中沉积。在3.125μg/mL、6.25μg/mL和12.5μg/mL低浓度GO下,细胞呈多角形或长梭形贴壁生长,没有出现大批死亡的现象,细胞折光度好,与对照组无明显差异。而在25μg/mL和50μg/mL较高浓度时,大鼠BMSCs形态较对照组及低浓度组而言老化明显,活性细胞数量减少,细胞伸展性和折光度变差,形态发生皱缩或呈扁平状,立体感消失。此外,在加药后3 d和4 d,GO颗粒发生聚积,细胞进一步皱缩或老化,并可见漂浮的死细胞。而在低GO浓度下,细胞能保持良好形态。
综上所述,通过连续镜下观察后发现,低浓度GO对细胞形态影响不明显,高浓度GO对细胞形态有显著影响,且细胞形态与GO浓度和处理时间呈正相关(图5、6)。
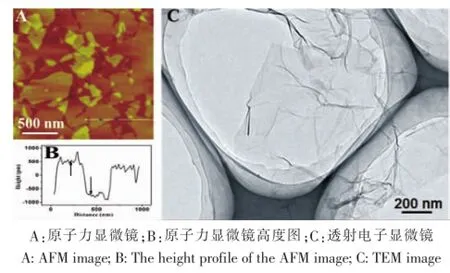
图1 氧化石墨烯的表征。Fig.1 The characterization of GO
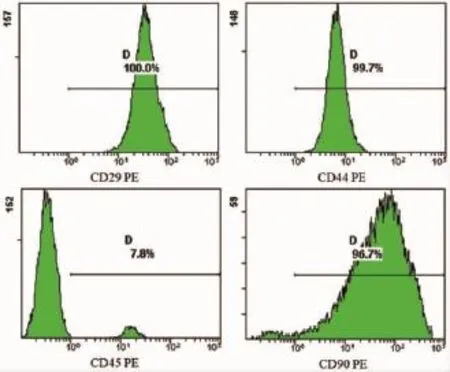
图2 大鼠间充质干细胞表面标志物的表达Fig.2 Expression of surface markers of rat bone mesenchymal stem cells

图3 高细胞密度下,不同浓度GO处理后大鼠BMSCs增殖曲线Fig.3 The growth curve of rat BMSCs co-cultured with different doses of GO under high cell density
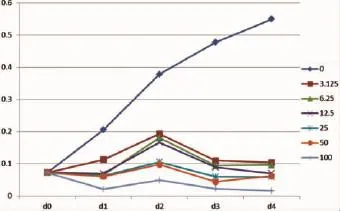
图4 低细胞密度下,不同浓度GO处理后大鼠BMSCs增殖曲线Fig.4 The growth curve of rat BMSCs co-cultured with different doses of GO under low cell density
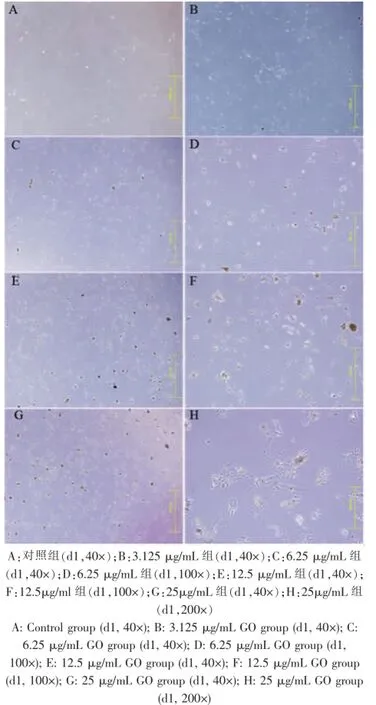
图5 BMSCs形态学观察Fig.5 Morphological observation of rat BMSCs

图6 BMSCs形态学观察Fig.6 Morphological observation of rat BMSCs
3 讨论
GO作为一种具有独特理化性质的新型纳米材料,已成为物理及材料领域的研究热点,而在生物医学方面的应用才刚刚起步。GO含大量含氧活性基团,具有超强的吸附力和良好的生物相容性,可发生多种共价反应和非共价反应,而且能对其进行功能化修饰,在载药、缓释、靶向治疗和生物检测方面具有广泛的应用前景[10]。目前,有关GO体外细胞毒性的研究甚少。较为一致的观点是,GO对细菌有毒性作用,但对细胞有无毒性及毒性的临界浓度意见不一。目前,GO对细胞影响的研究主要集中在其理化性质(如粒径大小、表面电荷、微粒形态、表面功能基团等)对细胞毒性的影响[11]。Liao等研究GO和G对红细胞和人皮肤成纤维细胞的毒性作用后发现,其粒径越小,溶血能力越强[12]。Wang等[13]研究发现,GO和G对人皮肤成纤维细胞的毒性作用具有剂量依赖性和时间依赖性。当GO浓度低于20μg/mL时,对细胞无明显毒性,当浓度大于50μg/mL时表现出明显的细胞毒性,细胞存活率下降并出现凋亡。此结果与本实验结果一致。而Chang等通过观察浓度在10~200μg/mL的GO对人肺癌上皮细胞系A549的体外毒性后发现,GO对人肺癌上皮细胞系A549毒性微弱,即使最高浓度组(200μg/mL)也能观察到细胞存活率达80%[14]。
本实验主要对GO的制备及两种细胞密度下大鼠BMSCs对GO的生物学反应进行研究。改良Hummers法是最为常用的GO制备方法[3],此法能获得官能团丰富、水溶性良好的GO,纯度高,厚度仅1.2 nm,为单层结构,制备过程安全、简便且价廉,为GO的生物学应用创造了良好条件[6,8,15-16]。本实验在两种细胞密度下通过检测GO对大鼠BMSCs增殖的影响后发现,GO能明显抑制BMSCs增殖,且呈剂量依赖性和时间依赖性。当GO浓度≤12.5μg/mL时,细胞数量无明显变化;当GO浓度>12.5μg/mL时,活细胞数量显著降低。随着处理时间的延长,凋亡细胞数量增多,表明GO能促进细胞凋亡。之后通过对细胞形态的连续镜下观察,也印证了该结果。在加入GO后1 d和2 d,在低浓度GO组(3.125μg/mL、6.25μg/mL、12.5μg/mL)中,大鼠BMSCs细胞形态呈多角形或长梭形,折光性好,未观察到细胞皱缩、裂解等现象,与对照组类似;在高浓度GO组(25和50μg/mL)中,细胞在早期即出现老化表现,细胞立体感逐渐消失,呈现扁平状,折光性变差,形状趋向多样,且漂浮的死细胞明显增多。在加入GO后3 d和4 d,高浓度GO可致细胞进一步老化、凋亡,细胞毒性作用明显强于对照组和低浓度GO组,但是低浓度GO组细胞在相同条件下能够保持良好形态。因此,我们有理由认为,12.5μg/mL是氧化石墨烯细胞毒性的临界浓度,当浓度大于12.5μg/mL时可观察到明显的细胞毒性,且与氧化石墨烯剂量和作用时间呈正相关。
综上所述,氧化石墨烯可以抑制大鼠骨髓间充质干细胞的生物学活性,其作用呈浓度依赖性。将其应用到组织工程和再生医学前,需明确其细胞毒性及机制。若能通过某些功能化处理降低氧化石墨烯的细胞毒性,将有助于其在生物医学上的应用。
[1]Novoselov KS,Geim AK,Morozov SV,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666-669.
[2]Meyer JC,Geim AK,Katsnelson MI,et al.The structure of suspended graphene sheets[J].Nature,2007,446(7131):60-63.
[3]Hummers WS,Offeman RE.Preparation of graphitic oxide[J].J Am Chem Soc,1958,80(6):1339.
[4]Chen G,Weng W,Wu D,et al.Preparation and characterizationof graphite nano sheets from ultrasonic powdering technique[J]. Carbon,2004,42(4):753-759.
[5]Lee WC,Lim CH,Shi H,et al.Origin of enhanced stem cell growth and differentiation on graphene and graphene oxide[J]. ACS Nano,2011,5(9):7334-7341.
[6]Hu N,Gao R,Wang Y,et al.The preparation and characterization of non-covalently functionalized graphene[J].J Nanosci Nanotechnol,2012,12(1):99-104.
[7]Gao R,Hu N,Yang Z,et al.Paper-like graphene-Ag composite films with enhanced mechanical and electrical properties[J]. Nanoscale Res Lett,2013,8(1):32.
[8]Yang Z,Gao R,Hu N,et al.The prospective two-dimensional graphene nanosheets:preparation,functionalization,and applications [J].Nano-Micro Lett,2012,4(1):1-9.
[9]Korkut S,Roy-Mayhew J,Dabbs D,et al.High surface area tapes produced with functionalized graphene[J].ACS Nano, 2011,5(6):5214-5222.
[10]程相阵,周毅,姜再兴,等.氧化石墨烯载药性能和生物安全性研究现状[J].生物医学工程与临床,2012,16(4):402-405.
[11]Akhavan O,Ghaderi E,Akhavan A.Size-dependent genotoxicity of grapheme nanoplatelets in human stem cells[J].Biomaterials, 2012,33(32):8017-8025.
[12]Liao KH,Lin YS,Macosko CW,et al.Cytotoxicity of graphene oxideand graphene in human erythrocytes and skin fibroblasts[J]. ACS Appl Mater Interfaces,2011,3(7):2607-2615.
[13]Wang K,Ruan J,Song H,et al.Biocompatibility ofgrapheneoxide [J].Nanoscale Res Lett,2011,6(1):8.
[14]Chang Y,Yang S,Liu J,et al.In vitro toxicity evaluation of grapheneoxide on A549 cells[J].Toxicol Lett,2011,200(3):201-210.
[15]Su Y,Wei H,Gao R,et al.Exceptional negative thermal expansion and viscoelastic properties of graphene oxide paper[J].Carbon, 2012,50(8):2804-2809.
[16]Huang X,Hu N,Gao R,et al.Reduced graphene oxide-polyaniline hybrid:Preparation,characterization and its applications for ammonia gas sensing[J].J Mater Chem,2012,22,22488-22495.(收稿日期:2013年9月28日;修回日期:2013年11月14日)
Preparation of Graphene Oxide and Its Effect on Biological Activity of Rat Bone Marrow Mesenchymal Stem Cells
WANG Jie1,LIU Jiaqiang1,FANG Bing1,WANG Yuxi2,YANG Zhi2.1 Department of Crania&Oral Maxillo-facial Science, Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Key Laboratory for Thin Film and Microfabrication of Ministry of Education,Research Institute of Micro/Nano Science and Technology,Shanghai Jiaotong University,Shanghai 200240,China.Corresponding author:FANG Bing(E-mail: braces_dr@hotmail.com);YANG Zhi(E-mail:zhiyang@sjtu.edu.cn).
ObjectiveTo explore the influences of grapheme oxide(GO)on the biological activity of rat bone marrow mesenchymal stem cells(BMSCs)in vitro.MethodsGraphene oxide was prepared by the modified Hummers method.The GO suspension with different concentration was co-cultured with rat BMSCs and then the effects of GO on cell proliferation and morphological change were investigated.The obtained data was statistically analyzed by SAS V8.ResultsIt was shown that highly purified GO could be prepared by the modified Hummers method by atomic force microscope and transmission electron microscope.It was found that GO could inhibit the proliferation of rat BMSCs with low density.When cell density was high,BMSCs reached the concentration of contact inhibition,GO could increase cell death resulting of the reduction of the living cells.Through continuous microscopy observation,it was discovered that GO had obvious impacts on cell morphology.The extensibility and refractivity of rat BMSCs were positively correlated with the concentration of GO.ConclusionGO can inhibit the biological activity of rat BMSCs with dose dependence.
Graphene Oxide;Rat bone marrow mesenchymal stem cells;Biological activity
Q813.1+1
A
1673-0364(2013)06-0306-06
10.3969/j.issn.1673-0364.2013.06.002
上海科委基础研究领域重点项目(12JC1405700);上海交通大学医工交叉研究基金(YG2012MS40);教育部新世纪优秀人才支持计划资助项目(NCET-12-0356);上海高校特聘教授(东方学者)岗位计划资助项目。
200011上海市上海交通大学医学院附属第九人民医院口腔颅颌面科(王洁,刘加强,房兵);200240上海市上海交通大学微纳科学技术研究院,薄膜与微细技术教育部重点实验室(王羽希,杨志)。
房兵(E-mail:braces_dr@hotmail.com);杨志(E-mail:zhiyang@sjtu.edu.cn)。

