DHA油脂在精炼过程中氧化稳定性的变化
龚东平,韩小军,陈国平,刑光才,王 平,王 飞
(江苏中邦制药有限公司,江苏南京211300)
二十二碳六烯酸(Docosahexaenoic Acid,DHA),俗称脑黄金,属于ω-3系列多不饱和脂肪酸,对人体具有多种优越的生理功效[1-2]。在实际生产应用中,DHA油脂因其高不饱和度,极易氧化产生异腥味,影响味觉和营养[3]。裂殖壶菌发酵产的DHA油脂需依次经历脱胶、碱炼、脱色、脱臭等工序除杂后,才可得到感官品质满足消费者需求的DHA精油。DHA油脂精炼的每个环节所经历的物化条件各异,去除的微组分也各有不同。这些微组分或可充当油脂的抗氧化剂(如酚类物质),或可充当油脂的促氧化剂(如脂质氢过氧化物)[4-5],因此油脂的氧化稳定性在整个精炼过程中呈动态变化。关于微生物DHA油脂在精炼过程中微组分和氧化稳定性的变化目前尚无研究报道。本文将分析裂殖壶菌DHA油脂在精炼过程中磷脂、色素、总酚、FFA、金属离子、脂质氧化产物的变化情况,并采用DPPH法分析DHA油脂中微组分清除自由基的能力,最后以光照法和Rancimat法比较精炼各环节DHA油脂的氧化稳定性,旨在为DHA油脂的科学精炼提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
裂殖壶菌DHA油脂(包括毛油、脱胶油、碱炼油、脱色油、精油) 取自某公司精制车间的同一批次油料。
紫外-可见分光光度计 美国Perkin Elmer公司;GZX-9140电热鼓风干燥箱 上海博迅实业有限公司;Rancimat-743油脂氧化稳定仪 瑞士Metrohm公司。
1.2 精炼各环节DHA油脂微组分变化的测定
精炼各环节的DHA油脂,按照GB5537-1985测定磷脂含量;按照JY/T 015-1996测定铁和铜含量;按照GB/T 5009.37-2003,测定过氧化值(POV)表征一级氧化产物的含量,测定酸价(AV)表征游离脂肪酸(FFA)的含量;采用三氯乙酸萃取法[6]测定其硫代巴比妥酸反应物(TBARS)表征二级氧化产物的含量,结果以丙二醛(MDA)计;采用甲醇萃取油脂中的酚类物质并通过福林酚比色法[7-8]测定DHA油脂中总酚的含量,结果以没食子酸(GAE)计;将DHA油脂溶于正己烷后,采用全波长扫描法[7-8]通过吸光值表征色素的含量;DHA油脂甲酯化后,采用GC分析其脂肪酸组成[9]。
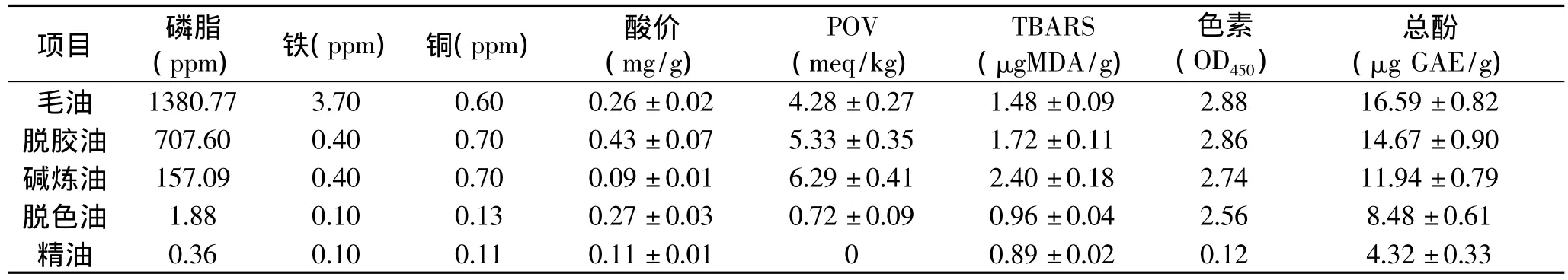
表1 微组分在DHA油脂精炼过程中的变化Table 1 Change of minor compounds in DHA oil during the refining process
1.3 DHA油脂甲醇萃取物清除DPPH·能力
采用甲醇萃取精炼各环节DHA油脂中的微组分后[7-8],按如下方法评价其自由基清除能力[7-8]:取1.5mL甲醇萃取物与1.5mL DPPH试剂(0.15mmol/L,甲醇溶解)混匀后,常温反应30min,以甲醇作空白,于517nm处测定其吸光值,记为 OD1;同理,测定1.5mL甲醇与1.5mL DPPH试剂混合液的吸光值OD0。DPPH清除率按如下公式计算:
DPPH·清除率(%)=[(OD0-OD1)/OD0]×100
1.4 精炼各环节DHA油脂的氧化稳定性
光照加速氧化[8,10]:取精炼各环节的 DHA 油脂各40.0g于100mL具塞三角瓶中,置入同一密闭纸箱(42cm长×32cm宽×32cm高)中,样品上方分别均匀悬挂两只45W三基色白织灯。纸箱密封后置入通风室内,箱内温度维持在(27±1)℃,定时取样测定油样的POV。
Rancimat法加速氧化[10]:准确称取精炼各环节的DHA油脂3.00g置于样品管中,于测定温度80℃、空气流速9L/h的条件下测定DHA油脂氧化所需的诱导时间。
2 结果与讨论
2.1 DHA油脂在精炼过程中的组成变化
油脂中的微组分种类众多且含量较低,本实验选择性地分析了DHA油脂中较为常规的微组分在精炼过程中的含量变化,结果如表1所示。
2.1.1 磷脂在DHA油脂精炼过程中的变化 磷脂的存在会影响油脂的感官品质和氧化稳定性,是一类兼有抗氧化性质和促氧化性质的物质。在有金属离子存在的情况下,由于磷脂中磷酸基团螯合金属离子的作用,磷脂可以发挥抗氧化功效;但在高浓度下,由于磷酸基团的极性,易于富集在油脂表面并降低表面张力,从而吸收油样表面的氧气加速脂质氧化[4]。裂殖壶菌DHA油脂中的磷脂在整个精炼过程中不断减少,到精油时仅存 0.36ppm,去除率达99.9%以上,其中脱胶、碱炼、脱色环节分别除去了48.8%、39.8%、11.2%(表 1)。
2.1.2 金属离子在DHA油脂精炼过程中的变化铁、铜等金属离子可以降低油脂自动氧化诱发期的反应活化能,并且可以促进脂质过氧化合物(ROOH)分解产生脂质自由基(ROO·、RO·),从而加速脂质氧化[4]。分析发现铁离子在DHA毛油中的含量为3.70ppm(表1),脱胶后其含量降至0.40ppm(降低89.2%),分析原因可能是与磷脂结合的铁离子在脱胶环节中随胶质被一并去除。脱色后,DHA油脂中的铁离子降至0.10ppm。铜离子含量在脱色环节以前并无明显变化,保持在0.70ppm左右,脱色后大幅降至0.13ppm。因此可见,在脱色环节中,活性炭等吸附剂可以有效地去除油脂中的金属离子。
2.1.3 FFA在DHA油脂精炼过程中的变化 FFA会使油脂带有刺激性气味而影响油脂的风味和食用价值。当油脂中FFA含量达到一定值时,由于其羧基具有极性,易于富集在油脂的表面并吸收氧气从而加速脂质氧化[4,11],因此在油脂精炼过程中要尽量除掉FFA。本研究将DHA油脂中FFA的含量以酸价(AV)间接表示,从表1可知,脱胶油的AV高于毛油(p<0.05),这可能是油脂在酸性脱胶条件下发生了轻微水解,或是少量磷酸基团残留。碱炼环节去除部分FFA后AV下降(p<0.05),但在后续脱色环节中,由于脱色剂中的酸碱催化剂及油脂中水份的存在,DHA油脂可能发生了轻微水解,从而使脱色油的酸价又有回升(p<0.05)。脱臭环节FFA可以被馏出,DHA油脂 AV降为(0.11±0.01)mg/g,同Jung[12]和 Farhoosh[13]等报道一样,脱臭环节并不能除尽油脂中的FFA或其他酸性小分子。
2.1.4 氧化产物在DHA油脂精炼过程中的变化脂质自动氧化的一级氧化产物(ROOH)会裂解成脂质自由基,进而促进未氧化油脂发生链式氧化;ROOH继续氧化分解产生的醛、酮、酸等小分子,严重地影响油脂的感官品质和氧化稳定性[4]。分析发现,裂殖壶菌DHA油脂的POV和TBARS值在整个精炼过程中的变化趋势一致(表1):自毛油到碱炼油,氧化产物不断增加,原因在于脱胶及碱炼环节系常压加热(70~80℃)操作,在促氧化因素(如空气、金属离子、FFA、热量等)的作用下,油脂发生氧化;后续脱色及脱臭环节系高温(>150℃)真空操作,一级氧化产物ROOH不断分解,二级氧化产物在真空条件不断逸出,使得DHA精油的POV最终降为0。
2.1.5 色素在DHA油脂精炼过程中的变化 油脂中类胡萝卜素的主要吸收波长在430~460nm之间,叶绿素及其衍生物的吸收波长在550~710nm之间[8]。类胡萝卜素因具有淬灭单线态氧分子的作用,可以阻止脂质的光氧化;在低氧分压下(<150mm Hg),类胡萝卜素的共轭双键还可以与脂质过氧自由基(ROO·)形成一种稳定共振的类胡萝卜素自由基从而起到抗氧化作用;与之相反,叶绿素及其衍生物常作为光敏物质,促进脂质发生光氧化[4-5]。全波长扫描发现,裂殖壶菌DHA油脂在波长430~460nm之间有很强的吸光值(图1),说明类胡萝卜素为其主要色素,这与Aki等[14]报道裂殖壶菌富含类胡萝卜素的结论相符合。分析得出,DHA油脂中的色素主要在脱臭环节以热脱色的方式去除,脱色环节效果并不佳。以DHA油脂在450nm处的吸光值为例(表1),从毛油到脱色油,OD450维持在2.56~2.88之间,脱臭后OD450由2.56大幅降至0.12。

图1 DHA油脂-正己烷(1∶6,V/V)混合液的全波长扫描图Fig.1 Visible spectra of DHA oil-hexane(1∶6,V/V)
2.1.6 酚类物质在DHA油脂精炼过程中的变化油脂中的酚类物质不仅影响油脂的感官品质及营养价值,而且有些酚类物质可以向脂质自由基提供自由氢,或者与之结合,从而阻断自由基与未氧化的脂质发生反应,使自动氧化的链式反应终止;有些酚类物质还具有螯合金属子的性质从而起到抗氧化作用[4-5]。从表1可知,裂殖壶菌DHA油脂含有酚类物质,且毛油中含量最高,达到(16.59±0.82)μg GAE/g,但是随着精炼环节的进行,其含量不断降低,到精油时含量已降至(4.32±0.33)μg GAE/g,整个精炼过程降低了74%。
2.1.7 脂肪酸组成在DHA油脂精炼过程中的变化
油脂的脂肪酸组成及其不饱和度是影响其氧化稳定性的内在因素。裂殖壶菌产DHA油脂在整个精炼过程中的脂肪酸组成变化如表2所示。

表2 DHA油脂在精炼过程中脂肪酸组成的变化(面积归一法)(%)Table 2 Change of fatty acid composition(Area percent)during the refining process(%)
分析发现,DHA油脂的脂肪酸组成在整个精炼过程中并无显著变化,DHA含量维持在42%左右,多不饱和脂肪酸总含量维持在68%左右。裂殖壶菌DHA油脂的这种高不饱和度是其易遭受氧化的根本原因。
2.2 DHA油脂甲醇萃取物清除DPPH·的能力
DPPH·是一种在517nm处有特征吸收的稳定自由基,当具有自由基清除能力的抗氧化剂与之反应时,其特征吸收值降低,因此可以用来评价抗氧化剂的活性[15]。实验发现裂殖壶菌DHA油脂的甲醇萃取物具有清除DPPH·能力,说明其中含有内源性的抗氧化剂。从图2可知,DHA油脂的甲醇萃取物清除DPPH·的能力:精油>脱色油>脱胶油>毛油>碱炼油(p<0.05),这一规律与甲醇萃取物中酚类物质的含量并不呈正相关(酚类含量:精油<脱色油<碱炼油<脱胶油<毛油,p<0.05),原因可能是:a.毛油、脱胶油、碱炼油中的杂质过多,影响了酚类等活性物质清除自由基的效果;b.DHA油脂中的部分微组分在后续的脱色及脱臭环节中生成了其他具有清除DPPH·能力的化合物。

图2 DHA油脂甲醇萃取物清除DPPH·的能力Fig.2 DPPH radical-scavenging activity of methanol extracts from DHA oils
2.3 精炼各环节DHA油脂对光稳定性比较
对DHA油脂进行光照加速氧化实验是为了考察其光氧化稳定性。本实验以POV为评价指标,考察精炼各环节的DHA油脂对光稳定性时发现(图3):碱炼油<毛油/脱胶油<脱色油<精油(p<0.05)。结合表1从图中可知,DHA油脂的对光稳定性与其初始的氧化产物含量呈正相关(氧化产物含量:碱炼油 >脱胶油 >毛油 >脱色油 >精油,p<0.05),毛油、脱胶油、碱炼油等虽含有较多的类胡萝卜素,但其脂质氧化产物含量偏高,促氧化因素的作用强于抗氧化因素,因而油脂对光稳定性相对较弱。另外,这三种油脂中还含有其他含量相对较多的微组分(如金属离子、FFA、光敏物质、磷脂等),它们同样对脂质具有促氧化作用[4-5]。
2.4 精炼各环节DHA油脂对热稳定性比较(Rancimat法)
精炼各环节的DHA油脂氧化产物含量相差较大,特别是毛油、脱胶油、碱炼油的POV偏高,采用Schaal烘箱法不能客观地评价这五种油脂的氧化稳定性强弱[10]。因此本实验还采用Rancimat法来比较精炼各环节DHA油脂的相对氧化稳定性。Rancimat法评价油脂氧化稳定性的原理:油脂氧化产生的挥发性小分子(如醛、酮、酸等)导入蒸馏水中,记录电导率的变化情况,根据二阶求导计算出诱导时间(电导率变化最快的时间点),诱导时间越长表明氧化稳定性越强[10]。

图3 DHA油脂对光稳定性比较Fig.3 Comparison of oxidative stability of DHA oils under light
从图4可知,氧化稳定性(诱导时间):碱炼油(0.57h)<毛油(0.74h)<脱胶油(1.18h)<精油(1.47h)<脱色油(2.44h),结合表1分析得出:a.DHA毛油中类胡萝卜素、酚类物质等虽然含量最高,但金属离子、磷脂等促氧化组分含量也相对较高,所以其氧化稳定性并非最高;b.脱胶油比毛油氧化稳定性高,或归因于脱胶环节中去除了大量的金属离子和磷脂;c.碱炼油最不稳定,是因为脂质氧化产物含量最高,且水化后的磷脂、皂角、水分等极性杂质不利于其氧化稳定性;d.脱色油、精油的稳定性高于其他三种油脂,在于上述的促氧化组分在高温脱色及脱臭环节中得以大量去除;e.高温脱臭环节虽然进一步地降低了促氧化组分的含量,但因类胡萝卜素和酚类物质等抗氧化组分大量损失,从而导致精油的氧化稳定性相对降低。

图4 DHA油脂对热稳定性的比较Fig.4 Comparison of thermal stability of DHA oils by the Rancimat method
3 结论
3.1 精炼各环节的DHA油脂在脂肪酸组成上无明显差异,但微组分含量各异,且整体呈下降趋势,从而导致各环节DHA油脂的氧化稳定性有所差异。DHA油脂对光稳定性:精油>脱色油>毛油/脱胶>碱炼油;DHA油脂对热稳定性(Rancimat法):脱色油>精油>脱胶油>毛油>碱炼油。与报道的植物油脂不同,裂殖壶菌DHA毛油并非最稳定,这与其高不饱和度以及内源性微组分有关。毛油、脱胶油、碱炼油虽然在酚类物质、类胡萝卜素含量上远高于脱色油和精油,但是因为含有较高的促氧化微组分(如磷脂、FFA、皂角等),特别是脂质氧化产物和金属离子,从而使其氧化稳定性低于后两者。DHA油脂甲醇萃取物清除DPPH的效果也间接支持了这一结论。
3.2 脱胶及碱炼环节系常压加热操作,由于空气的介入,加之油脂中含有较多的促氧化组分,导致DHA油脂在这两环节会发生氧化。鉴于DHA油脂的高不饱和度和高附价值,这两环节可在充氮条件下进行。后续的脱色和脱臭环节,改善了DHA油脂的品质并提高了氧化稳定性,但若片面寻求感官品质,导致精炼过度,使大量具有抗氧化活性的微组分被去除,会降低DHA精油的氧化稳定性[5],因此脱色和脱臭是优化DHA油脂氧化稳定性的关键环节。
[1]Baum S J,Hamm A.Fatty Acids and their derivatives in cardiovascular disease:arachidonic, eicosapentaenoic, and docosahexaenoic acids and their Byproducts,the eicosanoids and Docosanoids[J].Curr Cardiovasc Risk Rep,2012,6:146-154.
[2]Connor W E.Importance of n-3 fatty acids in health and disease[J].Am JClin Nutr,2000,71:171S-175S.
[3]朱丽娜,张志国,张敏,等.DHA的生理功能及其在食品中的稳定性[J].中国乳品工业,2009,37(2):45-48.
[4]Akoh C K,Min D B.Food lipids:chemistry,nutrition,and biotechnology[M].Florida:CRC Press,2008.
[5]龚东平,陈园力,张红漫,等.裂殖弧菌DHA油脂纯化后的氧化稳定性[J].食品科学,2011,32(11):79-82.
[6]李桂华.油料油脂检验与分析[M].北京:化学工业出版社,2006.
[7]Abuzaytoun R,Shahidi F.Oxidative stability of flax and hemp oils[J].J Am Oil Chem Soc,2006,83(10):855-861.
[8]Abuzaytoun R,Shahidi F.Oxidative stability of algal oils as affected by their minor components[J].JAgric Food Chem,2006,54(21):8253-8260.
[9]金立晶,任路静,纪晓俊,等.海洋真菌产油脂中DHA含量的准确快速测定[J].生物加工过程,2010,8(4):67-71.
[10]AOCS.Official methods and recommended practices of the american oil chemists’ society[M].6th ed.AOCS Press:Champaign,2009.
[11]龚东平,胡耀池,张红漫,等.游离脂肪酸对DHA油脂氧化稳定性的影响[J].食品与发酵工业,2010,36(11):30-33.
[12]Jung M Y,Yoon SH,Min D B.Effects of processing steps on the contents of minor compounds andoxidation of soybean oil[J].J Am Oil Chem Soc,1989,66(1):118-120.
[13]Farhoosh R,Einafshar S,Sharayei P.The effect of commercial refining steps on the rancidity measures of soybean and canola oils[J].Food Chem,2009,115:933-938.
[14]Aki T,Hachida K,Yoshinaga M,et al.Thraustochytrid as a potential source of carotenoids[J].J Am Oil Chem Soc,2003,80:789-794.
[15]Awika J M,Rooney L W,Wu X,et al.Screening methods to measure antioxidant activity of sorghum(Sorghum bicolor)and sorghum products[J].JAgric Food Chem,2003,51:6657-6662.

