泛素连接酶LNX1促进外源PBK的泛素化和降解
王小蓉,郭正光,高友鹤
(中国医学科学院基础医学研究所生理与病理生理系医学分子生物学国家重点实验室,北京100005)
Ligand of Numb protein X 1(LNX1)蛋白是LNX泛素连接酶家族的4个成员之一,其N末端有一个催化RING结构域,C末端串联4个PDZ结构域。最初的研究发现LNX1作为一个RING类的泛素连接酶,催化NUMB的泛素化并导致其被蛋白酶体降解[1]。其后,Claudin1、Claudin2、Claudin4[2]、c-src[3]和CD8α[4]也被鉴定是LNX1的底物。除了作为泛素连接酶催化底物泛素化的功能外,LNX1还被报道通过它的1个或多个PDZ结构域与许多细胞内重要蛋白相互作用,如 c-src[3]、Claudins[2]、RhoC[5]、KCNA4[6]、PAK6[6]、PLEKHG5[6]、PKC-alpha1[6]、TYK2[6]、PDZ-binding kinase(PBK)[6]和 CD8α[4]等。LNX1参与多种信号通路[1-2],还与肿瘤的发生密切相关[3,7]。
PBK是一个丝氨酸/苏氨酸蛋白激酶[8],在肿瘤的生长和发育过程中发挥作用[9-12]。PBK的C末端具有PDZ结构域结合模体(motif)。本实验以前的研究利用酵母双杂交体系发现LNX1PDZ1结构域结合PBK的C末端序列,另一个实验也用免疫共沉淀证实PBK和LNX1在细胞内相互作用[6]。
在实验中,一系列重组人LNX1截断体蛋白和LNX1全长蛋白被分别克隆、表达和纯化,在体外泛素化体系中研究了其对PBK的泛素化;进而在细胞内研究了LNX1对PBK的泛素化和降解,为深入研究LNX1的功能提供了重要线索。
1 材料与方法
1.1 材料
1.1.1 质粒、DNA模板、菌种和细胞:LNX1的PCR模板 IMAGE克隆(IMAGE:4995278)和 PBK的PCR模板IMAGE克隆(IMAGE:4082846)(Proteintech Group公司)。
原核表达质粒载体PGEX-4T-1和PET-41a+为本实验室保存。真核表达质粒载体pcDNA4/MYC-his为本实验室保存。pcDNA6由医科院基础所强伯勤教授课题组提供。HA-ubiquitin载体由首都医科大学李汇华教授惠赠。
大肠杆菌菌株BL21和BL21(DE3)(全式金公司)。HEK293ET细胞由本实验室保存。
1.1.2 试剂、抗体和酶:GSTrap FF(1 mL)(GE Healthcare公司)。MagExtractor(His-tag)(TOYOBO公司)。
E1(Calbiochem公司),E2(重组UbcH5b蛋白)(UpState公司)。His-ubiquitin(Sigma-Aldrich公司)。
转染试剂MegaTran 1.0 Transfection Reagent(OriGene 公司)。protein G-agarose beads,MG132(Beyotime公司)。RIPA lysis buffer(Applygen公司)。
抗体:anti-S-tag(Abcam公司);anti-Flag-tag(DYKDDDDK),anti-beta-Tubulin(Abmart公司);anti-MYC-tag(MBL公司);anti-HA-tag(Imagen BioSciences公司)。
1.2 方法
1.2.1 表达载体的构建:
1)原核表达载体的构建:分别设计引物,以IMAGE克隆(IMAGE:4995278)为模板,将 LNX1全长、LNX1ΔPDZ4(1~600aa)、LNX1ΔPDZ34(1 ~ 497aa)、LNX1ΔPDZ234(1~377aa)和 LNX1ΔPDZ1234(1~273aa)PCR扩增出来,PCR产物用BamHⅠ和EcoRⅠ酶切,连接到PGEX-4T-1载体上,转化大肠杆菌中,挑取单克隆,PCR鉴定,最后送交公司测序确定编码序列和读码框架无误。所有LNX1及其截断体N末端融合GST标签。
将编码PBK蛋白C末端8个氨基酸残基(-VEALETDV)的寡聚核苷酸链化学合成,克隆到PET41a+载体的 C末端(酶切位点HindⅢ和XhoⅠ),作为人工底物的表达载体。编码PBK蛋白C末端的人工底物的N末端融合S-tag和His-tag标签。
2)真核表达载体的构建:设计引物,以IMAGE克隆(IMAGE:4995278)为模板,将LNX1全长PCR扩增出来,PCR产物用BamHⅠ和XbaⅠ双酶切,连接到 pcDNA4/MYC-His载体上;设计引物,以IMAGE克隆(IMAGE:4082846)为模板,将PBK全长PCR扩增出来,PCR产物用BamHⅠ/XhoⅠ双酶切,连接到pcDNA6载体上。连接产物分别转化大肠杆菌中,挑取单克隆,PCR鉴定,最后送交公司测序确定编码序列和读码框架无误。LNX1真核表达载体的C末端融合MYC-His标签;PBK真核表达载体的N末端融合Flag标签。
1.2.2 重组LNX1和人工底物的表达和纯化:GSTLNX1的表达和纯化:分别将测序正确的LNX1全长、LNX1ΔPDZ4、LNX1ΔPDZ34、LNX1ΔPDZ234、LNX1ΔPDZ1234和 PGEX4T-1空载体转化到 BL21感受态细胞中,分别挑取单克隆,摇菌扩增至 A value=0.8左右,分别加入0.1 mmol/L IPTG 16~26℃诱导蛋白表达过夜,收集细胞,超声破碎,离心去沉淀,上清液用GSTrap FF纯化表达蛋白,SDSPAGE电泳,考马斯亮蓝染色分析蛋白纯化效果;纯化的蛋白用Bradford法定量。
人工底物表达和纯化:将人工底物转化到BL21(DE3)感受态细胞中,挑取单克隆,摇菌扩增至A value=0.8左右,加入0.2 mmol/L IPTG 30℃诱导蛋白表达4~6 h,收集细胞,超声破碎,离心去沉淀,菌体上清液用Mag Extractor(His-tag)试剂盒富集表达蛋白。
1.2.3 体外泛素化实验:体外泛素化体系包括以下成分:0.1μg E1(Calbiochem),0.5μg E2(重组UbcH5b)(UpState),1μg E3(纯化的不同截断体的LNX1 蛋白),2 mmol/L ATP,3 μg His-ubiquitin(Sigma-Aldrich), 50 mmol/L Tris-HCl(pH 7.4),2.5 mmol/L MgCl2,1 mmol/L DTT,100 ng底物,反应体系用去离子水补齐至20μL。在30℃反应90 min后,用5×SDS(十二烷基硫酸钠)上样缓冲液终止反应。反应产物95℃处理5 min,反应混合物用SDS-PAGE分离,用anti-S-tag抗体进行蛋白免疫印迹分析。泛素化的底物和未泛素化的底物分别用Image J定量并计算标准化比值。
1.2.4 细胞内泛素化和降解实验:真核表达质粒用MegaTran 1.0转染试剂转染至HEK293ET细胞中。转染后24~48 h收获细胞,用RIPA裂解液裂解(含2 mmol/L PMSF),离心去沉淀。细胞裂解液上清中加入相应的抗体,4℃孵育过夜。免疫复合物结合到protein G琼脂糖凝胶珠孵育1~3 h,琼脂糖凝胶珠用冷PBS洗3次,加入5×SDS(十二烷基硫酸钠)上样缓冲液,95℃处理10 min。处理后的蛋白样品用SDS-PAGE分离,用相应的抗体免疫印迹分析。免疫沉淀下的泛素化蛋白和PBK分别用Image J定量并计算标准化比值。在检测蛋白降解的实验中,澄清的细胞裂解液直接通过SDS-PAGE分离,用相应的抗体免疫印迹。在需要蛋白酶体抑制剂的实验中,转染的细胞在收获前用10μmol/L的MG132处理10~22 h。PBK和内参分别用Image J定量并计算标准化比值。
2 结果
2.1 蛋白质表达的纯化
纯化重组LNX1蛋白和其截断体的结果如图1所示,纯化后的 GST-LNX1ΔPDZ1234、GST-LNX1ΔPDZ234、GSTLNX1ΔPDZ34、GST-LNX1ΔPDZ4 和 GST-LNX1 蛋白分子量分别为 55、70、100、115 和约130 kd,均与理论分子量接近。
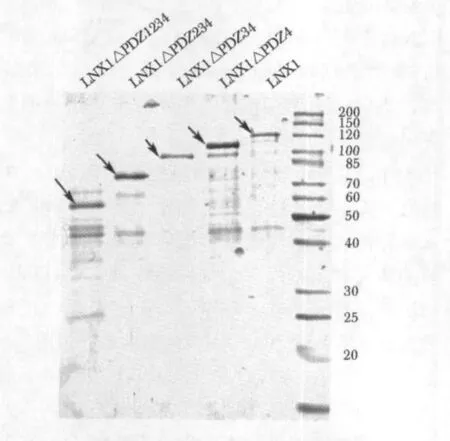
图1 纯化后的LNX1截断体和LNX1全长蛋白Fig 1 Purification of the LNX1 truncations for the in vitro ubiquitination assays
2.2 体外泛素化实验
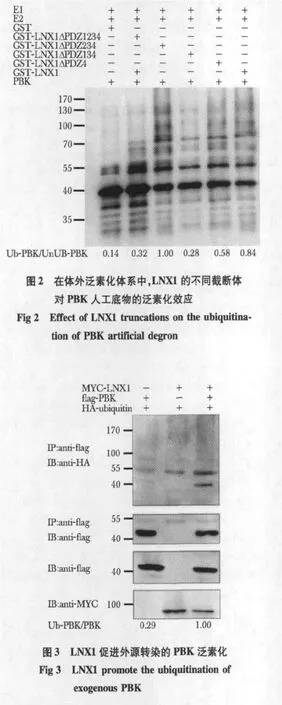
PBK在本实验室中已经证实是LNX1PDZ1的配体蛋白。在体外泛素中,相对于LNX1ΔPDZ1234,含有PDZ1的LNX1ΔPDZ234可以显著地促进含有PBK的C末端的人工底物泛素化(图2)。含有PDZ1的所有 LNX1截断体和 LNX1全长都能使PBK的人工底物泛素化。只含有 PDZ1的LNX1ΔPDZ234对PBK的泛素化最强,而含有更多PDZ的LNX1截断体和LNX1全长对PBK的泛素化程度相对减弱。
2.3 细胞内泛素化实验
在体外泛素化实验中,LNX1通过识别PBK的C末端促进其泛素化。在哺乳动物细胞内,相对于单独表达LNX1和PBK,共表达LNX1和PBK后,PBK在高分子区段产生更明显的泛素化链(图3)。
2.4 LNX1促进蛋白酶体降解PBK
细胞内蛋白的泛素化通常导致其被蛋白酶体降解[1]。在HEK293ET细胞中,LNX1的过表达显著导致外源转染的PBK的降解,当细胞用10μmol/L的蛋白酶体抑制剂MG132处理22 h后,PBK的降解被明显地抑制(图4)。

图4 LNX1促进外源转染的PBK通过蛋白酶体途径降解Fig 4 LNX1 promotes the proteosomal degradation of exogenous PBK
3 讨论
这项实验利用体外泛素化体系和哺乳动物细胞体系发现了LNX1泛素化PBK并导致外源转染的PBK被蛋白酶体降解。在体外泛素化的实验中,所有含有PDZ1结构域的LNX1截断体都能够泛素化含有PBK的C末端的人工底物。这一结果说明LNX1通过PDZ1识别PBK的C末端并促进其泛素化。而含有更多 PDZ结构域的 LNX1ΔPDZ34、LNX1ΔPDZ4和LNX1全长对PBK的泛素化程度反而降低,这可能是由于LNX1其他PDZ结构域产生了空间位阻效应,阻碍了其与底物通过LNX1PDZ1的相互识别。通过实验还发现,不含有任何PDZ的LNX1ΔPDZ1234也能够使PBK人工底物微弱泛素化,其可能原因是,LNX1ΔPDZ1234含有催化结构域RING,由于体外泛素化体系浓度较高,LNX1ΔPDZ1234与人工底物彼此靠近,虽不通过PDZ与C末端相互作用,也能部分地发生泛素化反应。然而含有PDZ结构域的LNX1截断体对上述人工底物的泛素化程度更强,这仍能够说明PDZ结构域参与了对底物的识别。
LNX1已报道的主要功能是做为E3泛素化底物或作为分子支架将多种蛋白结合在一起,参与不同的生物学过程。如LNX1参与调节Notch信号通路[1];参与细胞紧密连接的重组[2];参与 AP-1 信号传导过程[5]。在 LNX1 knock down 的细胞中,β-catenin、MAPK、NF-κB 和 C-MYC 信号通路被激活,P53和TGF-β依赖的信号通路被抑制,细胞周期被阻断在 G0/G1期[13]。LNX1还与肿瘤的发生有关[3,7]。LNX1的更多底物和更多功能仍需进一步研究。
上述实验鉴定了PBK是LNX1的潜在底物。PBK是一个丝氨酸/苏氨酸蛋白激酶[8],在多种肿瘤的生长和发育过程中发挥作用[9-12]。已有报道PBK可以促进肿瘤细胞的存活,抵抗化疗药物(如阿霉素)诱导的细胞凋亡[9-10]。根据实验结果推测,LNX1可能通过泛素化和降解肿瘤相关蛋白PBK,调节细胞的生长和凋亡,进而参与肿瘤的发生。这需要更多的深入研究来证实,如RNAi、细胞生长曲线和细胞凋亡实验等。这项研究工作为进一步全面系统深入地研究LNX1的功能奠定基础。
[1]Nie J,McGill MA,Dermer M,et al.LNX functions as a RING type E3 ubiquitin ligase that targets the cell fate determinant Numb for ubiquitin-dependent degradation[J].EMBO J,2002,21:93 -102.
[2]Takahashi S,Iwamoto N,Sasaki H,et al.The E3 ubiquitin ligase LNX1p80 promotes the removal of claudins from tight junctions in MDCK cells[J].J Cell Sci,2009,122:985-994.
[3]Weiss A,Baumgartner M,Radziwill G,et al.c-src is a PDZ interaction partner and substrate of the E3 ubiquitin ligase Ligand-of-Numb protein X1[J].FEBS Lett,2007,581:5131-5136.
[4]D Agostino M,Tornillo G,Caporaso MG,et al.Ligand of Numb proteins LNX1p80 and LNX2 interact with the human glycoprotein CD8alpha and promote its ubiquitylation and endocytosis[J].JCell Sci,2011,124:3545 -3556.
[5]Zheng D,Sun Y,Gu S,et al.LNX(Ligand of Numb-protein X)interacts with RhoC,both of which regulate AP-1-mediated transcriptional activation[J].Mol Biol Rep,2010,37:2431-2437.
[6]Wolting CD,Griffiths EK,Sarao R,et al.Biochemical and computational analysis of LNX1 interacting proteins[J].PLoSOne,2011,6:e26248.
[7]Chen J,Xu J,Zhao W,et al.Characterization of human LNX,a novel ligand of Numb protein X that is downregulated in human gliomas[J].Int J Biochem Cell Biol,2005,37:2273-2283.
[8]Gaudet S,Branton D,Lue RA.Characterization of PDZ-binding kinase,a mitotic kinase[J].Proc Natl Acad Sci USA,2000,97:5167-5172.
[9]Park JH,Lin ML,Nishidate T,et al.PDZ-binding kinase/T-LAK cell-originated protein kinase,a putative cancer/testis antigen with an oncogenic activity in breast cancer[J].Cancer Res,2006,66:9186-9195.
[10]Ayllon V,O'Connor R.PBK/TOPK promotes tumour cell proliferation through p38 MAPK activity and regulation of the DNA damage response[J].Oncogene,2007,26:3451-3461.
[11]Oh SM,Zhu F,Cho YY,et al.T-lymphokine-activated killer cell-originated protein kinase functions as a positive regulator of c-Jun-NH2-kinase 1 signaling and H-Ras-induced cell transformation[J].Cancer Res,2007,67:5186-5194.
[12]Zhu F,Zykova TA,Kang BS,et al.Bidirectional signals transduced by TOPK-ERK interaction increase tumorigenesis of HCT116 colorectal cancer cells[J].Gastroenterology,2007,133:219-231.
[13]Zheng D,Gu S,Li Y,et al.A global genomic view on LNX siRNA-mediated cell cycle arrest[J].Mol Biol Rep,2011,38:2771-2783.

