截短ALT1蛋白的获得及其多克隆抗体的制备
谌海兰,王 鹏,黄美容,胥文春
(1.重庆医科大学临床检验诊断学教育部重点实验室,重庆400016;2.河南省人民医院核医学科,河南郑州450003;3.遵义医学院附属医院输血科,贵州遵义563003)
丙氨酸氨基转移酶(alanine aminotransferase,ALT)是一种以磷酸吡哆醛为辅基的酶,其在体内可逆地催化L-丙氨酸和α-戊二酸转化为L-谷氨酸和L-丙酮酸,通过调节这4类物质的量而在糖与氨基酸的相互转化过程中发挥重要作用。由于ALT在肝脏中的含量较血清中高1 000倍以上,因此肝脏损伤时血中ALT水平增高显著,是目前临床评价肝脏功能最灵敏的一个指标。近年来发现ALT有3种同功酶,ALT1、ALT2 和 ALT2-2[1]。ALT1 与 ALT2 有共同催化活性,而ALT2-2未发现有催化活性[2]。ALT1主要分布于肝、肾和骨骼肌中;ALT2主要分布在骨骼肌和心肌细胞中,而在肝脏和肾脏组织中未见表达[3],因此血清中ALT1水平比总ALT能更特异的反映肝脏功能状态[4-7]。但由于ALT1和ALT2有共同催化活性,所以很难用酶法将二者分别测定,而ALT属于蛋白质,因此首选检测方法是免疫学法[8]。
生物信息学分析[9]发现,ALT1的N端1~115个氨基酸序列含有免疫原性较高的两个抗原表位,这115个氨基酸序列与ALT2及ALT2-2全长相似性75%左右,但在生物信息学分析具有较强免疫原性的2段表位序列,与ALT2及ALT2-2均不存在同源性。因此本实验拟通过原核表达系统制备含ALT1 N端1~115个氨基酸序列的ALT1截短蛋白并制备其多克隆抗体,为ALT1免疫学体外诊断试剂的研发提供原料,为肝脏疾病的诊断和鉴别诊断提供了依据。
1 材料与方法
1.1 材料
1.1.1 试剂:DNA纯化试剂盒、HindⅢ、NdeⅠ、DNA聚合酶、连接酶(Takara公司);DNA胶回收试剂盒(Invitrogen公司);质粒提取试剂盒(Omiga公司);弗氏佐剂(Sigma公司);其他试剂均为分析纯;实验用水为Millipore纯净水。
1.1.2 质粒,菌株:pCold TF载体(金斯瑞生物公司),HRV 3C蛋白酶(本室自制),大肠杆菌E.Coli BL21(DE3)(本室保存)。
1.1.3 动物:清洁级新西兰大白兔,体质量约2.0 kg,来源于重庆医科大学实验动物中心并于中心处代养[合格证号SCXK(渝)2007-0001]。
1.2 方法
1.2.1 截短ALT1原核表达载体的构建:以本研究前期构建的含ALT1全长序列的质粒PGEX4T-2-ALT1(已经过基因测序且序列正确)为模板,采用上游引物:5'-CTGGGTAGACATATGGCCTCGAGCACA GGTGAC-3'(含NdeⅠ酶切位点),下游引物:5'-CC CCAGCTGAAGCTTCAACACGCCTGCAAGATGCGCT C-3'(含HindⅢ酶切位点),扩增ALT1的N端1~115个氨基酸编码序列,加上酶切位点共354 bp。将目的基因片段插入pCold TF载体,转化入大肠杆菌BL21(DE3),经菌液PCR、质粒PCR、双酶切鉴定后进行DNA测序。
1.2.2 截短 ALT1融合蛋白的表达:重组质粒pCold TF-ALT1构建成功后,于LB液体培养基中经IPTG(终浓度0.5 mmol/L)诱导表达,16℃,16 h。以4℃,8 000 r/m离心收集细菌,用PBS重悬,超声破菌:功率200 W,超声3 s暂停5 s,工作时间30 min/L菌。4℃,12 000 r/m,离心30 min收集上清,经0.22μm滤膜过滤后用于后续纯化。
1.2.3 截短ALT1融合蛋白的纯化:镍柱亲和层析纯化重组蛋白后,再经HRV 3C蛋白酶切,比例:重组蛋白:HRV3C(w:w)=4~10∶1,4℃酶切过夜。再用镍离子亲和柱去除标签蛋白,收集穿透液,超滤浓缩至浓度大于20 g/L后采用分子筛纯化,SDSPAGE分析蛋白纯度。
1.2.4 截短ALT1多克隆抗体的制备:免疫前取兔耳缘静脉血测本底效价,选取无效价新西兰大白兔用于免疫。首次免疫方案:300μg/只,蛋白与等量弗氏完全佐剂乳化后,于腹股沟、背部、皮下多点注射免疫。7 d后,再次免疫,剂量及方法同首次免疫。首次免疫后第28天蛋白与弗氏不完全佐剂加强免疫。首次免疫后第35天经兔耳缘静脉取血,间接ELISA检测抗体效价,经颈动脉插管放血,离心分离血清,于-80℃保存备用。
1.2.5 多克隆抗体的纯化:兔血清用蛋白A抗体纯化柱纯化后用ELISA方法测效价,以SDS-PAGE分析蛋白纯度,分装后-80℃保存。
2 结果
2.1 目的基因扩增
以质粒PGEX4T-2-ALT1为模版,经PCR扩增后,可见在350 bp左右有一明显的条带(图1),与预期基因片段长度相符。

图1 PCR扩增ALT1基因Fig 1 PCR products for ALT1 gene
2.2 重组质粒鉴定
2.2.1 菌液PCR:重组质粒转化入大肠杆菌BL21(DE3),经抗生素筛选后,挑取8株菌行菌液PCR鉴定。结果显示,除8号菌外均于350 bp处出现明显的条带(图2),与预期相符。阴性克隆命名为BL21/pCold TF-ALT1。

图2 菌液PCR鉴定重组质粒Fig 2 Identification of recombinant plasmidsin BL21/pCold TF-ALT1
2.2.2 重组质粒双酶切及DNA测序:重组质粒经HindⅢ、NdeⅠ双酶切,在约350 bp处可见一酶切片段(图3),大小与预期相符,经DNA测序证明序列正确。
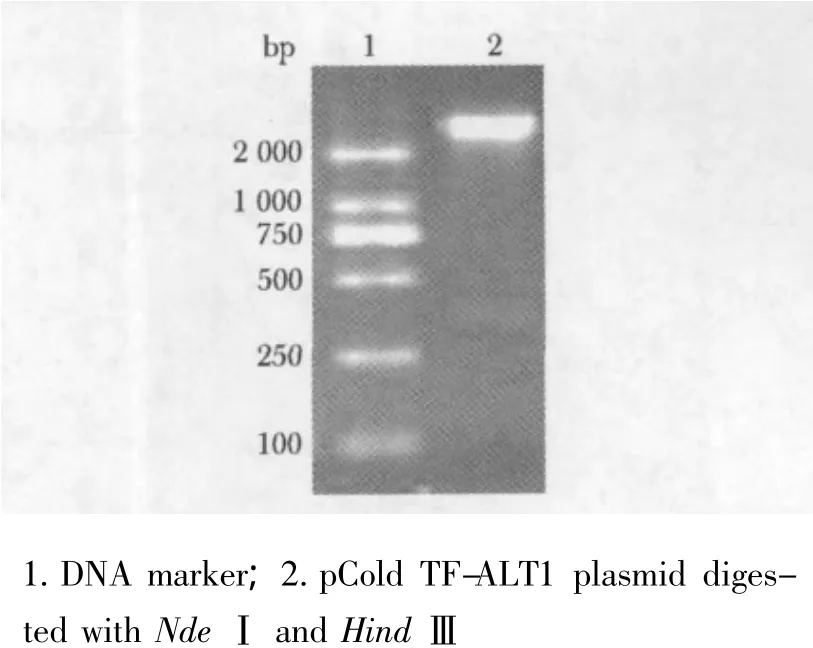
图3 pCold TF-ALT1质粒双酶切鉴定Fig 3 Identification of pCold TF-ALT1plasmid with enzyme digested
2.3 截短ALT1蛋白表达及可溶性分析
BL21/pCold TF-ALT1经IPTG诱导表达,以转pCold TF空载(BL21/pCold-TF)做诱导前后对照。重组融合蛋白分子质量约70 ku(pCold TF标签蛋白约54 ku,目的蛋白ALT1约16 ku),结果显示上清中存在该蛋白,表明该蛋白为可溶性表达(图4)。
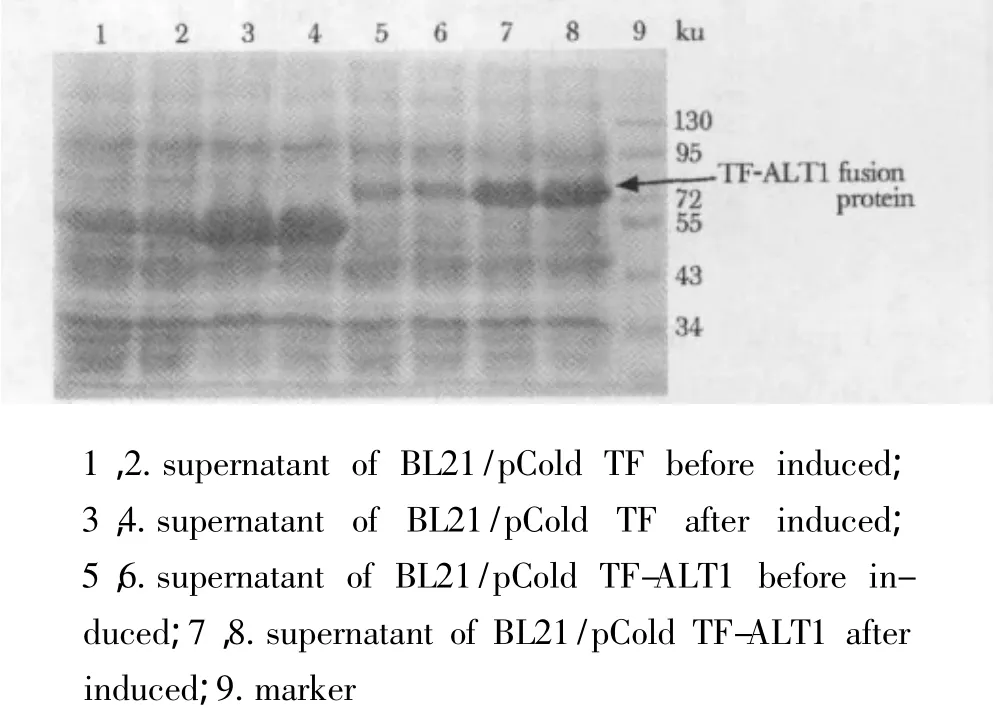
图4 pCold TF-ALT1重组蛋白表达Fig 4 Recombinant protein from supernatant of BL21/pCold TF-ALT1 analyzed by SDS PAGE
2.4 重组蛋白的纯化
2.4.1 截短TF-ALT1融合蛋白镍柱亲和层析纯化:重组蛋白大量表达经镍柱层析纯化,得到含标签的重组融合蛋白,约70 ku(图5)。
2.4.2 HRV 3C酶切融合蛋白:重组融合蛋白TFALT1经HRV 3C蛋白酶酶切,得到含无标签截短ALT1蛋白、HRV 3C蛋白酶和TF标签的混合酶切产物(图6)。2.4.3 分子筛纯化无标签ALT1蛋白:融合蛋白去除TF标签蛋白后,再经分子筛纯化,得到不含标签的截短ALT1纯蛋白,纯度大于90%(图7)。经多步纯化,最后每升菌可获无标签蛋白5 mg。
2.5 截短ALT1抗血清制备及纯化
免疫新西兰大白兔后,经ELISA检测,其抗血清效价可达4×106。采用蛋白A柱纯化兔多克隆抗体,经SDSPAGE鉴定,可见重链于55 ku左右,轻链于25 ku左右(图8)。
2.6 抗血清的鉴定
纯化后的抗体经Western blot鉴定,与TF标签蛋白、正常人血清无反应,与乙型肝炎病患者血清及HepG2人肝癌细胞裂解液反应,与重组表达的截短ALT1蛋白反应(图9)。
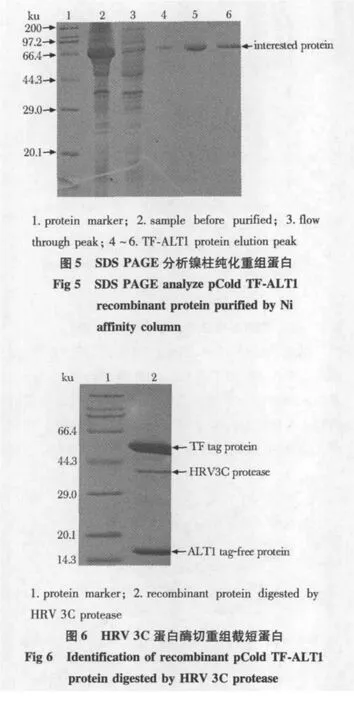
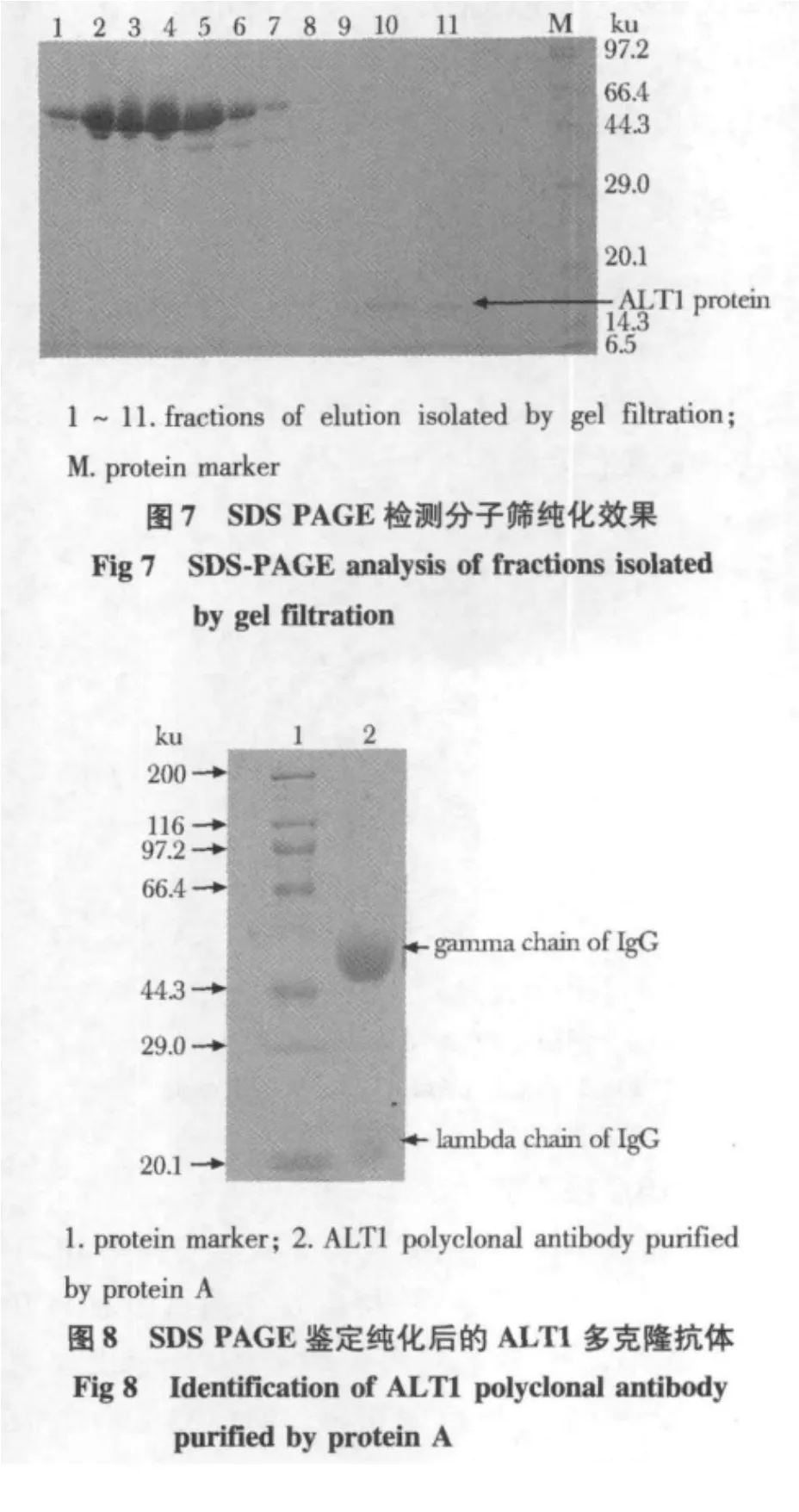
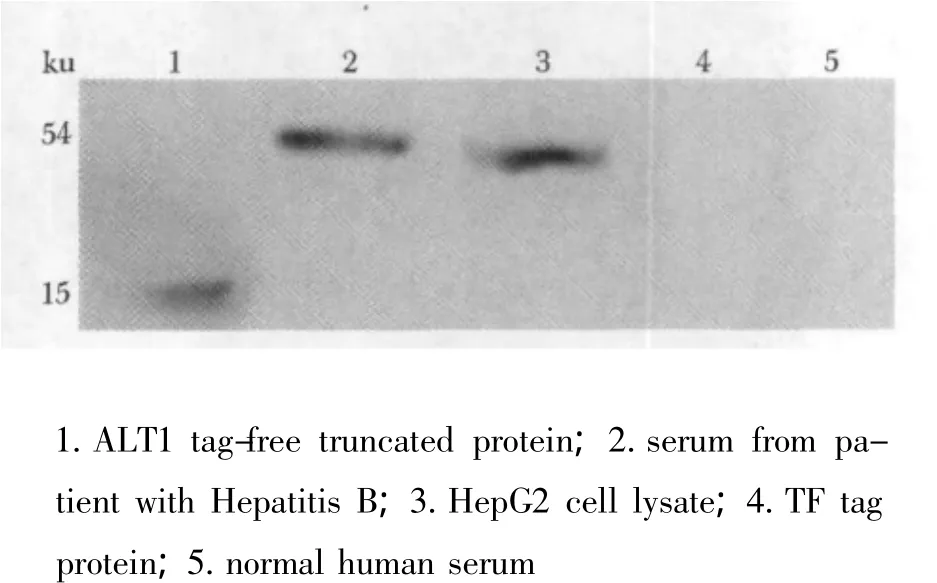
图9 Western blot鉴定ALT1多克隆抗体特异性Fig 9 Identification of ALT1 polyclonal antibody by Western blot
3 讨论
如前言所述,ALT1的质量检测比ALT总酶活性的检测能更特异的反映肝细胞损伤,因此免疫学检测是今后的发展方向。
本研究前期通过多次尝试,拟表达全长ALT1蛋白,然后制备其多克隆抗体和单克隆抗体。但通过pET32a(+),pET28a(+)等多种载体均未能表达出产量高、可溶的全长ALT1蛋白。通过多种B细胞抗原表位预测软件分析,从表面可及性、转角及线性结构、柔韧性、亲水性和抗原性等方面筛选免疫原性强的抗原表位,发现在ALT1的N端1~115个氨基酸序列内包含两个易暴露、具空间可及性等免疫原性较强的抗原表位(MASSTGDRSQAVRHG和NPDLLSSPNFPDDAKK),且这2个位点氨基酸序列与人和鼠体内的蛋白均无较高的同源性。而经验表明,直接用肽段免疫难以获得高效价和高亲和力的抗体。因此用表达含这2个表位肽的N端115个氨基酸,制备其抗体。将该序列DNA片段插入pCold TF载体质粒,转入大肠杆菌经IPTG诱导,表达出大量、可溶的ALT1融合蛋白,经HRV 3C蛋白酶酶切,将ALT1蛋白和TF标签蛋白切开,通过二次镍柱纯化和高分辨能力的分子筛纯化得到不含标签及其他杂蛋白的截短ALT1纯蛋白。
截短ALT1蛋白免疫新西兰大白兔制备的多克隆抗体可与乙肝病人血清及高分泌ALT的肝癌细胞HepG2裂解液反应,而与正常人血清和标签蛋白无反应,表明该血清有较高特异性。本实验获得的无标签蛋白作为较纯的免疫原,由于没有分子质量较大的标签蛋白形成空间位阻,可以被机体更好的识别。
高质量的ALT1抗原和特异的多克隆抗体的获得为ALT1的免疫学检测试剂的研发提供了依据。
[1]Toshio O,Yutaka S,Tetsuo N,et al.Complete sequencing and characterization of 21,243 full-length human cDNAs[J].Nature Genetics,2004,36:40-45.
[2]Glinghammar B,Rafter I,Lindstrom A,et al.Detection of the mitochondrial and catalytically active alanine aminotransferase in human tissues and plasma[J].Int J Mol Med,2009,23:621-631.
[3]Lindblom P,Rafter I,Copley C,et al.Isoforms of alanine aminotransferases in human tissues and serum-differential tissue expression using novel antibodies[J].Arch Biochem Biophys,2007,466:66-77.
[4]Josef O,Marcia R,Martin S,et al.The current state of serum biomarkers of hepatotoxicity[J].Toxicology,2008,245:194-205.
[5] Georgina PR,Cristina A,Laura OL,et al.Paralogous ALT1 and ALT2 retention and diversification have generated catalytically active and inactive aminotransferases in saccharomyces cerevisiae[J].PLoS One,2012,7:e45702.doi:10.1371/journal.pone.0045702.
[6]Yang RZ,Park S,Reagan WJ,et al.Alanine aminotransferase isoenzymes:molecular cloning and quantitative analysis of tissue expression in rats and serum elevation in liver toxicity[J].Hepatology,2009,2,49:598-607.
[7]Rafter I,Gråberg T,Kotronen A,et al.Isoform-specific alanine aminotransferase measurement can distinguish hepatic from extrahepatic injury in humans[J].Int J Mol Med,2012,11,30:1241-1249.
[8]Li Liu,Shao Zhong,Rongze Yang,et al.Expression,purification,and initial characterization of human alanine aminotransferase(ALT)isoenzyme 1 and 2 in High-five insect cells[J].Protein Expr Purifi,2008,8,60:225-231.
[9]张维铭.现代分子生物学实验手册[M].2版.北京:科学出版社,2003:412-477.

