宫颈小细胞癌14例临床分析
金 滢,蒋 湘,李 艳,黄惠芳,吴 鸣,沈 铿,潘凌亚
(中国医学科学院北京协和医院妇产科,北京100730)
宫颈小细胞癌是一种较为罕见的原发于宫颈的神经内分泌性肿瘤,仅占宫颈恶性肿瘤的不足3%[1]。该病理类型恶性程度极高,和宫颈鳞癌及腺癌相比,预后极差,据文献报道分期>Ⅰb1的患者少有生存超过30个月者[2]。因此,尽快明确其生物学行为,并找到适当的治疗方法,对于改善宫颈小细胞癌的预后具有重要意义。但是,由于该疾病的少见性,很难募集到足够的病例进行前瞻性的随机对照研究,治疗上往往缺乏循症医学证据,多参照宫颈鳞癌或肺小细胞癌。本研究总结了北京协和医院收治的14例宫颈小细胞癌患者的病例资料,对其临床特点、治疗和预后进行总结,期望对今后宫颈小细胞癌的治疗提供参考。
1 临床资料
自2006年4月至2012年3月,北京协和医院共收治宫颈小细胞癌患者14例(表1),同期收治宫颈癌患者共1 966例。
1.1 一般情况
14例患者年龄26~66岁,中位年龄38岁,13例患者为育龄期,仅1例66岁的患者绝经10年。
1.2 肿瘤分期及转移部位
根据2009年 FIGO分期[3],14例患者中Ⅰb1期为5例,Ⅰb2期3例,Ⅱa2期1例,Ⅱb期2例,Ⅳb期3例。在分期为Ⅳb期的3例患者中,远处转移部位为1例多发肝转移及骨转移,1例肺转移及肝转移,1例肺转移。
1.3 治疗
1.3.1 手术:共11例患者接受手术治疗:分期为Ⅰb1-Ⅱa2的9例患者及1例Ⅱb期患者经先期化疗后,接受了腹腔镜或开腹的根治性子宫切除术±双附件切除术+盆腔(和/或腹主动脉旁)淋巴结清扫术,1例Ⅳb期患者因术前可疑宫颈肌瘤行开腹全子宫切除术。术后病理高危因素包括:肿瘤侵犯宫颈深肌层或全层者8例,淋巴血管间隙受累者3例,阴道切缘阳性者1例,盆腔淋巴结转移者1例。
1.3.2 化疗:所有患者均接受了以顺铂为主的化疗,主要化疗方案为EP(足叶乙甙+顺铂),另有少数患者为PF(顺铂+5-氟尿嘧啶)或TC(紫杉醇+卡铂),有1例患者按照肺小细胞癌接受9周方案化疗,疗程数分别为2~5个。
1.3.3 放疗:参照宫颈鳞癌,有4例Ⅰb1-Ⅱa2期的患者于子宫根治性手术后接受辅助盆腔放疗(外照射+内照射),主要的放疗指征为宫颈深肌层浸润及盆腔淋巴结阳性,放疗同时进行DDP化疗增敏,为4~7次。另1例Ⅱb期及1例Ⅳb期患者接受了根治性盆腔放疗,于放疗前后给予EP方案化疗或TC化疗增敏。
1.4 随访及预后
14例患者随访时间3~51个月,FIGOⅠb1-Ⅱa2期的9例患者中,7例患者无瘤生存,平均随访时间18.2月,中位随访时间14个月。2例FIGOⅠb1期和Ⅰb2期的患者分别于随诊10个月和9个月时发生肺转移。分期为Ⅱb期-Ⅳb期的5例患者中,1例Ⅱb期患者随访19个月时盆腔复发,另4例患者死亡,总生存期5~12个月。
2 讨论
宫颈小细胞癌是一种罕见的宫颈恶性肿瘤,文献报道其发病率占所有宫颈恶性肿瘤的小于3%,在本研究中报道的14例病例共占同期本院宫颈恶性肿瘤的0.7%,与文献报道相符。该病是一种恶性程度很高的恶性肿瘤,预后很差,和其他病理类型相比,患者常早期发生肺、肝、脑、骨和淋巴结等远处转移,因此长期生存率低[4]。本研究也发现该病理类型患者容易早期发生远处转移的特点,在14例患者中,有3例起病时即有肺、肝及骨等远处转移,在治疗后复发的3患者中,2例为肺转移,仅1例为盆腔局部复发。既往文献报道,FIGO分期晚、肿瘤体积大、淋巴结转移、吸烟、宫颈深肌层浸润、年龄大及病理为纯的小细胞癌为预后不良的因素[1,5-6],但近期的两项病例数较多的研究进行多因素分析后,发现FIGO分期是患者预后的独立因素[7-8]。但是,即使对于临床分期ⅠB1-ⅡA的较早期病例,5年生存率也仅有36.8% ~54.0%,远远低于宫颈鳞癌和腺癌,对于晚期患者,没有治愈的可能,Ⅳb期患者5年生存率为0%。在本研究的14例患者中,Ⅱb期以上的5例患者预后均极差,4例患者短期内死亡,存活时间4~15个月,另1例患者存活19个月后肿瘤盆腔复发。由此可见,宫颈小细胞癌的最重要的高危因素是临床期别,本研究中FIGO IB1-ⅡA2期的9例患者中,有7例患者随访过程中无肿瘤复发,而ⅡB期以上的5例患者中,有4例患者死亡。
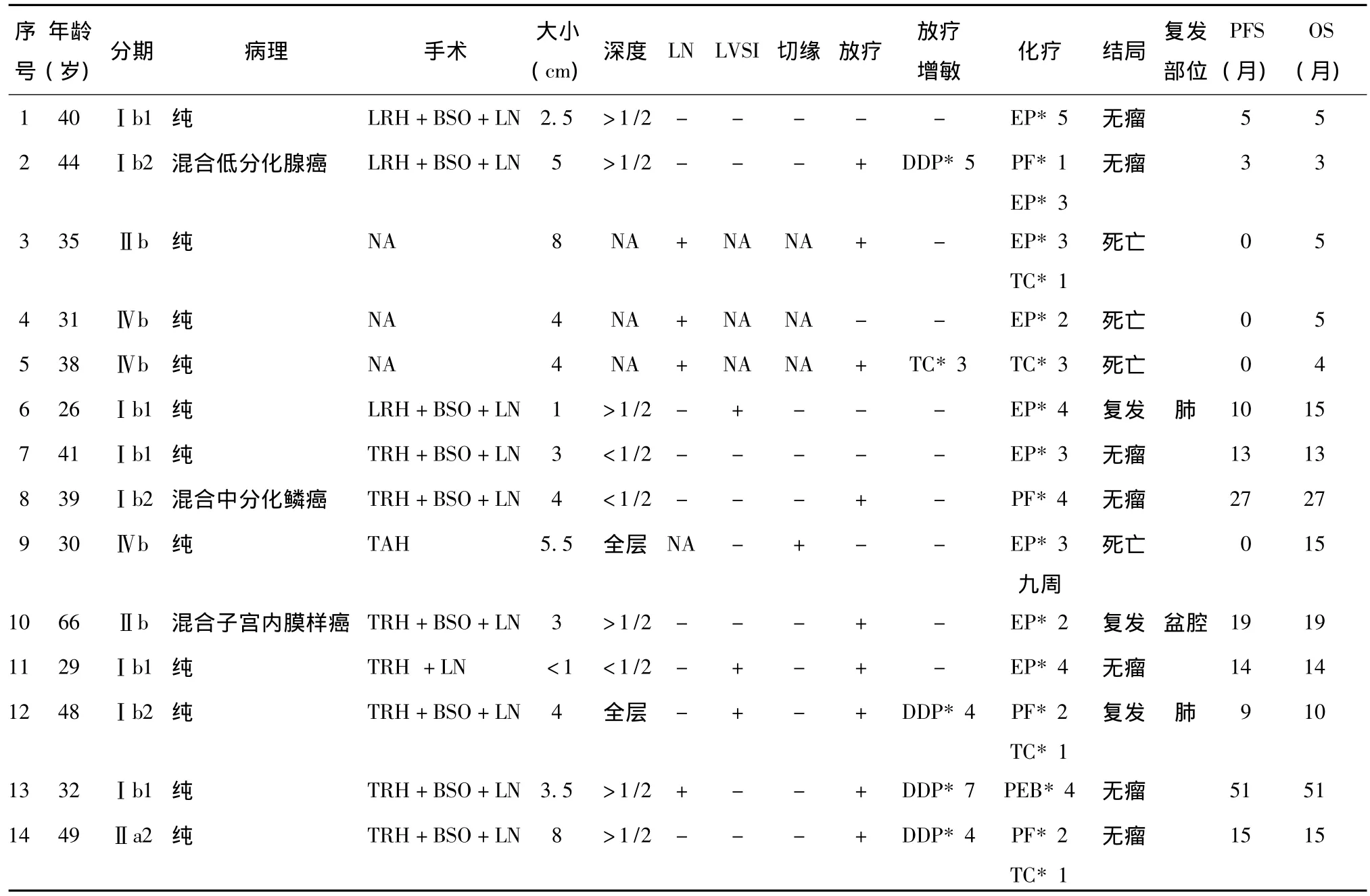
表1 宫颈小细胞癌患者病例资料
病理学上,宫颈小细胞癌的诊断并不困难,其形态上类似于肺小细胞癌,通常由圆形或梭形细胞组成,胞质稀薄,胞核小。多数病例的神经内分泌标志物的免疫组化呈阳性,如NSE、Syn、CgA和CD56。文献报道,约24%的患者肿瘤混合其他病理类型,多为腺癌,而这些混合性病理类型的患者往往预后较好[9]。在本研究中,有3例患者病理混合腺癌或鳞癌,占21.4%,与文献报道相似。混合性病理的患者预后较相同期别的纯的小细胞癌患者为好,在FIGOⅡB期以上的5例患者,唯一存活的患者为混合性神经内分泌癌(小细胞癌+子宫内膜样癌),随访19个月时盆腔复发;另2例混合性病理的患者均为IB2期,分别随访3个月和27个月无肿瘤复发。
鉴于该疾病的少见性,很难募集到足够病例进行临床随机对照研究,因此,目前关于其治疗还缺乏循证医学证据,多是来自单中心的经验,或参考其他病理类型的宫颈癌或小细胞肺癌的治疗。对于宫颈小细胞癌的治疗,目前多数作者认为,应进行多学科的综合治疗,即包括手术、放疗及化疗[6,10-12]。近期,也有尝试在晚期病例中采用新辅助化疗的病例报道[13]。某些研究探讨了根治性子宫切除在宫颈小细胞癌治疗中的作用,但结论不一致。Cohen等[7]总结了多中心的188例宫颈小细胞癌患者的预后资料,发现对于FIGOⅠ-ⅡA期患者,根治性子宫切除术可改善5年生存率(分别为38.2%和23.8%),并且是独立的预后影响因素。但是,在一项台湾 GOG进行的多中心研究中[8],对于 FIGOⅠ-ⅡB期患者,选择临床期别早、年轻、无淋巴结转移及肿瘤直径较小的患者进行手术,结果显示,初治时手术的患者更容易复发。这可能是由于两个中心对手术指征选择及术后辅助治疗的差异造成的。总体来说,由于该肿瘤较易通过血性播撒的特点,即使是早期病例,仅进行局部治疗也是不够的。因此,有必要对此类患者进行全身化疗来兼顾远处转移的治疗。
目前,宫颈小细胞癌的化疗细胞方案通常来自肺小细胞癌。2002年以来,确立了EP方案(足叶乙甙+顺铂)在肺小细胞癌治疗中首选的化疗方案[14]。近期,有作者陆续报道了其他方案的优势。Noda等[15]报道一项临床随机对照研究证实,伊立替康(irinotecan)+顺铂方案在肺小细胞癌治疗中的疗效优于既往的EP方案。但Hanna等[16]未发现此方案的优势。Hermes等[17]报道伊立替康+卡铂的生存率显著优于口服足叶乙甙+卡铂。这些Ⅲ期临床试验提示伊立替康在小细胞癌的治疗中可能优于足叶乙甙。近期,一项来自日本的病例报道也证实了伊立替康+顺铂在宫颈小细胞癌治疗中的作用[13]。另外,多数临床试验选择的化疗疗程数为4~6个,但宫颈小细胞癌化疗疗程数不确定。我国台湾的GOG研究[8]表明,晚期的宫颈小细胞癌患者(FIGOⅡB-Ⅳb期)初治时接受5个以上疗程的EP化疗可获得更长的无进展生存期。
总之,宫颈小细胞癌是一种恶性程度极高的神经内分泌癌,容易早期发生远处转移,预后极差,特别是对于FIGO分期ⅡB期以上的晚期患者,很难获得长期生存,治疗应采用包括手术、放疗和化疗的综合治疗模式。
[1]Crowder S,Tuller E.Small cell carcinoma of the female genital tract[J].Semin Oncol,2007,34:57-63.
[2]Viswanathan AN,Deavers MT,Jhingran A,et al.Small cell neuroendocrine carcinoma of the cervix:outcome and patterns of recurrence[J].Gynecol Oncol,2004,93:27-33.
[3]Pecorelli S,Zigliani L,Odicino F.Revised FIGO staging for carcinoma of the cervix[J].Int J Gynaecol Obstet,2009,105:107-108.
[4] McCusker ME,CotéTR,Clegg LX,et al.Endocrine tumors of the uterine cervix:incidence,demographics,and survival with comparison to squamous cell carcinoma[J].Gynecol Oncol,2003,88:333-339.
[5]Kasamatsu T,Sasajima Y,Onda T,et al.Surgical treatment for neuroendocrine carcinoma of the cervix[J].Int J Gynecol Obstet,2007,99:225-228.
[6]Chan JK,Loizzi V,Burger RA,et al.Prognostic factors in neuroendocrine small cell cervical carcinoma:a multivariate analysis[J].Cancer,2003,97:568-574.
[7]Cohen JG,Kapp DS,Shin JY,et al.Small cell carcinoma of the cervix:treatment and survival outcomes of 188 patients[J].Am J Obstet Gynecol,2010,203:347.e1-6.doi:10.1016/j.ajog.2010.04.019.
[8]Wang KL,Chang TC,Jung SM,et al.Primary treatment and prognostic factors of small cell neuroendocrine carcinoma of the uterine cervix:a Taiwanese Gynecologic Oncology Group study[J].Eur J Cancer,2012,48:1484-1494.
[9]Li JD,Zhuang Y,Li YF,et al.A clinicopathological aspect of primary small-cell carcinoma of the uterine cervix:a single-centre study of 25 cases[J].J Clin Pathol,2011,64:1102-1107.
[10]Delaloge S,Pautier P,Kerbrat P,et al.Neuroendocrine small cell carcinoma of the uterine cervix:what disease?What treatment?Report of ten cases and a review of the literature[J].Clin Oncol,2000,12:357-362.
[11]Chen J,Macdonald K,Gaffney DK.Incidence,mortality,and prognostic factors of small cell carcinoma of the cervix[J].Obstet Gynecol,2008,111:1394-1402.
[12]Lewandowski GS,Copeland LJ.A potential role for intensive chemotherapy in the treatment of small cell neuroendocrine tumors of the cervix[J].Gynecol Oncol,1993,48:127-131.
[13]Nasu K,Hirakawa T,Okamoto M,et al.Advanced small cell carcinoma of the uterine cervix treated by neoadjuvant chemotherapy with irinotecan and cisplatin followed by radical surgery[J].Rare Tumors,2011,3:e6.doi:10.4081/rt.2011
[14]Sundstr∅m S,Bremnes RM,Kaasa S,et al.Cisplatin and etoposide regimen is superior to cyclophosphamide,epirubicin,and vincristine regimen in small-cell lung cancer:results from a randomized phaseⅢtrial with 5 years'follow-up[J].J Clin Oncol,2002,20:4665-4672.
[15]Noda K,Nishiwaki Y,Kawahara M,et al.Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J].New Engl J Med,2002,346:85-91.
[16] Hanna N,Bunn Jr PA,Langer C,et al.Randomized phaseⅢtrial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J].J Clin Oncol,2006,24:2038-2043
[17]Hermes A,Bergman B,Bremnes R,et al.Irinotecan plus carboplatin versus oral etoposide plus carboplatin in extensive small-cell lung cancer:a randomized phaseⅢtrial[J].J Clin Oncol,2008,26:4261-4267.

