妊娠合并宫颈浸润癌14例临床分析
王 巍,金 滢,黄惠芳,沈 铿,向 阳,吴 鸣,潘凌亚
(中国医学科学院北京协和医院妇产科,北京100730)
在妊娠期诊断出恶性肿瘤是临床少见病例,其中常见妇科恶性肿瘤,又以宫颈癌发生率最高。为了与非孕期宫颈癌区分,目前普遍将妊娠期、产时及产后6个月内发现的宫颈癌定义为妊娠相关性宫颈癌(cervical cancer associated with pregnancy)[1]。妊娠合并宫颈癌的处理既要保证肿瘤治疗的及时有效,又要在可能情况下兼顾胎儿的可成活性及患者生育功能的保留,是妇产科医生面临的复杂棘手问题。目前研究者普遍认为妊娠并未对宫颈癌患者的预后产生负面影响,对于早、中孕的宫颈癌患者亦可在满足相应条件下实现延迟治疗而不影响预后[2-3]。但也有报告显示妊娠相关性宫颈癌预后差,认为可能与妊娠期高雌激素水平及盆腔血流丰富加速了肿瘤细胞的扩散和转移有关[4]。目前,对于妊娠合并ⅠA期宫颈微小浸润癌患者的治疗已达成共识,即可延迟治疗至胎儿成熟,不影响预后,而对于ⅠB期及以上患者的治疗仍无统一标准[5]。本研究回顾性分析了14例妊娠合并宫颈浸润癌患者的临床特点、治疗方案及母婴结局,旨在总结经验,为合理选择治疗方案提供依据。
1 资料与方法
1.1 资料来源
回顾性分析自2005年1月至2012年1月北京协和医院收治的所有宫颈癌患者,排除宫颈原位癌及微小浸润癌(ⅠA期),共1 803例,其中与妊娠相关者14例。收集患者年龄、孕产次、肿瘤诊断时孕周、临床症状、诊断方法、FIGO分期、肿瘤大小、组织学类型、分化程度、宫颈肌层浸润深度、肿瘤治疗方案、终止妊娠时机、方式及母婴结局等临床资料,分析妊娠合并宫颈癌患者临床特点及预后情况。
1.2 统计学方法
采用SPSS 17.0软件进行统计学分析。生存分析采用Kaplan-Meier分析,组间差异的P值计算采用log-rank检验。研究终点为患者无瘤生存或复发,生存期的计算以末次随访时间为准。
2 结果
本研究期内宫颈浸润癌患者中合并妊娠的发生率为0.78%,均为妊娠期诊断。
2.1 患者临床特点
14例患者中位年龄为34.5岁(22~43),中位孕次为3次(1~7),中位产次为1次(0~2),其中7例(50%)有生育要求(包括1例已生育一女者,13#)。肿瘤诊断时中位孕周为20+4周(5+5~33+6),其中早孕期4例(29%),中孕期7例(50%),晚孕期3例(21%)。大部分患者(11/14,79%)有接触性出血或孕期出血病史,所有患者均经宫颈活检病理证实为癌。14例患者中,7例(50%)为 FIGOⅠB1期,5例(36%)ⅠB2 期,1例(7%)ⅡA2 期,1 例(7%)ⅡB 期;肿瘤直径<4 cm及≥4 cm者各7例(50%);大部分为鳞癌(10/14,71%),9 例(64%)低分化,2 例(14%)中分化,3例(21%)高分化(表1)。
2.2 治疗方案
所有早孕期(4/4,100%)及绝大部分中孕期(6/7,86%)患者一经诊断即放弃胎儿开始肿瘤治疗,故除1例ⅡB期患者(7#)在行剖宫产术终止妊娠后直接开始放化疗外,其余9例中,8例行开腹根治性子宫切除及盆腔淋巴结清扫术,术中同时悬吊双侧卵巢,1例在子宫动脉插管先期化疗(顺铂联合氟尿嘧啶)1程后自然流产,后行开腹根治性宫颈切除及盆腔淋巴结清扫术(4#)。另外1例中孕27周、镜下ⅠB1期、MRI未显示病灶的患者(11#),延迟治疗至孕37周行剖宫产术分娩,产后42天行宫颈锥切术,病理为宫颈原位鳞癌,切缘净,随诊。3例晚孕期患者中,1例孕29+1周(12#)患者MRI显示病灶局限于宫颈,宫旁及盆腔淋巴结均未见转移,延迟治疗至孕32周行剖宫产术。1例孕29+5周患者(13#)宫颈病灶为带蒂肿物,切除后行先期化疗1程(顺铂联合氟尿嘧啶),于孕34周行剖宫产,术后再次化疗1程后行开腹根治性子宫切除及盆腔淋巴结清扫术。术后病理提示子宫内膜有残余癌,再次行2程化疗后随诊。1例孕33+6周的ⅡA2期患者(14#)行剖宫产分娩后直接放化疗(表2)。
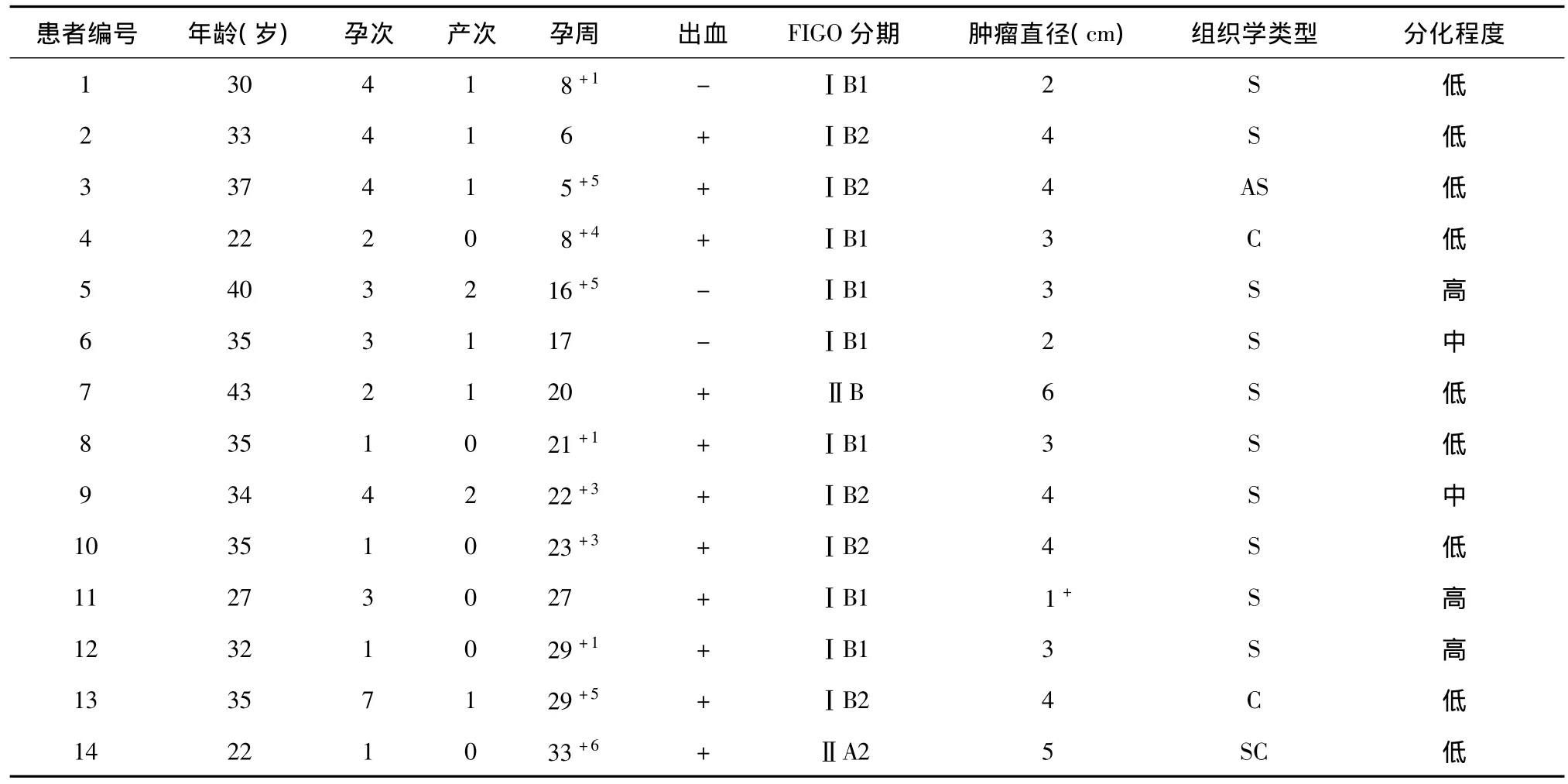
表1 14例妊娠合并宫颈癌患者临床特点
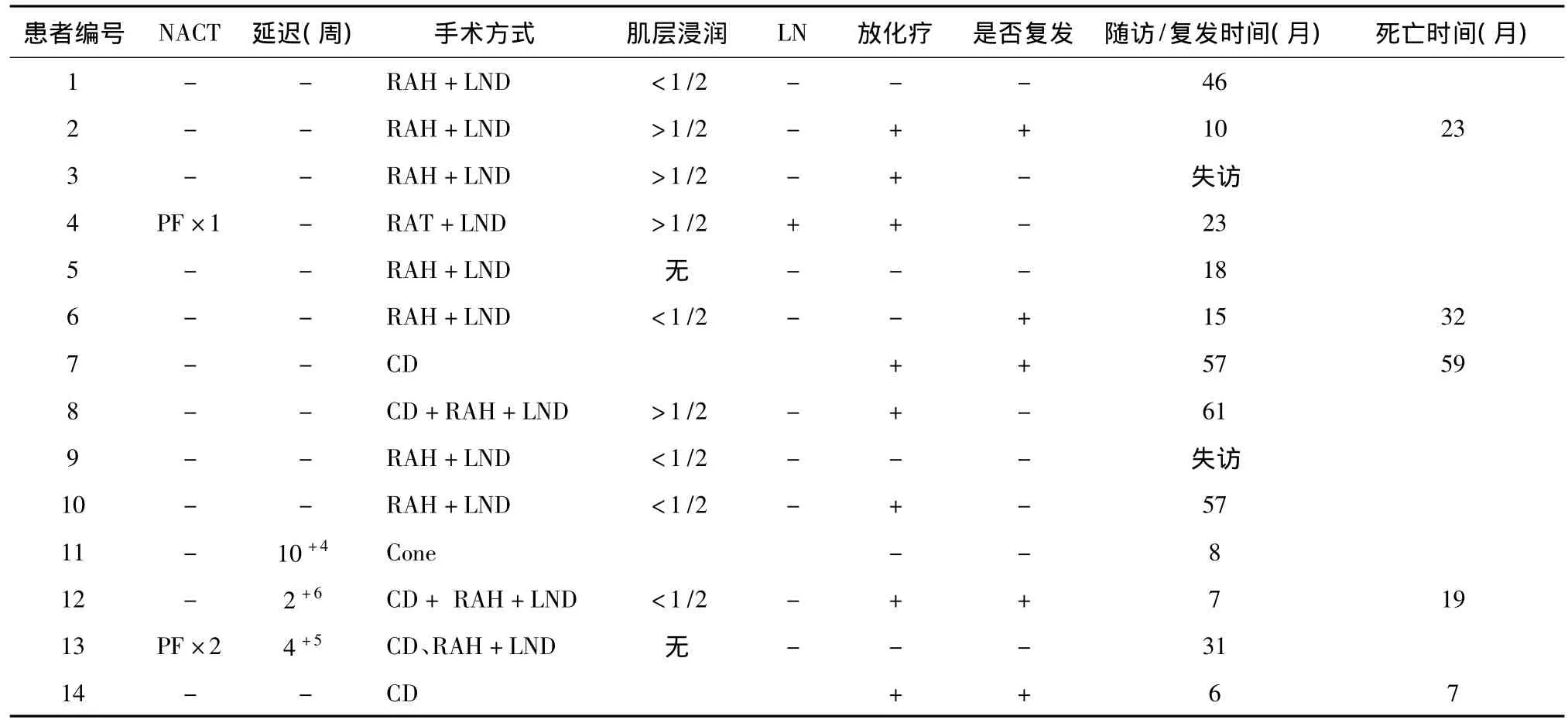
表2 14例妊娠合并宫颈癌患者治疗方案及随诊复发情况
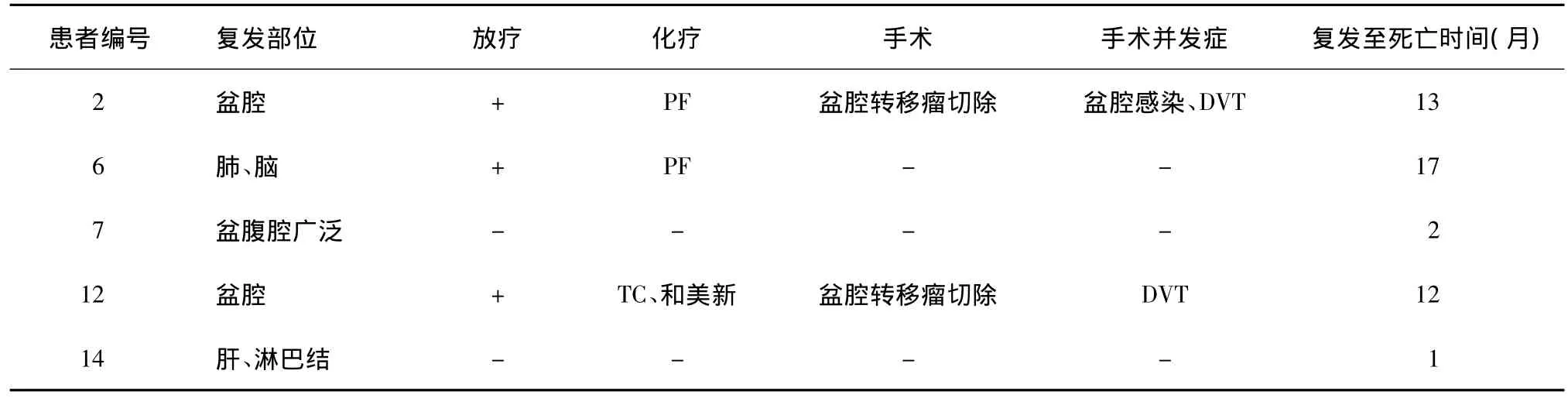
表3 5例死亡患者复发后治疗情况
术后病理显示,4例有宫颈深肌层浸润,均发生于低分化癌。仅1例行根治性宫颈切除患者(4#)术中冰冻病理显示淋巴结阴性,术后石蜡病理回报有1个盆腔淋巴结阳性(1/14)。对于肿瘤直径>4 cm、宫颈深肌层浸润以及盆腔淋巴结阳性者术后辅助同步放化疗,包括腔内及体外照射,同时顺铂周疗(40 mg/m2)或顺铂(70 mg/m2)联合氟尿嘧啶(1 g/m2/d×4 d)三周疗。
2.3 母婴结局及生存分析结果
14例患者中,2例失访,中位随访时间为27个月(7~61)。其中7例患者无瘤生存,5例患者复发死亡,中位无瘤生存时间为10个月(6~57),中位总生存时间为23个月(7~59),具体复发部位及复发后治疗生存情况见表3。
本研究患者的总3年及5年无瘤生存率分别为70.1%及46.8%。分别计算不同孕期、肿瘤分化程度、肿瘤大小、肌层浸润深度患者5年无瘤生存率,显示早孕期为75.0%,中孕期为55.6%,晚孕期为33.3%;肿瘤高中分化患者为53.3%,低分化患者为51.9%;肿瘤直径<4 cm患者为68.6%,≥4 cm患者为35.7%;肌层浸润 <1/2患者为72.9%,≥1/2患者为75%。Log-rank检验显示组间比较P值均>0.05,差异无统计学意义。
本组患者中1例中孕27周及3例晚孕期诊断宫颈癌者最终于孕32至孕37周接受剖宫产术分娩活婴,37周前结束妊娠者均经地塞米松促胎肺成熟,其中1例孕34+3周新生儿出生后Apgar评分1分钟评8分,5分钟评10分,但转儿科后最终死亡。其余3例新生儿健康存活。
3 讨论
妊娠合并宫颈浸润癌是临床少见病例,文献报告宫颈癌于孕期发生率为0.1‰~1.2‰[5],而宫颈癌患者中合并妊娠的发生率为0.92% ~7.05%[6],其中80%以上为鳞癌[7]。本研究考察宫颈浸润癌患者中合并妊娠的情况,发生率为0.78%,由于妊娠期宫颈癌多为早期,故相当部分为原位癌或微小浸润癌,故本研究统计数值低于文献报告。
3.1 妊娠合并宫颈癌的筛查及诊断
妊娠合并早期宫颈癌可以完全无症状,因此妊娠期宫颈癌筛查是孕期检查的重要项目。目前,许多治疗指南[8-9]推荐所有妊娠妇女应在首次孕期检查时进行宫颈脱落细胞检查,且妊娠各期行阴道镜检查及活检均安全可靠[10]。除非高度怀疑宫颈微小浸润癌或浸润癌,否则不宜于孕期行宫颈锥切术[11-12]。妊娠合并宫颈癌的主要临床表现为阴道出血、排液,但由于该症状与妊娠期的一些病理情况相似,并且患者甚至医生对流产有顾虑,临床上往往忽略宫颈的检查。本研究的患者均非于我院产检,均因可疑孕期宫颈癌转至我院。14例患者中,仅1例为产检时阴道检查诊断,2例因流产/引产时发现,其余11例(79%)均有孕期阴道出血,甚至在孕前即有性交出血症状但并未行阴道检查;仅29%的患者为早孕期诊断;50%的患者诊断时肿瘤直径≥4 cm。这一特点恰与国外文献报告相反,Germann等[13]对21例妊娠合并宫颈癌患者的研究显示,76%的患者为无症状孕检时发现,62%为早孕期诊断,29%的患者肿瘤直径≥4 cm。国内也有研究者报告5例妊娠合并宫颈癌患者诊断均较晚,4例死亡[14]。因此,应强调对于非孕期及孕期妇女的常规宫颈脱落细胞检查,依据大量临床安全性研究数据首先从医生角度消除对于孕期阴道检查及宫颈活检的顾虑,进而对患者加强宣教,提高这一疾病的早诊率,使患者获得更多的治疗及保留生育功能甚至保留胎儿的机会。
3.2 妊娠合并宫颈浸润癌的治疗
妊娠合并宫颈癌总的处理原则应为采用能够使患者获得最大生存概率的治疗方案,在不影响治疗效果的前提下尽量保留患者生育功能或胎儿。非常重要的是要尊重患者的知情选择权,制定个体化的治疗方案。传统观点建议孕20周以前诊断的宫颈癌,因距离胎儿可存活孕周时间较长,建议立即终止妊娠并开始规范肿瘤治疗。目前观点倾向于对于早期、淋巴结阴性患者尝试维持妊娠至胎儿成熟的治疗,称为延迟治疗[13]。淋巴结状态的评估很重要,MRI是重要的评估方法[15],而金标准诊断仍为切除后的组织学检查。对于妊娠<20周的患者可行腹腔镜淋巴结切除,文献报告ⅠB1期之前的患者淋巴结阳性率为12%,而≥ⅠB2期患者中50%淋巴结阳性[16-20]。对于淋巴结阴性者可每6~8周行阴道镜检查,监测肿瘤外观变化及复查MRI至胎儿成熟[21]。淋巴结阳性者应立即终止妊娠并开始肿瘤治疗。对于孕20周后已无法行腹腔镜淋巴结切除的ⅠB1期患者,可进行MRI检查以评估淋巴结状态,阴性者严密随诊至胎儿成熟。肿瘤直径<2 cm者也可行根治性宫颈切除术,但流产风险较高,文献报告为 36%[16,22-23];对于肿瘤直径 2 ~4 cm者的治疗有争议,目前认为如胎儿接近成熟可严密随诊,如肿瘤直径接近4 cm则可考虑新辅助化疗(neoadjuvant chemotherapy,NACT),但应交代肿瘤进展风险[21]。
肿瘤直径>4 cm的ⅠB2期患者,应直接放化疗。妊娠<20周在终止妊娠后开始或直接开始(巨块型宫颈肿瘤),妊娠>20周如MRI显示淋巴结阴性,也可严密随诊至胎儿可存活孕周行剖宫产术后开始放化疗。对于强烈要求保留胎儿的ⅠB2期患者,可尝试NACT以降低肿瘤负荷,控制微小转移,在治疗疾病的同时延长孕周至胎儿可存活后终止妊娠,同时行根治性手术。但在治疗前应交代肿瘤有快速进展的风险,化疗药物对胎儿的影响无远期随访结论[5,21]。
本研究中1例孕27周浸润最深处为2 mm的ⅠB1期淋巴结阴性患者(11#)成功期待至孕37周剖宫产分娩,孕期阴道镜下显示宫颈一直无肉眼可见病灶,因患者配偶孕期意外死亡,产后42 d行宫颈锥切术,术后病理仅为原位鳞癌,故保留子宫随诊。这一病例提示我们对于这种无肉眼可见病灶,镜下多点微浸润,仅病灶面积超过ⅠA期的ⅠB1期患者能否参照妊娠合并宫颈微浸癌的处理原则期待至足月,需要更多的临床病例总结。我们也尝试对于1例肿瘤直径4 cm的ⅠB2晚孕期患者行1程NACT后于孕34周终止妊娠,目前无瘤存活31个月,遗憾的是新生儿转儿科后死亡。因此,妊娠合并宫颈癌患者的治疗方案应为多科会诊的结果,需要妇科肿瘤、产科、肿瘤放疗科、新生儿科及病理科医生的通力合作,以保证良好的母婴结局。
3.3 妊娠合并宫颈浸润癌的预后
妊娠合并宫颈浸润癌患者的预后目前尚有争议,许多文献显示与非孕期宫颈癌无明显差别。由于发生率低且肿瘤期别、诊断时孕周等在各研究间存在较大差异,故还需更多的总结研究。本组患者的总3年及5年无瘤生存率分别为70.1%及46.8%,低于文献报告 (79%和73%),考虑为宫颈癌诊断时孕周与肿瘤期别较晚有关。本研究分别计算了不同孕期、肿瘤分化程度、肿瘤大小、肌层浸润深度患者的5年无瘤生存率,由于病例数少随诊时间不长,均未显示出统计学差异,但仍可以看出随诊断时孕周的变晚,患者生存率递减,且肿瘤直径≥4 cm患者生存率较<4 cm者明显变低,结果与文献报告相似[13]。因此再次提示我们早期诊断对于改善妊娠合并宫颈癌患者的预后有重要意义。
随着生育年龄推后及肿瘤年轻化的发展趋势,妊娠合并宫颈癌这一少见情况将逐渐增加,因此如何兼顾肿瘤治疗及生育功能保留是妇产科医生面临的难题。与国外研究相比,目前我国妊娠期宫颈癌的特点是诊断晚预后差,应加强筛查;我们在治疗中为患者制定了个体化治疗方案,尝试了根治性宫颈切除、孕期NACT及延迟治疗等方法,获得了良好的母婴结局,但仍需加强多科合作及提高早产儿的救治水平。
[1]Sood AK,Sorosky JI,Mayr N,et al.Cervical cancer diagnosed shortly after pregnancy:prognostic variables and delivery routes[J].Obstet Gynecol,2000,95:832 - 838.
[2] Manuel-Limson GA,Ladines-llave CA,Sotto LS,et al.Cancer of the cervix in pregnancy:a 31-year experience at the Philippine General Hospital[J].J Obstet Gynaecol Res,1997,23:503 -509.
[3]Sood AK,Sorosky JI,Krogman S,et al.Surgical management of cervical cancer complicating pregnancy:a casecontrol study[J].Gynecol Oncol,1996,63:294 -298.
[4]彭立平,张国楠.妊娠合并宫颈癌的治疗[J].实用妇产科杂志,2007,23:519-521.
[5]Morice P,Uzan C,Gouy S,et al.Gynaecological cancers in pregnancy[J].Lancet,2012,379:558 -569.
[6]乐杰,谢幸,丰有吉,等.妇产科学[M].6版.北京:人民卫生出版社,2004:293.
[7]杨怡卓,李亚里.妊娠期宫颈癌诊治进展[J].中国实用妇科与产科杂志,2010,5:245-246.
[8]Solomon D.2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ[J].Am J Obstet Gynecol,2007,197:340-345.
[9]Selleret L,Mathevet P.Precancerous cervical lesions during pregnancy:diagnostic and treatment[J].JGynecol Obstet Biol Reprod,2008,37:S131-S138.
[10]Van Calsteren K,Vergote L,Amant F.Cervical neoplasia during pregnancy:diagnosis,management and prognosis[J].Best Pract Res Clin Obstet Gynecol,2005,19:611-630.
[11]Robinson WR,Webb S,Tirpack J,et al.Management of cervical intraepithelial neoplasia during pregnancy with LOOP excision[J].Gynecol Oncol,1997,64:153 -155.
[12]Seki N,Kodama J,Kusumoto T,et al.Complications and obstetric outcomes after laser conization during pregnancy[J].Eur J Gynaecol Oncol,2010,31:399 -401.
[13]Germann N,Haie-Meder C,Morice P,et al.Management and clinical outcomes of pregnant patients with invasive cervical cancer[J].Ann Oncol,2005,16:397 -402.
[14]陆云燕,刘蓉,徐海波.妊娠相关性宫颈癌5例临床治疗体会[J].现代肿瘤医学,2011,19:754-756.
[15]Doyle S,Messiou C,Rutherford JM,et al.Cancer presenting during pregnancy:radiological perspectives[J].Clin Radiol,2009,64:857 -871.
[16]Alouini S,Rida K,Mathevet P.Cervical cancer complicating pregnancy:implications of laparoscopic lymphadenectomy[J].Gynecol Oncol,2008,108:472 -477.
[17]Sioutas A,Schedvins K,Larson B,et al.Three cases of vaginal radical trachelectomy during pregnancy[J].Gynecol Oncol,2011,121:420 -421.
[18]Favero G,Chiantera V,Oleszczuk A,et al.Invasive cervical cancer during pregnancy:laparoscopic nodal evaluation before oncologic treatment delay[J].Gynecol Oncol,2010,118:123-127.
[19]Herod JJ,Decruze SB,Patel RD.A report of two cases of the management of cervical cancer in pregnancy by cone biopsy and laparoscopic pelvic node dissection [J].BJOG,2010,117:1558-1561.
[20]Stan C,Megevand E,Irion O,et al.Cervical cancer in pregnant women:laparoscopic evaluation before delaying treatment[J].Eur J Gynaecol Oncol,2005,26:649 -650.
[21]Morice P,Narducci F,Mathevet P,et al.French recommendations on the management of invasive cervical cancer during pregnancy[J].Int J Gynecol Cancer,2009,19:1638-1641.
[22]Ungar L,Smith JR,Palfalvi L,et al.Abdominal radical trachelectomy during pregnancy to preserve pregnancy and fertility[J].Obstet Gynecol,2006,108:811 -814.
[23]Karateke A,Cam C,Celik C,et al.Radical trachelectomy in late pregnancy:is it an option?[J].Eur J Obstet Gynecol Reprod Biol,2010,152:112 -113.

