氢溴酸槟榔碱对幽门螺杆菌生长和空泡毒素A表达和活性的影响
刘 丹,廖顺花,王莉新,王 易
(上海中医药大学免疫学与病原生物学教研室,上海 201203)
幽门螺杆菌(Helicobacter pylori,H.pylori)的致病性与其分泌的多种毒力因子有关,包括:尿素酶(Ure)、鞭毛蛋白(Fla)、细胞毒素相关蛋白A(cytotoxin associated gene A,CagA)和空泡毒素A(vacuolating cytotoxin,VacA)等。其中VacA是一种单独作用即可引起靶细胞发生空泡化、凋亡、骨架重排等病理改变,最终导致宿主细胞死亡的毒性蛋白,与胃、十二指肠的炎症性疾病密切相关[1]。已有资料显示并非全部的H.pylori都具有致病性,那些缺乏毒力因子(如VacA和CagA等)的细胞株常常是低毒株或无毒株,而不具有致病性[2]。且有文献报道,经药物治疗的H.pylori感染人群,其食管癌发病率增高(源于返流性食管炎的增加),提示非致病的H.pylori可能是人体潜在的正常菌群,完全清除并非善策[3-4]。故寻找非抗生素的其他治疗策略或成为必要。
槟榔、大腹皮是临床治疗慢性活动性胃炎、消化性溃疡等消化道疾病[5]的常用中药。氢溴酸槟榔碱(arecoline hydrobromide,AH)是此两味中药的主要药理成分[6]。临床使用虽不能获得类似西药二联、三联和四联等方案联合使用的根除效果。但对症状的缓解与改善却十分肯定[7]。为解释这一现象。本研究提出了中药在非杀菌剂量下,可能通过抑制H.pylori毒力因子的形成与分泌来下调其毒性效应的设想,故选择VacA作为所选中药成分氢溴酸槟榔碱的主要实验对象,在体外实验予以验证。
1 材料与方法
1.1 菌株、细胞株及中药 H.pylori国际标准菌株NCTC11637购自于上海消化疾病研究所。胃癌细胞株BGC-823由上海中医药大学中药学院赠送。中药活性成分氢溴酸槟榔碱购自Sigma公司。
1.2 培养基 混合抗生素:多粘菌素B(polymyxin B Sulfate)(Amerisco)2.5 ×107U· L-1,两性霉素B(Amphotericin B)(Amerisco)5 g· L-1,万古霉素(Vancomycin HCl)(Amerisco)10 g· L-1,磺胺增效剂(上海日初)5 g· L-1。混合抗生素添加于培养基中,用于抑制其它杂菌的污染,同时可为H.pylori生长提供所需的胸腺嘧啶脱氧核苷[8]。
哥伦比亚固体培养基:哥伦比亚琼脂(Columbia Agar Base,CAB)(上海日初)39 g· L-1,1‰ (V/V)混合抗生素,10%(V/V)脱纤维羊血(上海青阳)。脑心浸液液体培养基:脑心浸液培养基(上海日初)39 g· L-1,1‰ (V/V)混合抗生素。
1.3 H.pylori的培养和鉴定 H.pylori菌株的固体培养:将菌株接种于上述哥伦比亚琼脂固体培养基上,L型棒均匀涂布,透明胶带固定后放于充气罐内充入混合气体(85%N2、10%CO2、5%O2),37℃恒温培养,更换气体每天1次,3~5 d后进行菌种鉴定。取对数期细菌,经无菌 PBS洗涤后,测其OD600nm值,1OD 细菌浓度相当于 1 ×1011· L-1,调细菌浓度为1×109· L-1,用于后续实验。
H.pylori菌株的液体培养:刮取已培养48 h的H.pylori菌苔,混悬于1 ml无菌生理盐水,吸取200 μl接种于4 ml含混合抗生素的脑心浸液液体培养基中,置入厌氧罐,充入混合气体,37℃ 100 r·min-1振荡培养,每天更换气体1次,待液体混浊后进行鉴定。通过形态学和生化学方法加以鉴定,将具有典型菌落特征者进行涂片和革兰染色,油镜观察其典型形态特征,并进行快速尿素酶试验、过氧化氢试验、氧化酶试验等一系列生化学鉴定。
1.4 中药活性成分对 H.pylori最低抑菌浓度(MIC)的测定[9]
1.4.1 固体法 将50 g· L-1氢溴酸槟榔碱倍比稀释成不同的浓度梯度,每浓度取1 ml于无菌培养皿中,再加入9 ml哥伦比亚琼脂,使氢溴酸槟榔碱的终浓度为 5、2.5、1.25、0.63、0.31、0.16、0.08 g·L-1。取50 μl上述对数期的 H.pylori菌液接种于制备好的含药固体培养基上,培养3~5 d后观察细菌的生长情况,每个浓度做3复板,无细菌生长的最小药物浓度为MIC。
1.4.2 液体法 使用含混合抗生素的脑心浸液液体培养基对氢溴酸槟榔碱进行倍比稀释,使药液终浓度与固体法一致,每个浓度做3复管,加入对数期菌液 100 μl,培养3 ~4 d 后,每管各取50 μl接种于不含中药活性成分的哥伦比亚琼脂固体培养基上,无细菌生长的最小浓度为MIC。
1.5 粗制VacA蛋白制备 将对数期细菌分别培养于含有0.15 g· L-1溴酸槟榔碱的液体培养基中,并设立不加药物处理的对照组,每组3复管,培养至液体浑浊 (OD600=0.8)后,收集各组细菌菌液,按照文献方法进行粗制VacA蛋白制备[10],测蛋白浓度,-20℃保存备用。
1.6 VacA活性检测 胃癌细胞BGC-823作为H.pylori分泌的VacA毒性作用的靶细胞,在本研究中用来评价VacA的细胞毒性效应。BGC-823培养于含10%新生牛血清(Gibco)的RPMI 1640(Gibco)培养液中,对数期BGC-823细胞接种至24孔细胞板,1×105/孔,继续培养24 h,至细胞贴壁并铺满大部分板底。根据文献选择1∶2毒素滴度,终体积1 ml,作用24 h[10]。分为 3 组:VacA 对照组加入上述未经药物处理的粗制VacA蛋白;AH处理组加入经溴酸槟榔碱处理后的粗制VacA蛋白;细胞对照组加入不含VacA的细胞培养液1 ml。24 h后吸弃上清,倒置显微镜观察细胞形态。每孔加入0.05%中性红 PBS 溶液 200 μl,置室温孵育 8 min,500 μl PBS洗3次,加入200 μl 75%酸化乙醇,酶标仪测定570 nm 吸光值(A570)[10]。
1.7 半定量RT-PCR检测 使用革兰阴性细菌RNA提取试剂盒(OMEGA)进行细菌RNA提取,测定各样本的 OD260和 OD280,以定量 RNA浓度,OD260/OD280>1.8可用于实验。用10 μg RNA样本,使用RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas)进行逆转录,反应体系和条件按照试剂盒说明书操作。用5 μl cDNA作为模板,以gyrB为内参,按照PCR Master Mix试剂(Fermentas)使用说明,分别用VacA和gyrB引物,使用PCR Master Mix试剂(Fermentas)进行PCR检测,分析VacA mRNA表达水平,VacA引物为 F 5'-CAATCTGTCCAA TCAAGCGAG-3',R 5'-GCGTCTAAATAATTCCAAGG-3',产物长度 570bp。gyrB引物为 F 5'-CGCTAAAGAAAGTGGCACGAC-3',R 5'-TGCGCGTTTCTTC ATCCAT-3',产物长度265bp。反应条件为:94℃ 5 min预变性;94℃ 15 s,55℃ 30 s(gyrB)/52℃ 30 s(vacA),72℃ 1 min,35 个循环(gyrB)/40 个循环(vacA);72℃ 7 min延伸。5 μl PCR产物进行2%琼脂糖凝胶电泳,80V恒压电泳30 min。用GBOX CHEMI图像分析系统采集图像,并使用smartview软件读取密度值。结果用目的基因/gyrB密度值表示。
1.8 细菌菌体蛋白和分泌蛋白样本的制备 菌体蛋白制备:收集含药物固体培养基上的细菌,PBS洗3次,沉淀加入1 ml细菌裂解液(8 mol· L-1脲素、4%CHAPS、1%pharmalyte(pH 3 ~10)、1%蛋白酶抑制剂混合物,用前加1%DTT。)悬浮。采用300W超声粉碎细菌(工作10 s,间隔10 s)直至上清变清澈。4℃ 12 000 r·min-1离心 40 min,取上清。用考马斯亮蓝蛋白定量试剂盒(南京建成)定量蛋白浓度,-80℃保存备用。
分泌蛋白制备:收集在含药物液体培养基中生长的细菌,将其高速离心,0.22 μm滤膜过滤,上清加入10%1 mol· L-1三氯乙酸,4℃放置3 h以上,直至看到沉淀。4℃ 80 000 r·min-1离心20 min,弃上清,沉淀加入1 ml丙酮洗涤3次,空气中自然干燥。沉淀蛋白加入细菌裂解液溶解,定量蛋白浓度,-80℃保存备用。
1.9 Western blot 取50 μg总蛋白进行SDS聚丙烯酰胺凝胶电泳,10%分离胶20 mA 15 min,3%堆积胶10 mA 1 h,200 mA 50 min转膜,TTBS(100 mmol· L-1Tris-HCI,0.9%(W/V)NaCl,0.1%(V/V)Tween 20,pH 7.5)5 min洗3次,以5%脱脂奶粉TTBS封闭,常温震荡1 h。分别加入1∶250 VacA单抗(Santa Cruz)或1∶500 GAPDH单抗(Santa Cruz),4℃孵育过夜,TTBS洗 3次,加入1∶5 000稀释的HRP标记二抗 (上海联科),RT震荡1 h,TTBS 5 min洗3次,去除未结合二抗。取等量ECL发光剂(A液、B液各1 ml)混匀,浸膜3~5 min,曝光后显影 5~60 s,定影 2 min。用 GBOX CHEMI图像分析系统采集图像,并使用smartview软件读取密度值。菌体蛋白中空泡毒素A的表达以GAPDH为内参,结果用目的蛋白/GAPDH密度值之比表示,上清中空泡毒素A的表达直接以目的蛋白密度值表示。
1.10 统计学分析 使用SPSS 13.0专业统计软件进行数据分析。实验数据以±s表示,各试验组与对照组间差异性采用t检验。
2 结果
2.1 细菌鉴定 肉眼可见直径约为0.2~1.0 mm的圆形、半透明或透明的灰白色或无色的针尖样细小菌落,典型菌落经革兰染色后,油镜下可见革兰阴性、弧形、S形或海鸥展翅状的典型形态,可判定为H.pylori(Fig 1)。进一步生化学鉴定显示,快速尿素酶试验、氧化氢试验、氧化酶试验均阳性者可确认为 H.pylori菌株[11]。

Fig 1 Morph of H.pylori observed by high power with staining of Gram
2.2 中药活性成分对H.pylori生长具有抑制作用 本研究首先使用平皿稀释固体法和脑心浸液液体法测定中药活性成分氢溴酸槟榔碱对H.pylori的最低抑菌浓度(MIC),以反映药物对H.pylori的抑制作用。结果显示二者均可以在体外抑制H.pylori的生长,其 MIC固体法为 1.25 g·L-1,液体法为 1.25 g·L-1。
2.3 中药活性成分对H.pylori分泌的VacA活性的影响 本研究进一步检测了氢溴酸槟榔碱在体外对H.pylori分泌的VacA活性的影响。经细胞毒实验筛选出对细胞无毒性作用的细胞浓度,且远低于相应MIC药物浓度的氢溴酸槟榔碱(0.15 g·L-1)干预处理的H.pylori培养上清,作用于BGC-823细胞,24 h后通过中性红摄入法,检测H.pylori分泌的VacA的细胞毒性,并以未经药物处理的H.pylori培养上清为VacA毒性对照组,和未加入VacA蛋白的细胞为细胞对照组。使用抑制率表示药物对VacA活性的抑制能力。抑制率/%=[1-(处理组OD-细胞对照组OD)/(VacA毒性对照组OD-细胞对照组OD)]×100%。结果显示,与细胞对照组相比较,未经药物处理的VacA蛋白对BGC-823细胞具有明显的毒性作用(P<0.01),氢溴酸槟榔碱可明显抑制VacA的活性,P<0.01(Fig 2A)。其对VacA活性的抑制率达100%(Fig 2B)。
2.4 氢溴酸槟榔碱对VacA mRNA和蛋白表达水平的影响 进一步使用不抑制H.pylori生长的药物浓度的氢溴酸槟榔碱(0.15 g· L-1)干预细菌24 h,收集细菌和培养上清,细菌菌体经细胞裂解后,检测细菌菌体中VacA mRNA和蛋白表达水平;并检测细胞培养上清中VacA的蛋白水平,同时以药物未干预细菌为对照。结果显示:与对照组相比,氢溴酸槟榔碱可明显抑制菌体内空泡毒素A mRNA(P<0.05)和蛋白(P<0.01)水平(Fig 3A)。且可明显抑制H.pylori上清中VacA蛋白的表达(P<0.01)(Fig 3B)。
3 讨论
目前针对H.pylori治疗虽已建立相当有效的根治措施[12]。但下列问题仍使临床医生感到棘手:①正在逐渐上升的H.pylori耐药性;②降低的根除率和升高的复发率;③患者对治疗方法的依顺性[13]。这些问题都提示我们需要从新的视角去审视H.pylori的致病机制及其治疗策略。且有关H.pylori作为潜在正常微生物群的观点也使医学界需要更审慎的考虑这个问题。
受此提示,本研究选取了中药槟榔、大腹皮的主要活性成分氢溴酸槟榔碱(AH)观察其对VacA是否具有设想中的抑制作用。结果显示在低于最低抑菌浓度(MIC)近十分之一浓度时,AH可以明显抑制H.pylori分泌的VacA的细胞毒性作用,可以抑制VacA对细胞的空泡化毒性效应。此结果与早期以中药生药水煎剂所进行的同类研究结果吻合,证实槟榔、大腹皮中对VacA细胞毒性起抑制作用的药理成分是AH。且经换算,该剂量在临床用药的安全范围之内。而产生抑菌作用之浓度已大于该药的安全范围[14]。

Fig 2 Effects of AH on activities of VacA secreted by H.pylori in vitro
本研究继续在VacA形成的mRNA及蛋白的表达和分泌水平上,分别对上述现象进行了验证,结果显示,AH对菌体内VacA mRNA及蛋白表达的抑制作用具有较好的一致性。且同时具有对VacA蛋白分泌的抑制作用。但其具体的抑制机制尚有待进一步研究。
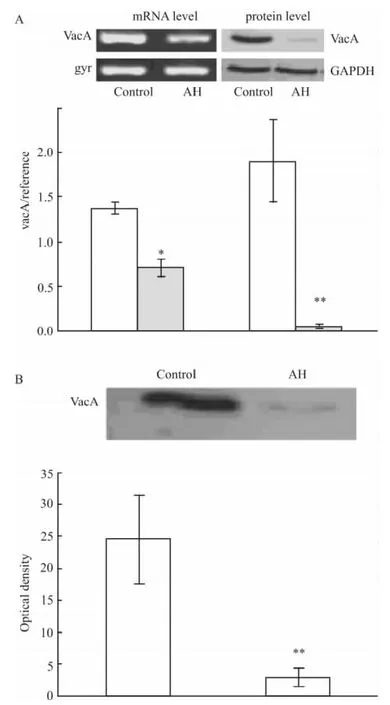
Fig 3 Effects of AH on mRNA and protein level of VacA expressed in H.pylori or secreted by H.pylori
尽管AH已经是一个临床应用久远的合成药物,但其针对H.pylori毒素形成的抑制作用尚属首次发现,考虑到AH自身的药物副作用和抑制H.pylori毒素形成的时效问题尚需进一步研究,故其临床应用尚有待时日。不过,不以杀菌为目的,而以抑制毒素形成为手段的应对策略,对于H.pylori所引起之疾病以及类似的机会性感染都是一个值得考虑的探索方向,也是临床新的药理作用(尤其是中药)发现与开发的一条蹊径。
[1]Kuck D,Kolmerer B,Lking-Konert C,et al.Vacuolating cytotoxin of Helicobacter pylori induces apoptosis in the human gastric epithelial cell line AGS[J].Infect Immun,2001,69(8):5080 -7.
[2]Kim S H,Park M,Woo H,et al.Inhibitory effects of anthocya-nins on secretion of Helicobacter pylori CagA and VacA toxins[J].Int J Med Sci,2012,9(10):838 -42.
[3]Ashktorab H,Entezari O,Nouraie M,et al.Helicobacter pylori protection against Reflux esophagitis[J].Dig Dis Sci,2012,57(11):2924-8.
[4]Blaser M J.An endangered species in the stomach[J].Scientific American,2005,292(2):38-45.
[5]阮小明,李洪森,徐 琛.幽门螺杆菌黏附MKN45细胞模型的建立与应用[J].中国药理学通报,2010,26(5):683 -6.
[5]Yuan X M,Li H S,Xu C.Development and application of antiadherent evaluation model of H pylori adherent to MKN45 cell[J].Chin Pharmcol Bull,2010,26(5):683 -6.
[6]韩腾飞,高 昂,巩 江,等.大腹皮药学研究概况[J].安徽农业科学,2011,39(14):8382 -4.
[6]Han T F,Gao A,Gong J,et al.An overview of pharmaceutical research on Pericarpium Arecae [J].J Anhui Agricultural Sci,2011,39(14):8382 -4.
[7]王恩湘,陈维顺,余小梅,等.湘潭制槟榔与幽门螺杆菌感染关系研究[J].世界华人消化杂志,2000,z1:70.
[7]Wang E X,Chen W S,Yu X M,et al.Research on the association between the processed Arecae and Helicobacter pylori[J].World Chin J Digestol,2000,z1:70.
[8]梁昌盛,黄锦桃,王 玲,等.幽门螺杆菌体外培养条件的研究[J].临床医学工程,2012,19(8):1259-60.
[8]Liang C S,Huang J T,Wang L,et al.Research on the conditions forin vitrocultivation of Helicobacter pylori[J].Clin Med Engin,2012,19(8):1259-60.
[9]许华玉,林海祥.药物抗菌作用测定方法[M]//马绪荣,苏德模,主编.药品微生物学检验手册.北京:科学出版社,2001:210-3.
[9]Xu H Y,Lin H X.TestMethodsfor antibacterial effect of drugs[M]//Ma X R,Su D M.Inspection manual for medicine microbiology.Beijing:Science Press,2001:210 -3.
[10]杜奕奇,李兆申.幽门螺杆菌空泡毒素活性的体外观察[J].上海医学,2005,28(10):858 -61.
[10]Du Y Q,Li Z S.Observations on vacuolating toxin of Helicobacter pyloriin vitro[J].Shanghai Med J,2005,28(10):858 - 61.
[11]Wang F,Luo L D,Pan J H,et al.Comparative genomic study of gastric epithelial cells co-cultured with Helicobacter pylori[J].World J Gastroenterol,2012,18(48):7212 -24.
[12]Sugizaki K,Sakata Y,Arai T,et al.A multicenter prospective observational study of triple therapy with Rabeprazole,Amoxicillin and Metronidazole for Helicobacter pylori in Japan[J].Intern Med,2012,51(22):3103 -8.
[13]Seck A,Burucoa C,Dia D,et al.Primary antibiotic resistance and associated mechanisms in Helicobacter pylori isolates from Senegalese patients[J].Ann Clin Microbiol Antimicrob,2013,12(1):3-7.
[14]Asthana S,Greig N H,Holloway H W,et al.Clinical pharmacokinetics of arecoline in subjects with Alzheimers disease[J].Clin Pharmacol Ther,1996,60(3):276 -82.

