rhEPO对高糖状态下大鼠Müller细胞凋亡及对Bcl-2和Bax表达的影响
孟 岩,李 艳,叶尚尚,张 月
(青岛大学医学院附属医院眼科,山东青岛 266001)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病非常严重的并发症,属致盲性眼病,对患者的生活质量有重大危害。以往认为高血糖引发的视网膜微循环障碍是DR的主要损伤因素,近年来研究发现,视网膜神经细胞及胶质细胞的凋亡是DR早期的重要表现。视网膜Müller细胞是一种特殊的神经胶质细胞,也是视网膜内最主要的神经胶质细胞,该细胞是从外界膜延伸到内界膜,贯穿于整个视网膜,能维持视网膜的正常代谢,调节神经成分和血管成分之间相互作用;在病理状态下,其异常活化与许多视网膜变性、缺血性疾病有着密切关系[1-2]。随着对胶质细胞研究的深入,人们发现在DR早期视网膜血管病变之前Müller细胞形态结构和生理功能就已经发生了变化[3]。重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)是与天然EPO具有相同生物学活性的糖蛋白,近年来发现其可以通过血-脑屏障和血-视网膜屏障,参与中枢神经及视网膜神经细胞缺血缺氧损伤的保护,具有广泛的抗凋亡作用。
由于视网膜Müller细胞在维持视网膜结构和
功能上的重要性,本实验拟在前期研究的基础上,通过建立体外高浓度葡萄糖状态下大鼠视网膜Müller细胞模型,采用TUNEL法检测视网膜细胞凋亡情况,酶联免疫吸附法检测凋亡相关基因Bcl-2和Bax蛋白的表达水平,并给予rhEPO干预,通过分析各组细胞结构、功能的改变,来探讨rhEPO对视网膜Müller细胞的保护作用及可能的调控机制。
1 材料与方法
1.1 实验动物 出生3~5 d的SD乳鼠5只(符合国家医用动物使用标准,动物合格证号:SLXK鲁20080002),山东鲁抗医药股份有限公司的实验动物中心提供。
1.2 实验方法
1.2.1 SD乳鼠视网膜Müller细胞的培养及纯化
用75%酒精浸泡出生3~5 d标准实验用SD大鼠处死,转移至超净台,摘取眼球,去除眼前节及玻璃体,分离视网膜组织。细胞培养方法同李树宁等[4]报道。培养期间,通过倒置相差显微镜,每天观察培养瓶内细胞的形态、数量、及生长情况。取第2代细胞,用抗Müller细胞特异性谷氨酰胺合成酶抗体,行免疫细胞化学染色SP法对培养细胞进行鉴定。随机计数每10个高倍镜视野(×200)下,胞膜完整的阳性染色细胞数及细胞总数,计算阳性染色Müller细胞所占百分数。每次计数3次,实验重复3次。
1.2.2 高糖模型的建立和实验分组 细胞传3代时接种于24孔板并进行高糖模型分组,葡萄糖浓度取 25 mmol·L-1:Ⅰ组:空白对照组(Control),空白对照组不给予干预;Ⅱ组:高糖培养组(HG,high glucose);Ⅲ组:高糖+5 kU·L-1rhEPO组(HG+5 kU·L-1rhEPO);Ⅳ组:高糖 +10 kU·L-1rhEPO组(HG+10 kU·L-1rhEPO);Ⅴ组:高糖 +20 kU·L-1rhEPO 组(HG+20 kU·L-1rhEPO);Ⅳ组:高糖+40 kU·L-1rhEPO 组(HG+40 kU·L-1rhEPO)。1.2.3 原位缺口末端标记法(TUNEL)检测细胞凋亡 6组细胞同时终止培养。培养液冲洗后加50 μl TUNEL检测液,37℃避光孵育 60 min,0.01 mol·L-1的PBS洗涤3次后,使用激发波长范围为450-500 nm,发射波长范围为515-565 nm(绿色荧光),在荧光显微镜下观察并照相。TUNEL阳性细胞计数:每组3孔,每孔连续观察10个视野(×200)计数阳性细胞,求平均数。
1.2.4 ELISA方法检测各实验组Bcl-2和Bax的表达 分组后的细胞继续培养2 d后,加入预冷的细胞裂解液(50 mmol·L-1Tris-Cl,200 mmol·L-1NaCl,2 mmol·L-1EDTA,1%SDS,0.1 mmol·L-1PMSF),低温匀浆,离心收集上清液,设计标准孔、样本孔及空白孔,采用双抗体一步夹心法,酶标仪450 nm波长处,测定各孔A值。
1.3 统计学分析 实验数据应用统计分析软件SPSS 11.0,实验结果以±s表示,多组资料均数间的比较采用单因素方差分析,两两比较采用q检验。
2 结果
2.1 大鼠视网膜Müller细胞体外培养及鉴定 刚接种的细胞呈球形或卵圆形,悬浮于培养基内。24 h后细胞基本贴壁,伸出短小突起。48 h后细胞体积增大,突起变长,发出分支。3~6 d时,细胞增多并增大,细胞突起明显。1~2周时,贴壁细胞达到80%融合。经反复胰蛋白酶消化,绝大多数细胞形态较一致,胞体狭长,胞质丰富,核呈圆形或卵圆形。GS免疫细胞化学法示阳性细胞胞核呈棕黄色,在光镜下,每10个高倍镜(×200)视野下,细胞总数平均为(566±3)个,阳性反应的细胞数平均为(539±5)个,阳性率为95.2%,表明2次传代的细胞绝大部分已是纯化的视网膜Müller细胞。
2.2 TUNEL法检测Müller细胞凋亡 空白对照组仅见极少量阳性细胞表达(Fig 1A),高糖组同空白组相比凋亡细胞明显增多(P<0.05)(Fig 1B)。而各rhEPO干预组TUNEL阳性细胞同高糖组相比明显减少(P<0.05)。见Fig 1C~F,Fig 2。

Fig 1 A few TUNEL positive cells in the retinal Müller cells
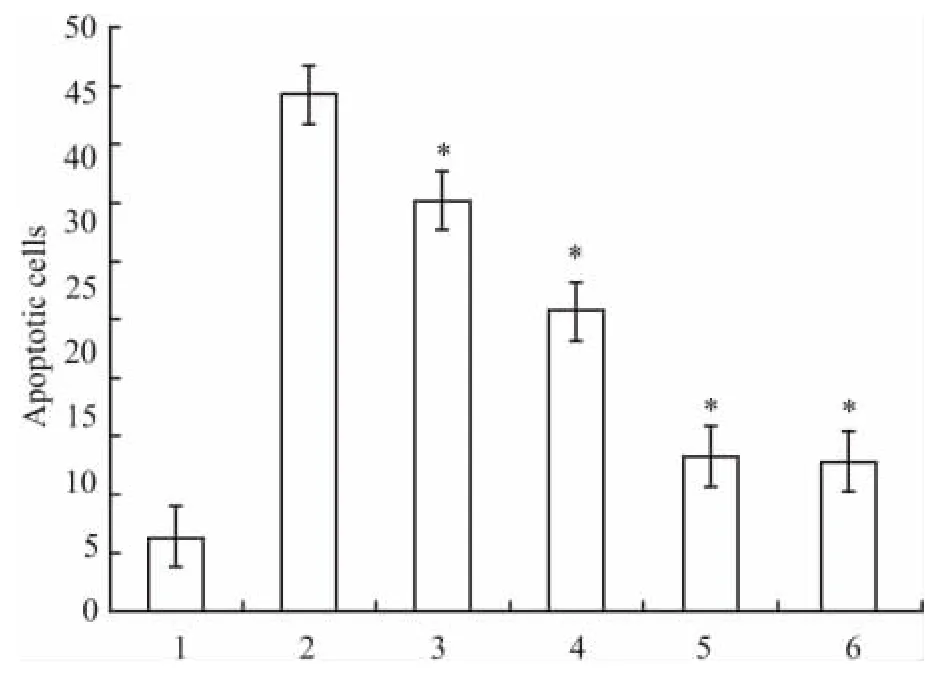
Fig 2 Apoptotic cells of different groups
2.3 Bcl-2及 Bax蛋白表达 空白对照组大鼠视网膜神经细胞中Bcl-2和Bax蛋白表达都较少,高糖组Bcl-2蛋白的表达明显降低,而Bax蛋白的表达明显增强,与正常对照组比较差异均有显著性(P<0.05)。rhEPO各剂量组Bcl-2蛋白的表达比高浓度葡萄糖培养组高,Bax蛋白的表达降低,差异均有统计学意义(P<0.05)(Tab 1,2)
Tab 1Expression of Bcl-2 in different groups(±s,n=4)

Tab 1Expression of Bcl-2 in different groups(±s,n=4)
△P<0.05 vs control;#P<0.05 vs HG
Group Bcl-2(average absorbance)q P Control 101.98 ±3.56 - -HG 56.08 ±5.12△ 17.99△ <0.01△HG+5 kU·L-1rhEPO 67.47 ±4.73# 4.47# <0.05#HG+10 kU·L-1rhEP 76.32 ±7.21# 7.94# <0.01#HG+20 kU·L-1rhEPO 85,43 ±3.11# 11.51# <0.01#HG+40 kU·L-1rhEPO 90.72 ±5.76# 13.58# <0.01#
Tab 2Expression of Bax in different groups(±s,n=4)

Tab 2Expression of Bax in different groups(±s,n=4)
△P<0.05 vs control;#P<0.05 vs HG
Group Bax(average absorbance)q P Control 3.98 ±0.35 - -HG 5.92 ±0.21△ 13.02△ <0.01△HG+5 kU·L-1rhEPO 5.31 ±0.15# 4.09# <0.05#HG+10 kU·L-1rhEP 5.06 ±0.32# 5.77# <0.05#HG+20 kU·L-1rhEPO 4.72 ±0.27# 8.05# <0.01#HG+40 kU·L-1rhEPO 4.34 ±0.41# 10.61# <0.01#
3 讨论
关于细胞培养,先行多聚赖氨酸预处理细胞培养瓶使Müller细胞更好贴附于瓶上;视网膜Müller细胞较其他细胞贴壁紧,在细胞贴壁后,用吸管反复吹打瓶底,使未贴壁或贴壁不紧的组织块和细胞悬浮,从而达到纯化目的[5-7]。另外,待细胞长满培养瓶后,加入少量0.25%胰蛋白酶反复多次消化后细胞形态基本一致。通过以上方法获得高数量和质量的标本,在体外建立了稳定的Müller细胞培养体系。
国内报道在STZ-糖尿病大鼠模型中,糖尿病组与正常对照组相比,视网膜神经层细胞凋亡数量增多,同时Bcl-2蛋白表达降低而Bax蛋白表达增多,Bcl-2/Bax比值下降。而使用EPO干预后的糖尿病组,Bcl-2蛋白表达增多,同时Bax蛋白表达又明显降低,Bcl-2/Bax比值升高[8-10]。有动物实验显示,外源性EPO对脑缺血、自身免疫性脊髓炎、脊髓束或外周神经损伤等多种神经系统疾病有保护作用[11-12]。视网膜是中枢神经系统的延续,EPO 同样参与了缺血性视网膜神经组织的保护。体内外实验均有证明,EPO可以促进血管生成,通过增加血供来促进神经功能恢复。另外,EPO还能减轻缺血过程中的炎症反应而起到神经保护作用。更重要的是,有研究证明 EPO可以通过酪氨酸蛋白激酶(PTK-2),激活级联信号转导途径,防止神经组织的细胞凋亡。与天然分离的EPO相比,重组人促红细胞生成素(rhEPO)具有相同氨基酸排列序列,且在体内、外生物学活性基本一致。这些研究表明,EPO可能通过控制抗凋亡Bcl-2和促凋亡基因Bax的平衡来发挥神经保护作用。
本文通过体外培养SD乳鼠视网膜Müller细胞,从细胞形态学、细胞凋亡、Bcl-2和Bax蛋白的表达方面,考察rhEPO对视网膜Müller细胞高浓度葡萄糖损伤的保护作用。研究结果表明,空白对照组大鼠视网膜神经细胞中Bcl-2、Bax表达都较少,高糖组同空白组相比凋亡细胞增多,且Bcl-2蛋白的表达降低、Bax蛋白的表达增强,与空白对照组比较差异均有显著性(P<0.05)。各 rhEPO干预组TUNEL阳性细胞同高糖组相比明显减少,Bcl-2蛋白表达比高糖组高,Bax蛋白的表达降低,差异均有统计学意义(P<0.05)。因此我们推测,rhEPO对糖尿病视网膜Müller细胞具有保护作用,可以抑制细胞凋亡,其机制可能与增强Bcl-2蛋白的表达,而降低Bax蛋白的表达有关,为rhEPO用于临床治疗糖尿病早期视网膜损伤提供了一定理论依据。
目前临床医师对DR的治疗大多只注意其后期发生的增殖性改变,针对早期视网膜神经细胞及神经胶质细胞的凋亡尚无明确有效的治疗药物,随着科研人员相关研究的进步,结合上述实验结果,表明以rhEPO为代表的抗凋亡制剂未来将在临床应用中发挥更加重要的作用。
[1]王心蕊,王越晖,辛 颖,等.Müller细胞在高血糖状态下的变化对维持视网膜结构与功能的影响[J].中国临床康复,2003,7(24):3294 -5.
[1]Wang X R,Wang Y H,Xin Y,et al.Effects of high glucose oli ultrastructure of Müller cells and structure and function of retina[J].Chin J Clin Rehab,2003,7(24):3294 -5.
[2]江雪丰,周希瑗.Müller细胞在糖尿病视网膜病变中的研究进展[J].眼科新进展,2006,26(10):796 -8.
[2]Jiang X F,Zhou X Y.Recent advances of the role of Müller cell in the diabetic retinopathy[J].Rec Adv Ophthal,2006,26(10):796-8.
[3]Lieth E L,Barber A J,Xu B,et al.Glial reactivity and impaired glumate metabolism in short-term experimental diabetic retinopathy Penn State Retina Research Group[J].Dibaetes,1998,47(5):815-20.
[4]李树宁,王竫华,白海青,王大博.改进的酶消化法培养新生大鼠视网膜 Müller细胞[J].眼科研究,2005,23(2):155 -7.
[4]Li S N,Wang J H,Bai H Q,Wang D B.Modified enzyme—digesting method for culturing Müller cells of newborn rat[J].Chin Ophthal Res,2005,23(2):155 -7.
[5]Hicks D,Courtois Y.The growth and behavior of rat retinal Müller cellsin vitro.An improved method for isolation and culture[J].Exp Eye Res,1990,51:119 -29.
[6]彭广华,李志杰,李 辰.视网膜Müller细胞原代培养的技术研究[J].眼科研究,1998,16(1):13-5.
[6]Peng G H,Li Z J,Li C.Conditioned primary culture of retinal Müller cells[J].Chin Ophthal Res,1998,16(1):13 - 5.
[7]刘 瑶,曾永清,魏厚仁,吕源淑.人视网膜Müller细胞培养及超微结构免疫组织化学观察[J].中华眼底病杂志,1995,11(3):178-80.
[7]Liu Y,Zeng Y Q,Wei H R,Lü Y S.The culture of human retinal Müller cells—ultrastructural observation and immunocytochemical characterization[J].Chin J Ocular Fundus Dis,1995,11(3):178-80.
[8]张 燕,牛膺筠,赵岩松,曲 虹.促红细胞生成素对糖尿病大鼠视网膜 bcl-2、bax和 WTp53表达的影响[J].眼科研究,2008,26(9):680 -3.
[8]Zhang Y,Niu Y J,Zhao Y S,Qu H.The effects of EPO on the expression of bcl-2,bax and WTp53 in diabetic rat retina[J].Exp Eye Res,2008,26(9):680 -3.
[9]刘学政,萧 萍,于 波.凋亡相关基因Bcl-2和Bax在糖尿病大鼠视网膜中的表达[J].眼科研究,2002,20(5):440 -3.
[9]Liu X Z,Xiao P,Yu B.Expression of apoptosis-related genes Bcl-2 and Bax in the retinas of early diabetic rats[J].Exp Eye Res,2002,20(5):440 -3.
[10]朱弼珺,王卫峻,许 迅.促红细胞生成素对早期糖尿病大鼠视网膜神经胶质细胞的影响[J].中华眼底病杂志,2007,23(4):290-1.
[10]Zhu B J,Wang W J,Xu X.Effects of recombinant human erythropoietin(EPO)on early diabetic rats retinal neuroglial cell[J].Chin J Ocul Fundus Dis,2007,23(4):290 -1.
[11]Brines M L,Ghezzi P,Keenan S,et al.Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury[J].Proc Natl Acod Sci USA,2000,97(19):10526 -31.
[12]刘夫玲 ,牛膺筠 ,王红云,赵 颖.促红细胞生成素预处理对视网膜神经元缺氧性损伤的保护作用[J].中国药理学通报,2007,23(2):228 -33.
[12]Liu F L,Niu Y J,Wang H Y,Zhao Y.Protective effects of recombinant human erythropoietin(EPO)on rat retinal neurons hypoxia injuries[J].Chin Pharmacol Bull,2007,23(2):228 -33.

