人参皂苷Rg1的抗抑郁作用及对突触超微结构的影响
黄 倩,楚世峰,张均田,陈乃宏
(1.天然药物活性物质与功能国家重点实验室,新药作用机制研究与药效评价北京市重点实验室,中国医学科学院药物研究所,北京 100050;2.天津中医药大学,天津 300193)
抑郁症(depression)是由各种原因引起的以抑郁为主要症状的一组心境障碍或情感性障碍,包括注意缺失、无快感体验、睡眠障碍、反复自杀念头等,是一种高发病、高致残、高复发的疾病[1]。其病因和病理生理学机制复杂,至今尚未完全阐明。可能与社会、心理,以及遗传、应激、神经内分泌异常、神经递质功能紊乱等各种生物学因素有关[2]。目前突触丢失以及突触超微结构的改变也被认为是抑郁发病机制之一,越来越受到人们的关注[3]。人参(Panax ginsengCA Mey)是五加科植物的根茎,享有百草之王的美誉。人参皂苷Rgl是人参的标志性成分,前期研究已经证明,人参皂苷Rg1具有改善神经退行性疾病的作用,如老年痴呆、脑缺血、帕金森病。它还能够增加神经发生和突触可塑性,具有重要的神经保护作用[4]。而人参皂苷Rg1是否具有抗抑郁的作用并没有得到广泛的研究和认同,所以本研究是通过慢性应激模型来探讨人参皂苷Rg1的抗抑郁活性以及对突触超微结构的影响。
1 材料与方法
1.1 材料
1.1.1 动物 ♂ SD 大鼠,250~300 g,60只,购于北京维通利华实验动物技术有限公司。合格证编号:SCXK-2011V0012。大鼠饲养于清洁级动物房中,平均室温和相对湿度控制在(22±2)℃和(55±5)%。无应激期间,5只动物一笼。动物在动物房中适应5 d后开始进行实验。
1.1.2 药品与试剂 人参皂苷Rg1(云南极粹生物科技有限公司提供,纯度≥98%);盐酸度洛西汀肠溶胶囊(礼来苏州制药有限公司,批号:A873537C)。戊二醛固定液、四氧化锇固定液、Epon812树脂包埋剂、醋酸双氧铀染液、柠檬酸铅染液均由北京神经外科研究所超微病理研究室提供。
1.1.3 主要仪器 H-7650投射电子显微镜(Hitachi公司,北京神经外科研究所超微病理研究室)。
1.2 方法
1.2.1 分组与给药 SD♂大鼠60只,随机分为6组,每组10只。①正常组:正常饲养;②模型组:接受28 d慢性温和不可预见性应激制备抑郁模型。③阳性对照组:抑郁模型 +度洛西汀(10 mg·kg-1);④ 人参皂苷Rg1低剂量组:抑郁模型+人参皂苷Rg1(5 mg·kg-1);⑤人参皂苷Rg1中剂量组:抑郁模型+人参皂苷Rg1(10 mg·kg-1);⑥人参皂苷Rg1高剂量组:抑郁模型+人参皂苷Rg1(20 mg·kg-1)。人参皂苷Rg1易溶于水,双蒸水溶解,分别配制成 0.5、1、2 g·L-1溶液;度洛西汀将其胶囊中内容物放入研钵研成粉末,加入双蒸水,制成1 g·L-1混悬液),单次单剂量灌胃给药。正常组和模型组以相同方式按体重给予双蒸水。
1.2.2 慢性温和不可预见性应激大鼠模型 按照文献方法[5]进行抑郁大鼠模型的制备。除正常组之外其余各组均接受慢性应激28 d,包括:禁食24 h,禁水 24 h,噪音 1 h,倾斜 45°12 h,冰水游泳 10℃6 min,通宵照明 12 h,夹尾 1 min,拥挤 12 h,束缚 4 h,水平振荡 160 r·min-145 min,湿垫料 12 h。每天随机选择2种刺激,共28 d。
1.2.3 行为学测定 强迫游泳实验:给药1 h后,将大鼠置于直径50 cm,水深30 cm,水温(25±2)℃的圆桶中,观察5 min,记录各组动物在整个5 min内的不动时间。不动状态为:大鼠在水中停止挣扎,或呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面的状态。
糖水消耗实验:快感缺失是抑郁症的核心症状,对动物模型的评价则以一定时间内消耗一定浓度的蔗糖溶液量或百分比为衡量标准。首先给予大鼠质量分数为1%的蔗糖溶液预适应48、24 h后大鼠禁食禁水12 h,之后每只大鼠单笼饲养给予两只相同的水瓶,分别装有质量分数为1%的蔗糖水和正常饮用水,统计1h内大鼠摄入的蔗糖溶液和饮用水量,计算出蔗糖消耗百分比〔蔗糖消耗百分比=蔗糖溶液摄入量/(蔗糖溶液摄入量+饮用水摄入量)〕。
1.2.4 电镜生物样品制备 各组大鼠行为测试之后以水合氯醛腹腔麻醉,灌流固定,开颅取脑,在解剖镜下切取额前皮质区组织块,并将该组织切成1 mm3的小块,经四氧化锇固定2 h后,梯度酒精脱水,Epon812包埋,超薄切片机切片,醋酸铀、柠檬酸铅双重染色,每例观察3张铜网,先在低倍率(×5 000)下观察,最终放大到10万倍拍照,每只大鼠至少拍摄4对清晰的突触结构。
2 结果
2.1 人参皂苷Rg1对抑郁大鼠绝望行为的影响强迫游泳实验中,动物在水中的不动时间说明了抑郁动物的一种绝望行为。模型组大鼠的不动时间与正常组相比有明显增加(P<0.01)。人参皂苷Rg1 5、10、20 mg·kg-1组与模型组相比,不动时间明显减少(P<0.01),见 Tab 1。
2.2 人参皂苷Rg1对抑郁大鼠兴趣缺失行为的影响 兴趣缺失是抑郁症的核心症状之一,而糖水消耗实验可以反映大鼠的快感缺失状态。Tab 2的结果显示,与正常组相比,模型组大鼠糖水摄入百分比明显降低(P<0.01),而给予人参皂苷Rg1 5、10、20 mg·kg-1组均可明显增加应激大鼠的糖水摄入百分比(P<0.01)。
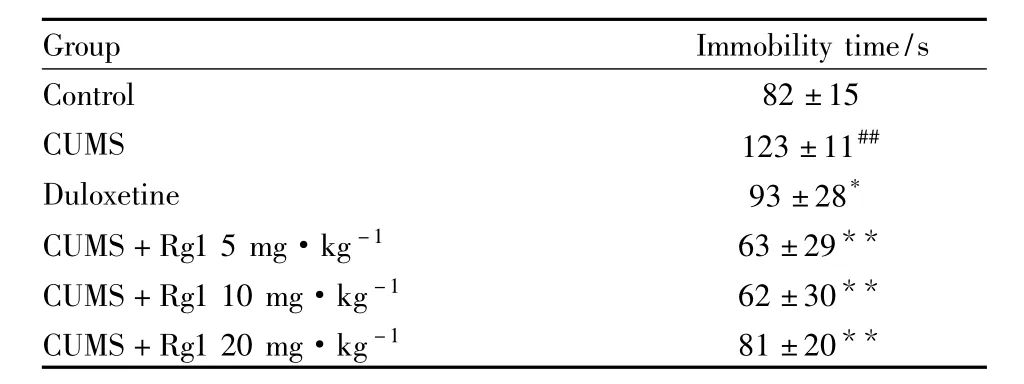
Tab 1 Effects of Ginsenoside Rg1 on immobility time in forced swim test in rats(n=10)

Tab 2 Effects of Ginsenoside Rg1 on sucrose intake percentage in sucrose preference test in rats(n=10)
2.3 慢性应激对大鼠前额皮层突触超微结构的影响及人参皂苷Rg1的改善作用 我们主要观察的是前额皮层突触前膜附近的突触囊泡密度和突触后致密物质厚度。如Fig 1所示,图中突触均为GrayⅠ型突触,即后膜致密物比前膜厚,两膜之间有明显的突触间隙,称为不对称突触,也是兴奋性突触。

Fig 1 Ginsenoside Rg1 improves synaptic ultrastructure in prefrontal cortex of CUMS rats(n=3)
对照组,突触前膜附近聚集着许多突触囊泡,以清亮圆形无核心小泡为主,比较密集;突触后膜有浓密的电子致密物质,较厚。模型组与对照组相比,突触前膜附近的突触囊泡密度明显减小,变得稀疏;突触后致密物质厚度也明显减小。给予人参皂苷Rg1低、中、高剂量和阳性药度洛西汀,均能改善突触的异常变化。尤其Rg1 10、20 mg·kg-1组与模型组相比,突触前膜附近的突触囊泡密度明显变大,突触后致密物质厚度也明显增大,与正常组很接近。
3 讨论
慢性温和不可预知性应激(CUMS)可模拟一系列抑郁症的核心症状,如兴趣缺失、绝望行为、睡眠障碍等等,是一个典型的、常用的研究抑郁模型,用于抗抑郁新药的筛选、临床作用机制及抑郁症病理生理机制的研究。本研究采用CUMS建立大鼠抑郁模型,选择强迫游泳和糖水偏好这两个经典的行为学实验,来检测抑郁大鼠的绝望行为和兴趣缺失等行为障碍。我们的研究结果证明了人参皂苷Rg1 5、10、20 mg·kg-1剂量均能减少抑郁大鼠在强迫游泳实验中的不动时间,增加糖水的摄入量,对CUMS诱导的抑郁行为和突触超微结构的异常有很好的改善作用。但人参皂苷Rg1高、中、低剂量组之间并没有表现出量效关系,在行为学实验中均呈阳性结果,且组间差异无显著性。可能原因是在神经精神领域的研究中,往往存在最适剂量,并不是在一定剂量范围内,随剂量增加作用效力也增加,因为神经通路、神经递质及受体间的影响因素太多。
大量研究证明,应激可以导致脑内结构的改变,这种改变集中体现在神经元结构可塑上,如突触、树突、树突棘及细胞的数量。抑郁大鼠的脑中多个脑区都存在突触和突触棘丢失的现象,树突长度也有缩短,如海马、额前皮质、前扣带皮层等[6-7]。额前皮质区,是一个与情绪调节有着密切的联系脑区。额叶受损的人,严重影响着他的情绪和社会行为,大多数人容易患有精神分裂症、重性抑郁和焦虑[8]。因此本研究选择了额前皮质区作为主要的脑内区域,来研究抑郁症造成的突触结构的变化。有文献报道[9],应激可导致额前叶皮层突触数量减少,而且额前叶皮层容积也有所缩小。我们的实验结果证明,长期应激会使大鼠额前皮质区突触超微结构发生改变,突触前膜的突触囊泡密度明显减小,突触后致密物质厚度也明显减小。在口服给予人参皂苷Rg1后,突触囊泡密度和突触后致密物厚度都有明显增大,抑郁的行为也有所改善。
我们实验室的前期研究还证明,人参皂苷Rg1能改善认知功能和性功能障碍,调节内分泌,提高突触可塑性和神经发生,还具有雌激素样的保护作用[10-13]。这些研究都说明人参皂苷Rg1除了能改善抑郁的核心症状外,还能治疗抑郁的一些伴随症状,如认知障碍、性功能障碍等等。而且从微观的角度去探究抑郁症机制,人参皂苷Rg1还能够改善突触的超微结构。因此人参皂苷Rg1很有可能成为临床新型、安全的抗抑郁剂。
[1]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193 -6.
[1]Liu J L,Yuan Y H,Chen N H.Research progress in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193 - 6.
[2]李云峰,张有志.抗抑郁及抗狂躁药[M].张均田,张庆柱,张永祥,主编.神经药理学.北京:人民卫生出版社,2008:522-50.
[2]Li Y F,Zhang Y Z.Antidepressant drug and antimanic drug[M].Zhang J T,Zhang Q Z,Zhang Y X.Chief editor.Neuropharmacology.Beijing:People’s Medical Publishing House,2008:522-50.
[3]Morinobu S.Physiopathological mechanism of depression in relation to neurotrophic and growth factors and synaptic plasticity[J].Seishin Shinkeigaku Zasshi,2009,111(6):687 -91.
[4]李 娜.人参皂苷Rg1治疗神经退行性疾病的研究进展[J].中国老年学杂志,2012,32(15):3345 -7.
[4]Li N.Research progress in gensenoside Rg1 treatment of neurodegenerative disease[J].Chin J Gerontol,2012,32(15):3345 -7.
[5]Sun J D,Liu Y,Yuan Y H,et al.Gap junction dysfunction in the prefrontal cortex induces depressive-like behaviors in rats[J].Neuropsychopharmacolog,2012,37:1305-20.
[6]Bennett M R.The prefrontal-limbic network in depression:A core pathology of synapse regression [J].Prog Neurobiol,2011,93(4):457-67.
[7]Sorra K E,Harris K M.Overview on the structure,composition,function,development,and plasticity of hippocampal dendritic spines[J].Hippocampus,2000,10:501 -11.
[8]王一牛,罗跃嘉.前额叶皮质损伤患者的情绪异常[J].心理科学进展,2004,12(2):161-7.
[8]Wang Y N,Luo Y J.Emotional disorders in patients with prefrontal cortex lesions[J].Adv Psychol Sci,2004,12(2):161 -7.
[9]Marsden W N.Synaptic plasticity in depression:Molecular,cellular and functional correlates[J].Prog Neuropsychopharmacol Biol Psychiatry,2013,43(2):168-84.
[10]张均田.人参皂苷Rgl的促智作用机制——对神经可塑性和神经发生的影响[J].药学学报,2005,40(5):385-8.
[10]Zhang J T.Nootropic mechanisms of ginsenoside Rgl—influence on neuronal plasticity and neurogenesis[J].Acta Pharm Sin,2005,40(5):385-8.
[11]Shen L,Zhang J.NMDA receptor and iNOS are involved in the effects of ginsenoside Rg1 on hippocampal neurogenesis in ischemic gerbils[J].Neurol Res,2007,29(3):270 -3.
[12]Shen L H,Zhang J T.Ginsenoside Rg1 promotes proliferation of hippocampal progenitor cells[J].Neurol Res,2004,26(4):422-8.
[13]李文娜,肖 苑,黄燮南.人参皂苷Rg1非心血管和神经系统药理活性研究进展[J].中国药理学通报,2012,28(6):751-4.
[13]Li W N,Xiao Y,Huang X N.Research progress on pharmacological effects of Ginsenoside Rg1 on non-cardiovascular and non-central nervous systems[J].Chin Pharmacol Bull,2012,28(6):751-4.

