火炮打击兔应激防护模型肠组织病理及NMDAr1表达的形态学研究
刘胜利 张建华 俞雄杰 周 龙 林进皇 余 海 郁毅刚▲
1.解放军第一七五医院暨厦门大学附属东南医院神经外科,福建漳州 363000;2.解放军73131部队,福建漳州 363000
在现代战争中,火炮打击带来的爆震性损伤,仍是部队减员最为重要的原因之一。而火炮打击后,除可见的肢体损伤外,由此引起的应激炎症反应综合征,对有生力量战斗力的影响不可忽视。本实验探讨了在模拟实战情况下火炮打击后,爆震伤引起的兔的应激炎症反应综合征的情况,在之前笔者分别探讨了卵巢、血清自由基等组织器官对于应激反应的病理及免疫组织化学的形态学变化[1-2]。本实验主要探讨肠组织病理改变及免疫组织化学中的NMDAr1(N-methyl-D-asparate receptor-1,NMDAr1)受体在肠应激反应中的作用机制。
1 材料与方法
1.1 仪器、试剂及动物
团进攻炮火覆盖火力类型:武装直升机火箭弹、XX自行榴弹炮、XX牵引加农炮、XX自行火箭炮、水陆两栖坦克、XX轮式突击炮、XX迫击炮、XX反坦克导弹。健康成年日本大耳白兔30只,雌雄不拘,清洁级,体质量2.5~3.0 kg(厦门大学医学院动物中心提供);按照随机表法分为3组,空白对照组6只、反角隐蔽组6只、迎面隐蔽组18只(距离攻击目标10 m隐蔽组6只,20 m隐蔽组6只,30 m组隐蔽6只)。
1.2 实验方法
按照文献方法设计实验[1],实验时间和环境条件为南方秋季中午山地环境,环境温度16~28℃,湿度为43%~65%。实验兔常规喂养,演习当日凌晨运至目标高地,炮靶前迎面10、20、30 m处挖掘约1 m深掩体,各放置实验兔6只,上覆盖硬质木板、松枝,留通气道。炮靶后反角10 m处挖掘同样掩体,放置实验兔6只。空白对照组于炮靶阵地外10 km营区喂养。中午演习开始,全过程2 h。轰炸机俯冲(未投弹),持续火炮急袭5 min。各型火炮、坦克、导弹、武装直升机集群连续发弹若干,期间暂停2次,各10 min。演习结束,工兵排爆清理阵地后进场取回实验兔。伤后6 h处死存活兔解剖,取肠组织标本,4%甲醛固定。
1.3 肠组织病理检测
取4%甲醛固定肠组织,石蜡包埋,切片行HE染色,光镜下观察形态学变化,由同一病理医师采用盲法评价。观察肠组织结构层次是否完整,肠组织细胞肿胀、变性、坏死,间质出血、水肿等情况。
1.4 肠组织NMDAr1免疫组织化学表达的测定
取4%甲醛固定肠组织,石蜡包埋,连续切片(4μm),每例标本切5张免疫组织化学染色用。采用改进型SP法进行免疫组织化学染色,严格参照试剂盒说明操作。试剂盒型号,购于XX公司。每次染色时均用已知阳性切片作阳性对照,用PBS(磷酸缓冲液,0.01 mol/L,pH 值 7.2)代替一抗作阴性对照。NMDAr1表达均位于胞质和胞核内,表现为浅黄、棕黄或棕褐色。用半定量法评估其染色,无阳性细胞数为(-),阳性细胞数<25%为(+),25%~50%为(++),51%~75%为(+++),>75%为(++++)。
2 结果
2.1 各组实验兔的一般情况
各组实验兔均无直接火力命中。与空白对照组比较,反角隐蔽组实验兔全部存活,部分精神萎靡、反应迟钝、伏地,少部分耳道出血。因弹着点不规律,迎面隐蔽3组距离无差异,合并为一组。迎面隐蔽组18只实验兔当场死亡9只,至伤后6 h取肠组织标本前再死亡3只,死亡率达66.7%(12/18)。剩余6只存活实验兔编为迎面隐蔽组,与另外两组同时刻点取肠组织进行病理形态学及免疫组织化学检测,每只取5张切片进行免疫组织化学表达强度及形态学观察研究。
2.2 肠组织HE染色结果
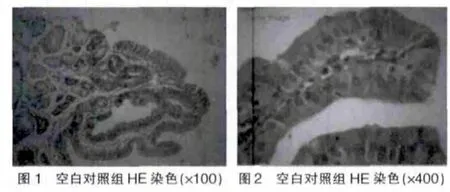
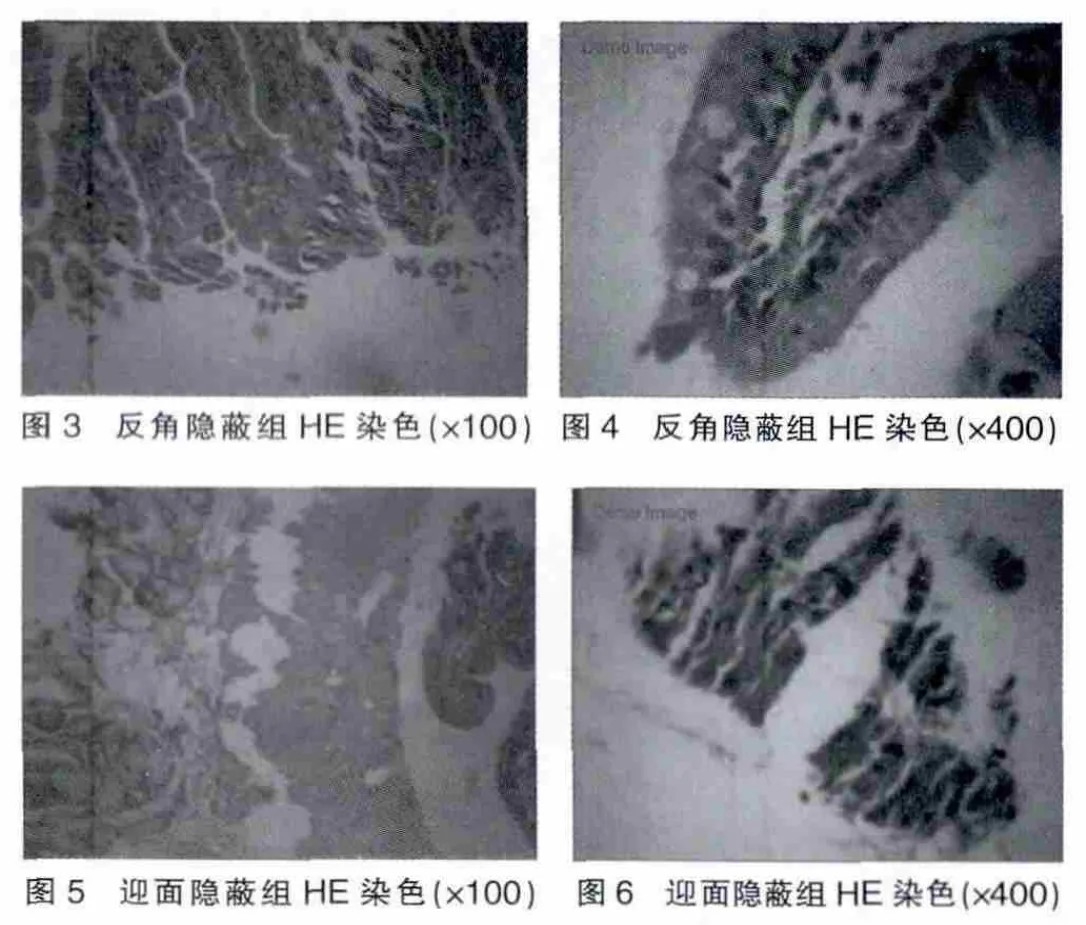
空白对照组肠组织切片HE染色显示,肠黏膜层、黏膜下层、肌层和浆膜层完整,结构均匀致密。环形皱壁表面存在多量不规则形状柱状绒毛,其间上皮及固有层完整。上皮间混杂杯状细胞。绒毛中心为结缔组织,可见黏膜下神经丛。绒毛基底可见潘氏细胞和肌间神经丛分布,肌浆深染,胶质丰富,可见散在分布血管,腔内少量红细胞,未见明显炎症细胞(图1、图2)。反角隐蔽组肠组织切片HE染色显示,分层结构存在。柱状绒毛上皮顶部变性坏死,局部脱落,上皮细胞胞质空泡变性;细胞间少量红细胞,炎症细胞浸润(图3、图4)。迎面隐蔽组肠组织切片HE染色显示,细胞结构层紊乱,分界不清,部分坏死,崩解;细胞数明显减少,黏膜层及下层和肌层分离;可见散在红细胞分布,浆细胞浸润(图 5、图 6)。
2.3 肠组织NMDAr1免疫组织化学的表达
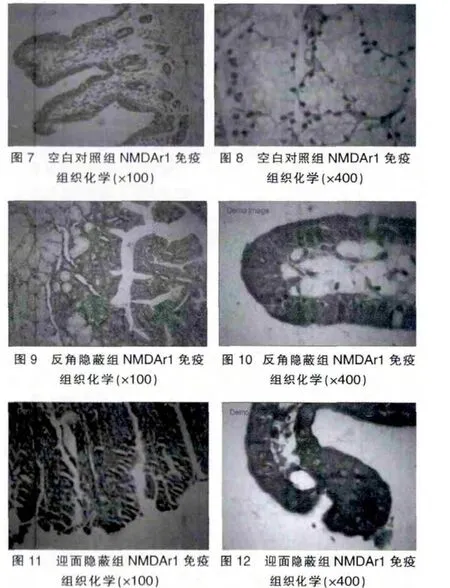
空白对照组见柱状绒毛完整,绒毛中心固有层可见分布NMDAr1表达阳性神经丛棕染,NMDAr1蛋白少量表达(+)(图7、图 8);反角隐蔽组可见绒毛肿胀,固有层变性,细胞减少,黏膜上皮细胞中神经丛广泛棕染(++),NMDAr1中量表达(图9、图10);迎面隐蔽组,可见绒毛坏死崩解,全部胞质、胞膜均棕染,色深。NMDAr1大量表达(++++)(图11、图12)。迎面隐蔽组、反角隐蔽组NMDAr1免疫反应强度均高于对照组,迎面隐蔽组NMDAr1免疫反应强度亦高于反角隐蔽组。
2.4 NMDAr1表达与组织病理的关系
通过3个实验组的观察,空白对照组、反角隐蔽组与迎面隐蔽组NMDAr1免疫组织化学的表达量逐渐递增,肠的病理改变也由可逆的变性加重为不可逆的坏死(表1)。

表1 NMDAr1表达与组织病理的关系
3 讨论
在火炮打击后,对比空白对照组、反角隐蔽组及迎面隐蔽组3组的生存率,发现反角掩体兔的存活率为100.0%(18/18),而迎面隐蔽组死亡率高达 66.7%(12/18),其有力地说明战地反角隐蔽可有效保证在密集火炮打击下生存。同时,也可说明迎面角投弹可有效消灭敌军。此外,如何减轻有生力量对炮击带来的爆震、弹片、噪声、应激、精神损伤等复合性损伤,保障有生力量的战斗力也极为重要。目前研究表明[3-6],加强日常训练,模拟战场环境训练,综合卫生心理训练,改善机体营养状况及伤后心理护理,均可提高机体应激适应能力。
众所周知,应激反应是把“双刃剑”,一般情况下的应激反应是对人有利的,但长时间过于强烈的应激反应会给人带来损伤。临床上因重型损伤导致的应激性消化溃疡较为常见。目前研究表明,肠的应激性损伤主要与脑-肠轴相关,而较早所认知的下丘脑-垂体-肾上腺皮质系统(HPA轴),内脏高敏效应、精神心理等因素可能仅是其在胃肠道应激作用中的具体表现[7-10]。胃肠道直接或间接的受中枢神经系统、自主神经系统的共同支配[11-12],并通过共同的递质——脑肠肽,建立起脑-肠轴调节的通路。已证实的脑肠肽包括组胺、5-羟色胺(5-HT)、一氧化氮(NO)、去甲肾上腺素(NE)、神经降压素(NT)、P 物质(SP)、降钙素相关肽(CGRP)、血管活性肠肽(VIP)等[13]。这些物质通过直接或间接影响胃肠平滑肌蠕动、血管的收缩、腺体的分泌实现对胃肠道的作用。较为深入地研究脑-肠轴的关系,明确脑肠肽在导致肠应激损伤通路中的节点,可确定药物治疗的新靶点,为探索新的预防与治疗方法提供思路。
NMDAr1是一种兴奋性氨基酸的特异性离子型受体,主要分布于大脑皮质、丘脑、纹状体、海马等的突出后膜上,此外其在脊髓背角运动神经元轴突中也有分布,并延伸到内脏神经末梢。目前研究表明,其与应激反应主要的通路HPA轴有着密切的关系[14]。本实验结果显示,随着兔的肠应激性病理改变的加重,NMDAr1在肠内的免疫组织化学表达量逐步增加。而Varga G等[15]研究证实,通过抑制NMDAr1受体可降低肠炎模型小鼠的炎症反应,表明NMDAr1参与了爆炸及爆炸应激状态下肠组织病理损伤过程。其可能的作用机制有以下几个方面:①中枢的NMDAr1通过激活HPA轴促进肾上腺皮质激素的分泌和释放,介导炎症应激反应[16]。叶建宁等[17]通过测定严重烫伤小鼠海马NMDAr1受体的表达研究认为,NMDAr1减弱了肾上腺皮质激素的负反馈调节,从而引起肾上腺皮质激素大量分泌。②NMDAr1通过降低胃黏膜VCL的表达,导致胃黏膜组织屏障发生变化,使胃酸、胃蛋白酶等更容易破坏黏膜的完整性[18]。③外周NMDAr1受体增强外周高敏化[19],Du J等[20]应用电生理学单纤维记录方法发现正常状态下给予NMDAr1可以诱发27%左右的C纤维放电,而在足底注射CFA后,NMDAr1诱发C纤维放电的概率(86%)和频率显著增加,并且诱发伤害性感受器放电所需的NMDAr1阈值浓度也较正常状态明显下降。痛阀的降低使应激变的更加敏感,应激的强度相应增高。④外周NMDAr1受体增强了神经递质的释放。在炎症和损伤情况下,外周伤害性感受器持续受到刺激,导致中枢终末释放的神经递质增多,引起脊髓背角突触后神经元超兴奋,该神经元将超兴奋的信息继续向上传递到脑中枢从而产生慢性痛[21]。持续的慢性疼痛导致应激反应持续时间增长,炎症加重。
通过本实验结果可以清晰观察到,兔的肠病理结构改变由轻到重时,NMDAr1的表达量也由(+)增加至(++++),这也佐证了目前对于NMDAr1的研究,NMDAr1在低水平量时,其介导的应激反应,起到自我保护作用,当其超过保护机制的临界点时,将损伤机体。由此,一旦确定NMDAr1损伤机体的扳机点,将有可能在其介导炎症前,采取阻断措施,从而减轻对机体的损伤。可见今后对于NMDAr1介导炎症通路及其扳机点的探讨,或者针对更加广泛的全身应激反应综合征的多通路、多指标的探讨,对于预防治疗应激性病变将产生不可估量的作用。
[1]林也容,张建华,郁毅刚,等.山地团进攻制式火炮打击兔应激防护模型血清自由基变化实验研究[J].临床和实验医学杂志,2012,11(15):1167-1169.
[2]林也容,张兰,李娟,等.火炮打击兔应激防护模型卵巢病理及P38表达的形态学研究[J].临床和实验医学杂志,2013,12(18):1437-1439.
[3]王新兴,钱令嘉,冷雪,等.不同训练强度士兵的应激适应能力[J].解放军预防医学杂志,2004,22(3):171-173.
[4]李敏,李彦章,黄梅园,等.军事演习应激对野战部队官兵心理和情绪的影响[J].第三军医大学学报,2007,29(19):1894-1895.
[5]赵秋玲,杨全峰,李晓明.急进驻高原官兵胃肠道应激反应的营养干预研究[J].临床军医杂志,2011,39(6):1147-1149.
[6]甘元琼.心理护理在当代护理工作中的运用和作用[J].中国当代医药,2009,16(15):117-119.
[7]TachéY,Perdue MH.Role of peripheral CRF signalling pathways instress-related alterations of gut motility and mucosal function[J].Neurogastroenterol Motil,2004,16(1):137-142.
[8]Stengel A,TachéY.Corticotropin-releasing factor signaling and visceral response to stress[J].Exp Biol Med (Maywood),2010,235(10):1168-1178.
[9]王敬东.脑-肠互动在肠易激综合征发病中的作用[J].世界华人消化杂志,2006,14(34):3299-3301.
[10]李宁宁,方秀才.脑-肠轴在肠易激综合征发病中的作用[J].胃肠病学和肝病学杂志,2013,22(2)163-166.
[11]Giaroni C,Zanetti E,Chiaravalli AM,et al.Evidence for a glutamatergic modulation of the cholinergic function in the human enteric nervous system via NMDA receptors[J].Eur J Pharmacol,2003,476(1-2):63-69.
[12]Liu MT,Rothstein JD,Gershon MD,et al.Glutamatergic enteric neurons[J].JNeurosci,1997,17(12):4764-4784.
[13]Varga G,Balint A,Burghardt B,et al.Involvement of endogenous CCK and CCK1 receptors incolonic motor function[J].Br J Pharmacol,2004,141(8):1275-1284.
[14]陆建华,黎海蒂,高京生.烫伤大鼠海马N-甲基-D-天冬氨酸受体亚型基因表达的变化[J].中华烧伤杂志,2002,18(3):180-182.
[15]Varga G,魪rces D,Fazekas B,et al.N-Methyl-D-aspartate receptor antagonism decreases motility and inflammatory activation in the early phase of acute experimental colitis in the rat[J].Neurogastroenterol Motil,2010,22(2):217-225.
[16]张庆宇,房明.应激反应中肾上腺激素的作用[J].中国当代医药,2009,16(8):184-185.
[17]叶建宁,陆建华,熊加祥.海马NMDAr1受体调节严重烫伤应激后HPA轴兴奋性的相关机制研究[J].中华神经医学杂志,2006,5(10):982-985.
[18]高会军,黄裕新,王胜智,等.应激对大鼠胃粘膜VCL和海马NMDAr1R2 表达的影响[J].山西医科大学学报,2012,43(10):727-803.
[19]Gaudreau GA,Plourde V.Involvement of N-methyl-d-aspartate(NMDA) receptors in a rat model of visceral hypersensitivity[J].Behav Brain Res,2004,150(1-2):185-189.
[20]Du J,Zhou S,Coggeshall RE,et al.N-methyl-D-aspartate-induced excitation and sensitization of normal and inflamed nociceptors[J].Neuroscience,2003,118(2):547-562.
[21]Woolf CJ,Salter MW.Neuronal plasticity:increasing the gain in pain[J].Science,2000,288(5472):1765-1769.

