Stenotrophomonas maltophilia产角蛋白酶对羊毛的作用机理探讨
李 贲,吴建明,朱华君,王 强,王 平,范雪荣
(1.江南大学生态纺织教育部重点实验室,无锡214122;2.宁波雅戈尔毛纺织染整有限公司,宁波315192;3.无锡协新毛纺织有限公司,无锡214192)
角蛋白酶是降解角蛋白的一类蛋白酶,由真菌、放线菌或细菌等多种微生物产生[1-3]。角蛋白酶来源不同,其结构、理化性质、活性也不同,其降解角蛋白的机制也不尽相同。这些酶大多属于细胞外酶,能将羽毛、羊毛、头发和指甲等不溶性底物降解[4]。在食品、饲料、制革、化妆品和医药等领域中有广泛应用[5-6]。
角蛋白酶对角蛋白降解机制非常复杂,目前还没有定论。普遍认为其降解角蛋白分3个步骤:首先角蛋白酶破坏角蛋白分子中的二硫键,形成变性角蛋白,从而使角蛋白丧失不溶于水和抗蛋白酶作用的能力;然后进一步水解变性蛋白,生成多肽、寡肽和游离氨基酸;最后通过转氨基作用产生氨和硫化物,使角蛋白彻底水解[7]。Dariot等用孢芽杆菌P 45分泌的角蛋白酶降解羽毛,72 h后降解率达90%,但它对头发没有显著降解作用[8]。蔡少波等[9]从腐烂的羊毛织物中分离出一种具有降解蛋白能力的细菌Pseudomonas,通过优化培养条件和处理工艺,该细菌分泌的角蛋白酶能提高羊毛和聚酯混合织物的抗毡缩性能和抗拉强度。周雯等[10]采用 Bacillus subtilis产角蛋白酶与蛋白酶一浴法处理羊毛,研究结果表明该角蛋白酶能促进蛋白酶对羊毛鳞片的降解,二者协同作用能有效去除羊毛鳞片。
本文应用Stenotrophomonas maltophilia产角蛋白酶,以羊毛角朊蛋白为底物,通过测定酶反应前后残液中巯基和肽键的变化,羊毛胱氨酸分析以及SEM测试,对角蛋白酶作用机理做了深入探讨。
1 试验部分
1.1 试验材料
凡立丁白坯(36 tex×36 tex,180 g/m2),无锡协新毛纺织有限公司;羊毛纤维(美利奴羊毛,平均直径25 μm,平均长度10 cm),无锡百芳毛纺厂;Stenotrophomonas maltophilia产角蛋白酶(酶活20 U/mL),江南大学生物工程学院;蛋白酶Savinase 16L(酶活160000 U/mL),诺维信公司;其他试剂均为分析纯。
1.2 试验仪器
Quanta 200扫描电子显微镜(荷兰FEI公司),UV-2802S扫描型紫外/可见分光光度计(美国Unico公司),WHYF-2F恒温振荡水浴锅(台湾瑞比公司),TDL40B高速离心机(上海安亭科学仪器厂),Agillent 1100氨基酸自动分析仪(美国Agillent公司)。
1.3 羊毛角朊蛋白溶液的制备
称取洗净的羊毛纤维1g,剪碎,以10 mL含0.7g十二烷基硫酸钠(SDS)、4.8g尿素及0.35g二硫苏糖醇(DTT)的水溶液于50℃溶解5 h,过滤除去不溶物,过滤后的溶液以去离子水透析3 d,除去小分子物质即得角蛋白溶液[11]。
1.4 试验方法
1.4.1 角蛋白酶处理 以5 mg/mL羊毛角朊蛋白为底物,用0.05 mol/L Tris/HCl缓冲液(pH值7.5)配制2.5%(v/v)浓度的角蛋白酶溶液,在55℃、体积比1:10的条件下反应1 h。
以羊毛织物为反应底物,织物先经90℃热水处理10 min,用50%(o.w.f)角蛋白酶溶液(pH值7.5)、JFC 1 g/L,在55℃、浴比1:50的条件下处理1 h。处理后试样用清水充分洗净、烘干。
1.4.2 蛋白酶处理 以羊毛角朊蛋白为底物,用0.05 mol/L Tris/HCl缓冲液(pH值8.5)配制 0.1%(v/v)浓度的蛋白酶溶液,在55℃、体积比1:10的条件下反应1 h。
以羊毛织物为反应底物,织物先经90℃热水处理10 min,用1%(o.w.f)蛋白酶溶液(pH值8.5)、JFC 1 g/L,在55℃、浴比1:50的条件下处理1 h。处理后试样用清水充分洗净、烘干。
1.4.3 角蛋白酶、蛋白酶二浴法处理羊毛角朊和羊毛织物:先经角蛋白酶处理,后经蛋白酶处理,试验方法同上。
1.5 巯基的测定
5,5'-二硫代-2-硝基苯甲酸(DTNB)在 pH值8.0时与巯基相互作用,生成硫代硝基苯阴离子,硫代硝基苯阴离子在412 nm处的摩尔吸光系数ε为136000,吸光值与巯基的数量成正比[12]。本实验以羊毛角朊蛋白为底物,用角蛋白酶断裂其二硫键,然后根据以下反应测定巯基数。

将取20 mg DTNB溶于5 mL 0.1 mol/L、pH值8.0的Tris-HCl缓冲液配制DTNB试剂。取4 mL 0.1 mol/L Tris-HCl缓冲液(pH值8.0,含10 mol/L尿素和0.01 mol/L EDTA)加入到1 mL羊毛角朊蛋白中,40℃保温30 min。然后加入125 μL DTNB试剂,25℃下显色10 min,测定412 nm处溶液吸光度。以半胱氨酸为标准底物,按下式计算巯基浓度[13]:

式中:C为蛋白质浓度(本实验为5.0 mg/mL);A412为412nm处吸光度;D为稀释倍数(本实验为10)。
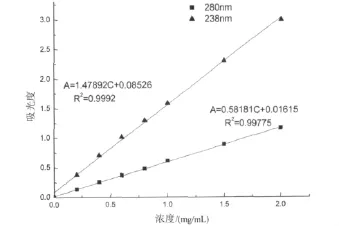
图1 238 nm和280 nm牛血清蛋白标准曲线Fig 1 Standard curve of bovine serum albumin at 238 nm and 280 nm
1.6 蛋白质标准曲线绘制
利用牛血清蛋白配制一系列标准浓度的蛋白质溶液,利用紫外分光光度计分别于238nm处和280 nm处测试各标准浓度蛋白质溶液的吸光度,绘制标准蛋白的浓度吸光度曲线。
1.7 羊毛氨基酸组成分析
将不同条件处理后的羊毛织物在110℃、6 mol/L HCl中水解24 h,水解完毕后,将水解管中液体摇匀过滤,并用双蒸水将滤液定容至50 mL;摇匀后再取1 mL滤液于塑料离心管中,冻干机真空浓缩6 h至近干燥状态。之后取1 mL 0.02 mol/L的盐酸于离心管中震荡均匀,14000 r/min离心15 min,吸上清液0.8 mL于氨基酸测定仪样品瓶,采用Agilent1100氨基酸分析仪分析羊毛试样水解液的组成及相对质量浓度。
1.8 SEM分析
将羊毛纤维在真空条件下表面镀金后,采用Quanta 200扫描电子显微镜对其进行观察拍照。测试条件:电压5 kV,放大倍数2000倍。
2 结果与讨论
2.1 角蛋白酶处理后残液中巯基的变化
以5 mg/mL羊毛角朊蛋白为底物,分别采用蛋白酶、角蛋白酶和两者二浴法处理。然后采用DTNB比色法测定残液中巯基数量的变化。
从图2中看出,蛋白酶工艺处理后残液中巯基含量与未经处理羊毛角朊蛋白相比变化不大,分别为60.0 μmol/g 和 59.5 μmol/g;角蛋白酶和二浴法工艺处理后残液巯基含量大幅增加,分别为74.3 μmol/g和75.0 μmol/g。在羊毛角朊蛋白溶液制备的过程,羊毛纤维的部分二硫键被DTT、SDS和尿素共同作用打断,形成巯基化合物,因此羊毛角朊蛋白中也大量存在巯基。在单独使用蛋白酶工艺处理后残液巯基数和未经酶处理的羊毛角朊原样巯基数相差不多,由此推断蛋白酶对二硫键没有降解作用,不能使之形成巯基化合物;而Stenotrophomonas maltophilia产角蛋白酶却有此功能,所以单用该酶处理后,残液巯基含量较高。二浴法工艺处理后,巯基数量相对于羊毛角朊原样大幅增加,但较单独使用角蛋白酶后的巯基数量没有显著变化,说明二浴法时蛋白酶分解蛋白质过程中巯基数量没有明显增加。
2.2 酶处理羊毛角朊蛋白残液中的蛋白质浓度
蛋白质分子中的色氨酸、酪氨酸和苯丙氨酸残基的苯环含有共轭双键,导致蛋白质溶液在280nm处有一个紫外吸收高峰。此外在238nm处,蛋白质溶液也有一个肽键特征吸收峰[14]。利用一定波长下的蛋白质溶液的紫外吸收值与蛋白质溶液浓度成正比,可对溶液中蛋白质含量进行定量测试。本文以羊毛角朊蛋白为底物,分别采用角蛋白酶和蛋白酶对其处理,之后测试紫外吸收值并通过图1所示牛血清蛋白浓度—吸光度标准曲线线性拟合方程测试水解液中蛋白质含量,结果如图3所示。
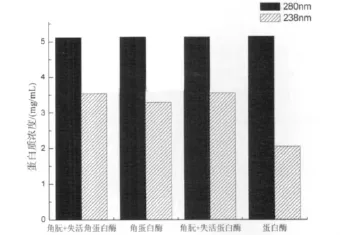
图3 不同紫外吸收波长下的牛血清蛋白标准曲线测得的蛋白质浓度Fig 3 Protein concentration at different ultraviolet absorption wavelengths of bovine serum albumin standard curve
由图3可知,在280nm波长下,通过测得的紫外吸光值得到的蛋白质溶液浓度四者都差不多,浓度约为5 mg/mL;在238nm波长下,通过测得的紫外吸收波长得到的羊毛角朊蛋白+失活角蛋白酶的蛋白质浓度约为3.5 mg/mL,单独角蛋白酶处理后的羊毛角朊蛋白的蛋白质浓度约为3.3 mg/mL,与前者相比,只有少量减少。单独蛋白酶处理后的羊毛角朊蛋白中蛋白质大量减少,浓度约为2.0 mg/mL,和羊毛角蛋白+失活蛋白酶相比,减少了42.9%。本实验所选用蛋白酶Savinase 16L为丝氨酸蛋白酶,该水解酶是一种肽链内切酶,主要促使疏水性氨基酸尤其是酪氨酸、色氨酸、苯丙氨酸及亮氨酸的羧基端多肽裂解,作用于它们的肽键,从而降解蛋白质大分子链,将其水解成小分子蛋白质或者氨基酸。在280nm波长下,测得的吸光度是由于溶液中蛋白质分子中的色氨酸、酪氨酸和苯丙氨酸残基中苯环的共轭双键引起的,经蛋白酶处理后,残液中含有残基共轭双键的蛋白质总量并没有发生变化,所以在该波长下测得的蛋白质浓度没有明显变化。在238nm处测得的吸光度和蛋白质的肽键含量成正比,蛋白酶处理后的羊毛角朊蛋白的肽键大量减少,从而导致其在该波长下测得的蛋白质浓度显著降低。角蛋白酶也属于蛋白酶,它的降解机理和蛋白酶有相似之处。从图中可以发现,羊毛角朊蛋白经角蛋白酶处理后,在280nm波长下测得的蛋白质浓度并没有显著变化,而在238nm波长下测得蛋白质浓度略有下降,说明羊毛角朊中的肽键减少。这可能是因为该角蛋白酶的酶活较低,只能水解少量的肽键,但同时也证明了角蛋白酶具有降解大分子蛋白质的作用[15],只是作用效果不强。
2.3 不同工艺处理后羊毛胱氨酸分析
羊毛纤维鳞片层占羊毛总量的10%左右,其中鳞片外层中胱氨酸含量很高,约占35%[16]。测定不同酶工艺处理后羊毛胱氨酸含量,有助于考查羊毛鳞片的去除情况。表1中列出了不同条件处理后羊毛纤维中胱氨酸的相对质量分数。

表1 不同工艺处理后羊毛纤维胱氨酸相对质量分数Table 1 Relative mass percentages of systine amino acids of wool fibers after different treatments
与未处理原样相比,用角蛋白酶处理后,羊毛纤维胱氨酸相对含量变化不大,仅略有下降。虽然角蛋白酶能降解羊毛鳞片的二硫键,使其变性,但同时角蛋白酶的后续水解能力较差,不能大量水解变性蛋白,该工艺处理后羊毛鳞片得不到有效去除,因此羊毛胱氨酸含量变化不明显。蛋白酶工艺处理的羊毛试样,胱氨酸相对含量略有上升,可能是由于羊毛纤维鳞片层的存在,表面疏水性较强,交联程度较高,蛋白酶处理倾向于将纤维细胞膜复合物水解,部分氨基酸从羊毛内部流出,而鳞片层中胱氨酸浓度变化不大,导致该工艺处理后羊毛纤维胱氨酸相对含量略有上升。二浴法工艺处理后,羊毛纤维胱氨酸含量较原样有显著下降,表明羊毛纤维鳞片层角蛋白得到有效水解。角蛋白酶对羊毛处理后,纤维鳞片层的二硫键被打开,使其可及度较大提升,蛋白酶更容易的进入纤维主体内,既能对纤维主体结构水解,也能对纤维外层变性蛋白降解,使纤维鳞片水解而被部分剥离,从而导致羊毛纤维胱氨酸相对含量降低,同时也验证了二浴法工艺可提高羊毛纤维表面鳞片的去处效果。
2.4 不同工艺处理后羊毛纤维表面形貌
为考查不同酶工艺处理后,羊毛纤维表面鳞片的总体去除情况,采用扫描电子显微镜对其进行表面观察,结果见图4。
从扫描电镜图中发现,未经处理的羊毛原样有特有的鳞片层结构,鳞片轮廓清晰,层次完整有序。经角蛋白酶处理后,羊毛的鳞片层结构依旧很完整,与原样相比无较大区别。这表明,仅用角蛋白酶对羊毛纤维的损伤较小,羊毛外鳞片层没有遭到明显破坏。这与上述氨基酸分析结果相一致。单独使用蛋白酶处理后,鳞片表面变得粗糙,鳞片边缘部分翘起,根部空隙变大。经角蛋白酶和蛋白酶二浴法工艺处理后,羊毛鳞片表面明显被侵蚀破坏,鳞片结构变得非常疏松,大部分鳞片已经被剥离,鳞片表面变得光滑。表明角蛋白酶和蛋白酶二浴法工艺能有效去除羊毛外层鳞片。

图4 羊毛纤维SEM图片Fig 4 SEM images of wool fibers
3 结论
Stenotrophomonas maltophilia产角蛋白酶不但具有断裂角蛋白中二硫键产生巯基的能力,还能降解大分子蛋白质,并水解成小分子蛋白或者氨基酸,但是作用效果不强,其中前者在水解角蛋白过程中起主导作用。羊毛氨基酸分析表明,角蛋白酶能断裂羊毛鳞片层中胱氨酸的二硫键。通过SEM观察,角蛋白酶联合蛋白酶二浴法工艺对羊毛纤维的处理效果较为明显,能有效剥离去除羊毛的鳞片。角蛋白酶作用机理与效果研究为羊毛的生物法改性提供了新的研究思路。
[1]Gradisar H,Kern S,Friedrich J.Keratinase of doratomyces microsporus[J].Applied Microbiology and Biotechnology,2000,53(2):196-200.
[2]Gushterova A,Vasileva-Tonkova E,Dimova E,et al.Keratinase production by newly isolated Antarctic actinomycete strains[J].World Journal of Microbiology and Biotechnology,2005,21:831-834.
[3]Williams C M,Richter C S,Mackenzie J M,et al.Isolation,identification and characterization of a feather-degrading bacterium[J].Applied and Environmental Microbiology,1990,56(6):1509-1515.
[4]Park G T,Son H J.Keratinolytic activity of Bacillus megaterium F 7-1,a feather-degrading mesophilic bacterium[J].Microbiological Research,2007,2:1-8.
[5]Varbanets L D.Current trends in the study of microbial glycopolymers[J].Mikrobiolohichny Zhurnal,2003,65(1):182-190.
[6]曾 毅,李忠琴,许小平.角蛋白酶的研究进展[J].海峡药学,2004,16(6):10-13.
[7]杨建强,汤国营.角蛋白酶研究进展[J].生物技术通报,2005,16(2):201-203.
[8]Daroit D J,Correa A P F,Brandelli A.Keratinolytic potential of a novel Bacillus sp.P45 isolated from the Amazon basin fish Piaractus mesopotamicus[J].International Biodeterioration & Biodegradation,2009,63(3):358-363.
[9]Cai S B,Huang Z H,Zhang X Q,et al.Indentification of a keratinase-producing bacterical strain and eneymatic study for its improvement on shrink resistance and tensile strength of wool and polyesterblended fabric[J].Applied Biochemistry and Biotechnology,2011,163:112-126.
[10]周 雯,纪惠军,王 强,等.角蛋白酶对羊毛蛋白酶防毡整理的促进作用[J]. 纺织学报,2011,32(1):82-88.
[11]Yamauchi K,Yamauchi A,Kusunoki T,et al.Preparation of stable aqueous solution of keratins and physicochemical and biodegradational properties of films[J].Journal of Biomedial Materials Research,1996,31:439-444.
[12]罗明江,罗春霞,吴赣香.Ellman's试剂比色法测定食品中蛋白质的巯基和二硫键[J].郑州粮食学院学报,1986,23(1):92-95.
[13]Mine Y.Effect of pH during the dry heating on the gelling properties og egg white proteins[J].Food Research International,1996,29(2):155-161.
[14]曹红翠.紫外分光光度法测定蛋白质的含量[J].广东化工,2007,8(34):93-95.
[15]涂国全,张 宝,叶亚建,等.链霉菌分解角蛋白的生化机制研究Ⅲ含硫化合物对角蛋白酶作用机理和角蛋白降解的生化机制初步研究[J].江西农业大学学报,1998,20(1):6-10.
[16]Walawskaa A,Rybicki E,Filipowska B.Physicochemical changes on wool surface after an enzymatic treatment[J].Progr Colloid Polym Sci,2006,132:131-137.

