参附注射液对缺氧缺血性脑损伤新生大鼠凋亡诱导因子表达的影响*
徐 艳,王 军
(徐州医学院附属医院儿科,江苏徐州 221002)
1 材料与方法
1.1 材料
1.1.1 动物 新生7d龄SD大鼠,体质量12~18g,均由徐州医学院实验动物中心提供。
1.1.2 主要仪器 8%O2/92%N2混合气体(上海特种气体厂);常压缺氧舱(上海市儿科研究所);手动匀浆器;Western blot所用的仪器设备(徐州医学院神经生物学实验室提供);Eppendor台式超速冷冻离心机(德国eppendo公司);-80℃超低温冰箱(Thermo electron corporation);CK30倒置相差显微镜(日本Olympus);可见分光光度计(上海精密科学仪器有限公司);PCR扩增仪(MJ Research,InC);Thermo酶标仪(上海热电仪器有限公司);凝胶图像分析处理系统(Labworks)(UVP Inc.Upland,CA,USA)。
1.1.3 主要试剂 胞核提取试剂盒(北京五洲元业生物有限公司);AIF一抗(Santa cruz公司)、兔抗羊二抗(北京中杉生物技术有限公司);NBT/BCIP显色剂(碧云天生物公司);Marker(Santa cruz公司);AIF及β-actin引物合成、总RNA抽提试剂盒(Trizol法)、AMV一步法RT-PCR试剂盒(上海捷瑞生物技术有限公司);Tunel凋亡试剂盒(武汉博士德公司)。
1.2 方法
1.2.1 动物模型制备 参照 Rice法[1]制作HIBD模型和假手术模型。将新生7d龄SD大鼠用无水乙醚吸入麻醉(0.5~1.0min)后,取仰卧位,四肢固定于手术板上,颈正中线切开皮肤,游离右侧颈总动脉丝线结扎,并缝合切口造成缺血。回窝休息2h。再置入一体积为2000ml、底部铺有CO2吸收剂钠石灰、与混合气体相连的密闭有机玻璃箱内,该容器置于37℃水浴中。以1~2L/min的速度输入含8%氧、92%氮气的混合气体,持续2h,造成缺氧。假手术组只做颈部切开和右颈总动脉分离术,不结扎,缝合切口后呼吸正常空气。
1.2.2 分组及给药方法 新生7d的SD大鼠随机分为假手术组(S)、生理盐水对照组(C)和参附治疗组(SF)。生理盐水对照组HI后立即腹腔注射生理盐水10ml/kg,每日1次,连续注射3d;参附治疗组HI后立即腹腔注射参附注射液,剂量及用法同生理盐水对照组。每组按术后观察时间点不同进一步分为 3h、6h、12h、24h、3d、7d 6 个亚组,每个亚组8只。
1.2.3 免疫印迹法检测胞核中AIF蛋白表达的动态变化 (1)亚细胞器的分离:各组新生大鼠在各个时间点断头取脑,称取患侧大脑皮层新鲜脑组织100mg左右,参照胞核提取试剂盒(N1201)说明书步骤进行操作。将提取好的胞核贮存在-80℃冰箱中。采用改良的lowry法测胞核的蛋白浓度,牛血清白蛋白作为标准蛋白;(2)Western blot法测胞核中的AIF 制备10%分离胶和5%浓缩胶,每个上样孔的上样量均为50μg;电泳、半干转将蛋白转到NC膜上,脱脂奶粉封闭1h,将NC膜孵育在AIF(sc-9416,1∶300),4℃过夜。将 NC 膜在兔抗羊二抗(1∶1000)中孵育2h,NBT/BCIP显色,用 Image J软件分析系统分析条带光密度值(OD)。组蛋白H1(Histone-H1)作为内部参照,用每个样本OD值与Histone-H1OD值的比值作为最后结果。
1.2.4 用RT-PCR法检测脑皮层组织AIF mRNA的水平 各组新生大鼠在各个时间点断头取脑,称取100 mg患侧大脑皮层组织置入5ml无核酶的EP管中,放入-80℃冰箱中贮存备用;用Trizol法从组织中提取总的mRNA;一步法行RT-PCR,步骤参照说明书;2%琼脂糖凝胶电泳,用凝胶成像系统拍照并分析数据。AIF上游引物:5’-CGTCCC TTTCCTGCTGATTG-3’;下游引物:5’-TTCCATTCC ACTGTCTGAACTG-3’;目的基因长度:203bp,Tm:54.4℃;β-actin 上游引物:5’-CCATTGAACACG GGCATTG-3’;下游引物:5’-ACGACCAGAGGC ATACAG-3’;目的基因长度:252bp,Tm:55℃。
1.2.5 原位末端标记法(TUNEL)检测脑皮层组织的凋亡细胞 按上述时间点,动物在乙醚麻醉下开胸,经心尖搏动处插管,用生理盐水20 ml冲洗血流,继之灌入4%多聚甲醛(0.1mol/L PB,pH 7.4)约20ml,灌毕即取右脑,沿视交叉前缘做2mm厚的冠状切片,放入4%多聚甲醛中固定,常规脱水、透明、浸蜡、包埋后行6μm连续切片,进行Tunel染色,Tunel试剂盒(MK1022)购自武汉博士德公司,步骤参照说明书。光镜下,胞核中有紫蓝色颗粒者为阳性细胞,即凋亡细胞。每张切片以40×10倍光镜下计数10个视野中的阳性细胞数,将10个视野计数的平均值作为统计参数。
1.3 统计学方法
应用SPSS 13.0统计软件进行数据分析,所有数据以均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,计量资料相关分析采用Pearson相关系数,P<0.05为差异有统计学意义。
2 结果
2.1 不同时间点各组新生大鼠AIF在胞核中的变化
表1图1显示,假手术组各时间点均没有AIF表达;生理盐水对照组在HI后3h即有少量的AIF表达,随着HI时间的延长而增加,24h达到高峰,随后开始下降,7d时仍有较高的表达;参附治疗组在HI后3h、6h、12h与生理盐水对照组比较差异无统计学意义(P>0.05),24h开始下降,到7d时与生理盐水对照组比较差异有统计学意义(P<0.05)。
表1 胞核各组不同时间点AIF与Histone H1比值的比较(±s,n=8)
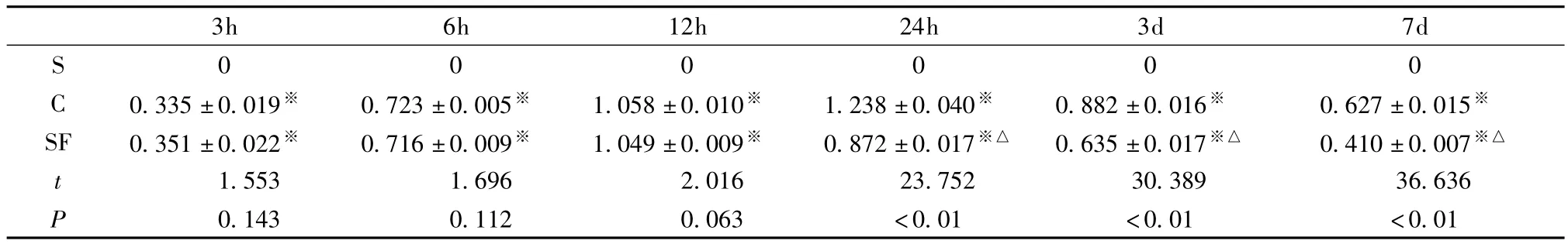
表1 胞核各组不同时间点AIF与Histone H1比值的比较(±s,n=8)
注:与S组比较:※P<0.01,SF组与C组比较:△P<0.01
3h 6h 12h 24h 3d 7d S 000000 0.143 0.112 0.063 <0.01 <0.01 <0.01 C 0.335±0.019※ 0.723±0.005※ 1.058±0.010※ 1.238±0.040※ 0.882±0.016※ 0.627±0.015※SF 0.351±0.022※ 0.716±0.009※ 1.049±0.009※ 0.872±0.017※△ 0.635±0.017※△ 0.410±0.007※△t 1.553 1.696 2.016 23.752 30.389 36.636 P
2.2 各时间点脑皮层组织细胞中AIF mRNA的水平
表2图2显示,假手术组各时间点均有少量表达;生理盐水对照组在HI后3h开始增加,24h达到高峰随后下降,7d时仍高于假手术组(P<0.05);参附治疗组在HI后各时间点AIF mRNA的水平均低于生理盐水对照组,差异有统计学意义(P<0.05)。
表2 各组不同时间点AIF mRNA与β-actin mRNA比值的比较(±s,n=8)
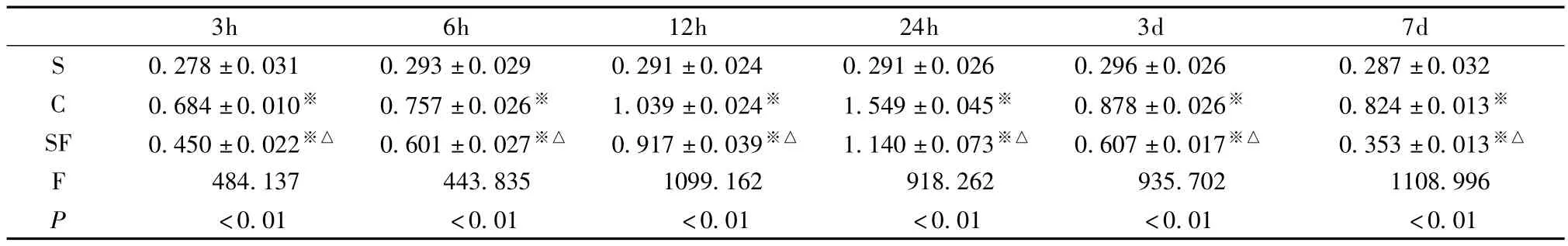
表2 各组不同时间点AIF mRNA与β-actin mRNA比值的比较(±s,n=8)
注:与S组比较:※P<0.01,SF组与C组比较:△P<0.01
<0.01 <0.01 <0.01 <0.01 <0.01 <0.01±0.026 0.296±0.026 0.287±0.032 C 0.684±0.010※ 0.757±0.026※ 1.039±0.024※ 1.549±0.045※ 0.878±0.026※ 0.824±0.013※SF 0.450±0.022※△ 0.601±0.027※△ 0.917±0.039※△ 1.140±0.073※△ 0.607±0.017※△ 0.353±0.013※△F 484.137 443.835 1099.162 918.262 935.702 1108.996 P 3h 6h 12h 24h 3d 7d S 0.278±0.031 0.293±0.029 0.291±0.024 0.291
表3 各组各时间点凋亡阳性细胞数比较(个/HP)(±s,n=8)

表3 各组各时间点凋亡阳性细胞数比较(个/HP)(±s,n=8)
注:与S组比较:※P<0.01,SF组与C组比较:△P<0.01
<0.01 <0.01 <0.01 <0.01 <0.01 <0.01±1.2 C 5.5±1.0※ 14.5±2.6※ 37.7±1.9※ 60.7±2.2※ 25.2±2.1※ 6.7±1.8※SF 5.8±1.2※ 14.3±2.3※ 36.2±1.9※ 45.7±2.1※△ 11.2±1.7※△ 1.8±0.8△F 29.4 77.6 1207.5 1814.4 300.3 32.4 P 3h 6h 12h 24h 3d 7d S 1.5±1.0 1.3±1.0 1.3±0.8 1.2±0.8 1.3±1.0 1.2

图1 各组不同时间点胞核内AIF的免疫印记条带
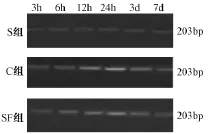
图2 各组不同时间点AIF mRNA电泳图
2.3 各时间点脑皮层组织细胞的凋亡
表3显示,光镜形态学检测各组各时间点均可见典型凋亡神经细胞,表现为染色质结紧、细胞皱缩,核固缩碎片,胞浆深染、胞浆空泡形成,见圆形凋亡小体。凋亡细胞周围无炎症反应,表现为单个细胞缺失。同时有细胞坏死,有较为清楚的坏死灶。S组各时间点脑皮质见个别的凋亡细胞;HIBD后C组和SF组3h凋亡细胞数开始增加,24h达到高峰后开始下降,7d时仍可见凋亡细胞多于S组(P<0.01)。SF组脑细胞凋亡数在24h、3d、7d均低于C组 (P<0.01)。
3 讨论
参附注射液是由中医治疗厥脱证(休克)的著名古方参附汤加工提炼而成,为红参和黑附片的提取物,主要成分为人参皂苷(Rb1)和乌头类生物碱,具有益气温阳之功效。近年来研究发现,参附注射液具有多种药理作用和神经保护作用,其机制为抑制细胞能量代谢障碍,清除氧自由基,减轻钙超载,保护血管内皮细胞,减轻炎症反应,抑制细胞凋亡等[2]。既往研究发现,参附注射液可以明显降低细胞凋亡指数,降低细胞凋亡的基因,包括凋亡诱导基因如Bak、Bax、Fas和凋亡抑制基因如 Bcl-2、Bcl-XL等的表达,有效防止细胞凋亡的末端效应Caspase的激活,从而能明显抑制细胞凋亡[3~7]。但参附注射液是否对AIF具有抑制作用,国内外未见相关报道。
凋亡诱导因子(apoptosis-inducing factor,AIF)是一种57kDa的黄素蛋白,存在于线粒体内外膜间,具有维持线粒体结构和促凋亡作用。一旦细胞遇到凋亡刺激,AIF从线粒体释放转入细胞浆或核内,引起染色质的凝聚和DNA的断裂。Zhu C等[8]研究AIF基因变异鼠缺氧缺血后脑梗死面积与野生鼠比较,雄鼠下降53%,雌鼠下降43%。Culmsee C等[9]发现,AIF缺乏对未成熟大鼠脑缺血后的保护作用超过50%,远远高于对成年大鼠脑缺血的保护作用。
李峰等[10]通过用不同剂量的参附注射液腹腔注入SD大鼠,用以研究其对颅脑损伤的保护作用。结果发现,不同剂量间无剂量效应关系,故本实验选择中等剂量的参附注射液(10ml/kg)。本研究显示,假手术组仅有少量的AIFmRNA表达;生理盐水对照组在HI后3h AIF mRNA表达开始增加,24h达到高峰随后下降,提示在脑缺氧缺血这种凋亡信号刺激下,AIF的转录开始活跃,且AIF mRNA随时间的动态变化与HI后神经细胞凋亡发生规律吻合,提示AIF基因转录参与细胞的凋亡,这与张丽等[11]研究局灶性大鼠脑缺血再灌注损伤AIFmRNA表达变化的结果相似。参附治疗组在HI后每一时间点AIFmRNA表达均明显低于对照组,提示参附注射液能够在转录水平上抑制AIF的表达,从而抑制凋亡起到脑保护作用。
本研究发现,假手术组胞核内没有AIF的表达,提示正常情况下胞核内没有或有极少量的AIF表达;生理盐水对照组在HI后3h AIF核转位开始增加,24h达到高峰随后下降。这与脑皮层凋亡细胞数的变化趋势一致,提示AIF核转位参与了细胞的凋亡。华正宇等[12]用免疫组化方法研究局灶性大鼠脑缺血再灌注损伤AIF的表达,也得出与本研究相似的结果。在HIBD后3h、6h、12h胞核中的AIF表达较对照组差异无统计学意义,24h、3d、7d胞核中的AIF表达较对照组明显减少。我们同时也发现,参附治疗组凋亡细胞数在24h后也明显少于对照组,提示参附注射液可以通过抑制AIF核转位来抑制凋亡。参附注射液对蛋白和基因抑制作用的时间点不同,考虑可能与参附注射液透过血脑屏障需要一定的时间才能发挥药理作用有关。
总之,通过本研究进一步阐明了参附注射液抑制缺氧缺血性脑损伤新生大鼠凋亡的机制,参附注射液不仅可以抑制转录水平的AIF,而且也可以抑制AIF的核转位,从而抑制凋亡的发生,发挥脑损伤的保护作用,为参附注射液在新生儿缺氧缺血性脑病的临床应用提供了更坚实的理论基础。
[1]Rice Je,Vannucci RC,Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[2]罗学科.参附注射液药理作用研究[J].临床和实验医学杂志,2007,6(9):157-159.
[3]王庆九.参附注射液对新生大鼠缺氧缺血性脑损伤的干预作用[J].中国妇幼保健,2009,23(24):3304-3306.
[4]刘正湘,刘晓春,李志刚.人参皂甙Rb1抗大鼠急性缺血-再灌流心肌细胞凋亡及相关基因蛋白表达[J].中华急诊医学杂志,2003,12(3):158-160.
[5]王伟,王军,徐艳,等.缺血缺氧性新生大鼠皮层神经元胞浆Smac/Diablo、caspase-9的表达及参附注射液的干预作用[J].中华神经医学杂志,201l,10(3):228-231.
[6]王军,杨丽娟,周长美,等.参附注射液对新生大鼠缺氧缺血性脑损伤干预作用的实验研究[J].中华医学杂志,2006,86(42):2994-2997.
[7]王军,杨丽娟,何艳芳,等.参附注射液对缺氧缺血性脑损伤新生大鼠海马神经元凋亡影响[J].实用儿科临床杂志,2007,22(21):1658-1677.
[8]Zhu C,Qiu L,Wang X,et al.Involvement of apoptosis-inducing factor in neuronal death after hypoxia-ischemia in the neonatal rat brain[J].J Neurochem,2003,86(2):306-317.
[9]Culmsee C,Zhu C,Landshamer S,et al.Apoptosis inducing factor triggered by poly(ADP-Ribose)polymerase and bid mediates neuronal cell death after oxygen-glucose deprivation and focal cerebral ischemia[J].J Neurosci,2005,25(44):10262-10272.
[10]李锋,钟宏,陈喜,等.参附注射液对颅脑损伤的脑保护作用[J].中医药临床杂志,2006,18(5):455-456.
[11]张丽,苏志强,陈丽霞,等.亚低温通过抑制两种凋亡通路对大鼠脑缺血再灌注损伤发挥保护作用[J].中风与神经疾病杂志,2006,23(3):318-321.
[12]华正宇,赵瑞波,刘宏.亚低温对脑缺血性损伤后凋亡诱导因子表达变化的影响[J].哈尔滨医科大学学报,2007,41(2):147-150.

