独一味对大鼠佐剂性关节炎防治作用的实验研究
王丽娟,王 勇,杨 婕,储燕平,张书靖
(1.天津市食品生物技术重点实验室,天津 300134;2.天津商业大学生物技术与食品科学学院制药系,天津 300134)
独一味 Lamiophloms rotate(Benth.)Kudo为唇形科无茎多年生草本植物,以根及根状茎入药,是藏、蒙、纳西等民族民间常用草药。研究表明,独一味具有止血镇痛、抗菌、改善学习记忆功能以及预防胃溃疡发生等诸多方面的作用,临床主要用于骨外伤、术后及妇科等多种疾病的镇痛、止血、消炎等[1~6]。文献报道,独一味巴布膏对免疫功能有调节作用[7],但其对免疫性关节炎的影响至今未见报道。佐剂诱导的大鼠关节炎(adjuvant-induced arthritis,AIA)是一种免疫性炎症模型,是研究治疗风湿和类风湿关节炎药物的理想病理模型,常用于筛选抗炎免疫药物。本实验观察了独一味对完全弗氏佐剂诱导的大鼠类风湿关节炎的防治作用,为独一味临床用途的进一步开发提供参考。
1 材料
1.1 药物与试剂
独一味购自青海西宁,实验室提取并配制成所需浓度;醋酸泼尼松片,天津力生制药股份有限公司(批号1006044),研细用生理盐水配制成混悬液备用;完全弗氏佐剂10ml,美国Sigma公司。
1.2 动物
Wistar大鼠14~16周龄,体质量160g~210g,雌雄兼用,由天津市实验动物中心提供(合格证号为SCXK(津)2010-0002)。
1.3 主要仪器
PV-200足跖容积仪,成都泰盟科技有限公司;UV-7504单束光紫外-可见分光光度计,上海欣茂仪器有限公司;HZS-H水浴振荡器,哈尔滨市东联电子技术开发有限公司。
2 方法
2.1 独一味水提取物的制备
独一味粉碎并干燥,称量后加水浸泡并煎煮3次,每次1 h,第1次加水量为11倍,第2、3次加水量为8倍,合并煎液室温下冷却、过滤,将滤液浓缩至生药 1g·ml-1,置于冰箱中备用。
2.2 独一味醇提取物的制备
独一味粉碎并干燥,称取适量并加入20倍量60%乙醇,回流提取25min,室温下冷却、过滤,将滤液浓缩至生药1g·ml-1,置于冰箱中备用。
2.3 预防性给药观察独一味对关节炎原发病变的影响
Wistar大鼠50只,体质量160g~210g,雌雄各半,随机分成5组,每组10只。即1组:生理盐水;2组:模型;3组:醋酸泼尼松(0.5g·kg-1);4组:独一味水提取物(生药1.0g·kg-1);5组,独一味醇提取物(1.0g生药·kg-1)。各组均灌胃给药,容量为10ml·kg-1,1 组和2 组灌胃等容量生理盐水,每日 1次,连续22d。于给药第4天制作免疫性炎症模型。每鼠右足跖消毒后,皮下注射完全弗氏佐剂0.1ml进行致炎,1组注射等容量生理盐水。在致炎前、致炎后第18、42、66、8天和第19天分别测各鼠右足容积,通过比较大鼠致炎侧足容积的变化,评价独一味对佐剂性关节炎原发病变的影响[8]。
2.4 预防性给药观察独一味对继发病变影响
Wistar大鼠50只,体质量160g~210g,雌雄各半,随机分成5组,每组10只(分组情况同2.3)。由于迟发型超敏反应所致的继发性病变一般出现于致炎后10d左右,故各鼠右足跖消毒后皮下注射完全弗氏佐剂0.1ml进行致炎,1组注射等容量生理盐水。于致炎后第6天各组灌胃给药,容量为10 ml·kg-1,1组和2组灌胃等容量生理盐水,每日1次,连续14 d。于致炎前、致炎后第11~14天和第19天分别测各鼠左足(致炎对侧)容积。致炎19d后,采用关节炎综合评分法对关节炎的严重程度进行评价[9]。四肢及足关节评分标准:0分=正常,1分=仅皮肤红,2分=皮肤红+轻肿,3分=严重肿,4分=关节变形、强直。每只鼠的关节炎总分数为四足分数之和。通过比较各组大鼠左足容积和关节炎综合评分,评价独一味的抗风湿作用。
2.5 治疗性给药观察独一味对继发病变的作用
Wistar大鼠体质量160g~210g,雌雄各半,随机分成5组,每组8只(分组情况同2.3)。各鼠右足跖消毒后皮下注射完全弗氏佐剂0.1ml进行致炎,1组注射等容量生理盐水。于致炎后第19天(继发病变已经形成)各组灌胃给药,容量为10 ml·kg-1,1组和2组灌胃等容量生理盐水,每日1次,连续7 d。于致炎前、致炎后第11、14、19、22、25 天和第 30 天分别测各鼠左足(致炎对侧)容积。通过比较各组大鼠左足容积,评价独一味对免疫性炎症的治疗作用[8],同时对体质量增长、胸腺指数、脾指数进行比较。
2.6 独一味对大鼠炎症组织前列腺素(PGE2)含量的影响
取健康合格大鼠30只,随机分为5组,每组6只(分组情况同2.3)。各组灌胃给药,1组和2组给予等容量生理盐水,连续给药7d。于末次给药后1h,各鼠分别右后足足跖皮下注射1%角叉菜胶0.1ml,1组注射等容量生理盐水。5h后处死大鼠,剪取右足(致炎侧)称其质量,沿中线纵向剖开,置于5ml生理盐水中4℃浸泡过夜,离心浸泡液,取上清 0.15ml,加入 0.5mol·L-1氢氧化钾-甲醇溶液1ml,置于50℃恒温水浴中异构化20min,加甲醇4ml。在278nm波长下测定光密度,以每克炎性组织中相应的光密度值表示PGE2含量[10]。
2.7 统计学方法
3 结果与分析
3.1 独一味对原发病变的预防作用
表1显示,模型组大鼠致炎后右足肿胀逐渐明显,42h肿胀达高峰,66h减轻,8d再度肿胀,之后肿胀减轻。与生理盐水组比较,模型组大鼠右足(致炎侧,原发病变)容积差异有统计学意义。与模型组比较,独一味和泼尼松组大鼠右足肿胀明显减轻(P<0.05),对原发病变具有显著的消肿和抗炎作用。
表1 独一味对大鼠佐剂性关节炎原发病变的预防作用(±s,n=10)
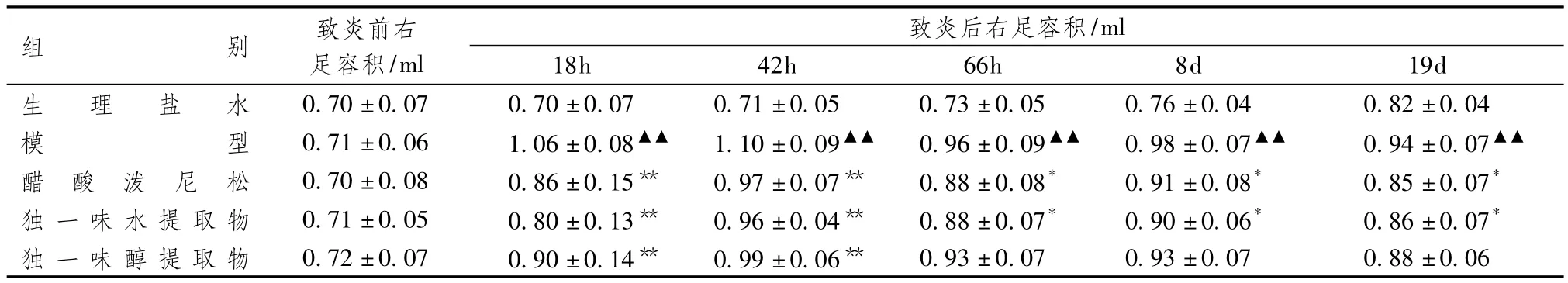
表1 独一味对大鼠佐剂性关节炎原发病变的预防作用(±s,n=10)
注:与生理盐水组比较:▲▲P<0.01;与模型组比较:*P<0.05,**P<0.01
组别 致炎前右足容积/ml致炎后右足容积/ml 18h 42h 66h 8d 19d生 理 盐 水 0.70±0.07 0.70±0.07 0.71±0.05 0.73±0.05 0.76±0.04 0.82±0.04模0.93±0.07 0.93±0.07 0.88±0.06型 0.71±0.06 1.06±0.08▲▲ 1.10±0.09▲▲ 0.96±0.09▲▲ 0.98±0.07▲▲ 0.94±0.07▲▲醋 酸 泼 尼 松 0.70±0.08 0.86±0.15** 0.97±0.07** 0.88±0.08* 0.91±0.08* 0.85±0.07*独 一味水提取物 0.71±0.05 0.80±0.13** 0.96±0.04** 0.88±0.07* 0.90±0.06* 0.86±0.07*独一味醇提取物 0.72±0.07 0.90±0.14** 0.99±0.06**
3.2 独一味对继发病变的预防作用
独一味对大鼠致炎后不同时间左足容积的影响。表2显示,致炎10d后,模型组大鼠致炎对侧足也发生了肿胀,并随时间逐渐加重。致炎后19d肿胀明显,与生理盐水组比较,模型组大鼠的足容积差异有统计学意义。独一味组和泼尼松组大鼠的左足容积较模型组明显减小,表明肿胀减轻,且关节炎综合评分与模型组比较差异有统计学意义,说明独一味对该继发病变有明显的抑制作用。
3.3 独一味对继发病变的治疗作用
表3显示,独一味对大鼠致炎后不同时间致炎对侧足(左足,继发病变)容积的影响;表4显示,独一味对大鼠体质量及胸腺指数、肾上腺指数的影响。
表3显示,在继发病变发生后,左足肿胀逐渐加重。至第19天与生理盐水组比较,各组肿胀明显(足容积差异有统计学意义),随时间推移肿胀持续。而经药物治疗后的大鼠足肿胀明显减轻,与模型组比较独一味组和泼尼松组大鼠的足容积差异有统计学意义(P<0.05),表明独一味和泼尼松对免疫性炎症有一定的治疗作用。表4显示,模型组大鼠的体质量增长较缓慢,但与生理盐水组比较差异无统计学意义,各组的胸腺指数和肾上腺指数比较差异无统计学意义。
表2 独一味对大鼠佐剂性关节炎继发病变的预防作用(±s,n=10)
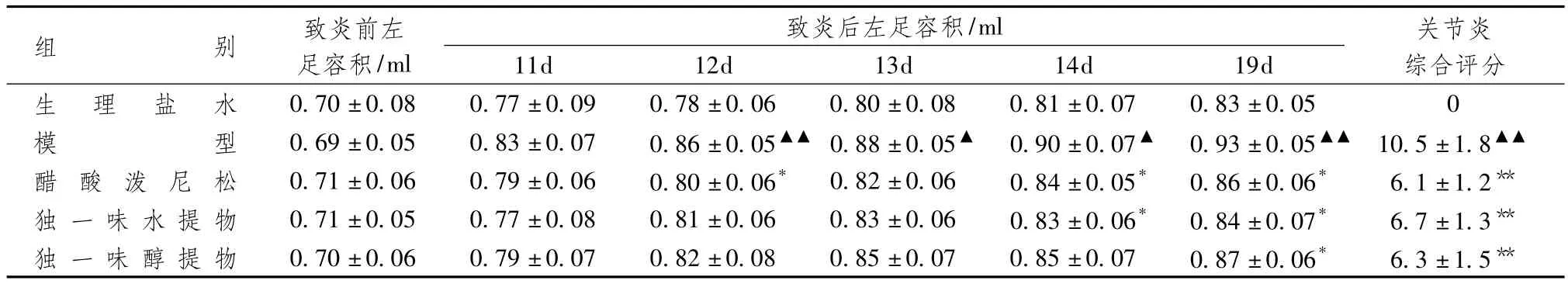
表2 独一味对大鼠佐剂性关节炎继发病变的预防作用(±s,n=10)
注:与生理盐水组比较:▲P <0.05,▲▲P <0.01;与模型组比较:*P <0.05,** P <0.01
组别 致炎前左足容积/ml致炎后左足容积/ml 关节炎综合评分生 理 盐 水 0.70±0.08 0.77±0.09 0.78±0.06 0.80±0.08 0.8 11d 12d 13d 14d 19d 1±0.07 0.83±0.05 0模型 0.69±0.05 0.83±0.07 0.86±0.05▲▲ 0.88±0.05▲ 0.90±0.07▲ 0.93±0.05▲▲ 10.5±1.8▲▲醋 酸 泼 尼 松 0.71±0.06 0.79±0.06 0.80±0.06* 0.82±0.06 0.84±0.05* 0.86±0.06* 6.1±1.2**独 一 味 水 提 物 0.71±0.05 0.77±0.08 0.81±0.06 0.83±0.06 0.83±0.06* 0.84±0.07* 6.7±1.3**独 一 味 醇 提 物 0.70±0.06 0.79±0.07 0.82±0.08 0.85±0.07 0.85±0.07 0.87±0.06* 6.3±1.5**
表3 独一味对大鼠佐剂性关节炎继发病变的治疗作用(±s,n=8)
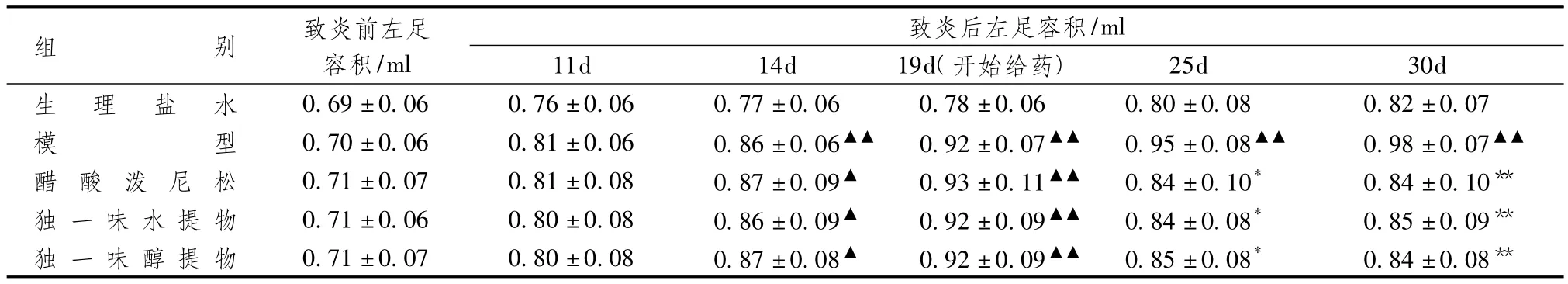
表3 独一味对大鼠佐剂性关节炎继发病变的治疗作用(±s,n=8)
注:与生理盐水组比较:▲P <0.05,▲▲P <0.01;与模型组比较:*P <0.05,** P <0.01
组别 致炎前左足容积/ml致炎后左足容积25d 30d生 理 盐 水 0.69±0.06 0.76±0.06 0.77±0.06 0.78±0.06 0.8/ml 11d 14d 19d(开始给药)0±0.08 0.82±0.07模型 0.70±0.06 0.81±0.06 0.86±0.06▲▲ 0.92±0.07▲▲ 0.95±0.08▲▲ 0.98±0.07▲▲醋 酸 泼 尼 松 0.71±0.07 0.81±0.08 0.87±0.09▲ 0.93±0.11▲▲ 0.84±0.10* 0.84±0.10**独 一 味 水 提 物 0.71±0.06 0.80±0.08 0.86±0.09▲ 0.92±0.09▲▲ 0.84±0.08* 0.85±0.09**独 一 味 醇 提 物 0.71±0.07 0.80±0.08 0.87±0.08▲ 0.92±0.09▲▲ 0.85±0.08* 0.84±0.08**
表4 独一味提取物对佐剂性关节炎大鼠体质量增长及脏器指数的影响(±s,n=8)
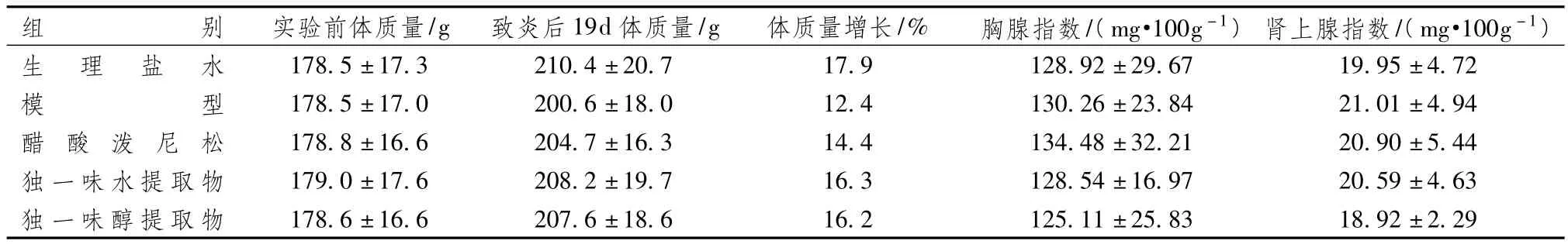
表4 独一味提取物对佐剂性关节炎大鼠体质量增长及脏器指数的影响(±s,n=8)
注:各组比较:均P>0.05
组别 实验前体质量/g 致炎后19d体质量/g 体质量增长/% 胸腺指数/(mg·100g-1)肾上腺指数/(mg·100g-1)生 理 盐 水 178.5±17.3 210.4±20.7 17.9 128.92±29.67 19.92±2.29 95±4.72模型 178.5±17.0 200.6±18.0 12.4 130.26±23.84 21.01±4.94醋 酸 泼 尼 松 178.8±16.6 204.7±16.3 14.4 134.48±32.21 20.90±5.44独一味水提取物 179.0±17.6 208.2±19.7 16.3 128.54±16.97 20.59±4.63独一味醇提取物 178.6±16.6 207.6±18.6 16.2 125.11±25.83 18.
3.4 独一味对炎症组织PGE2含量的影响
表5显示,模型组大鼠炎症组织内的PGE2含量明显增加,而泼尼松和独一味组炎症组织的PGE2含量虽较生理盐水组增加,但明显低于模型组,表明泼尼松和独一味的抗炎作用与抑制炎性组织PGE2的释放有关。
表5 独一味对炎症组织PGE2含量的影响(±s,n=6)

表5 独一味对炎症组织PGE2含量的影响(±s,n=6)
注:与生理盐水组比较:▲0.01<P<0.05,▲▲P<0.01;与模型组比较:** P <0.01
组别PGE2含量/光密度·每克炎症组织-1生 理 盐 水 组0.025±0.007模 型 组 0.054±0.006▲▲醋 酸 泼 尼 松 组 0.038±0.008▲**独 一 味 水 提 取 物 组 0.038±0.006▲**独 一 味 醇 提 取 物 组 0.033±0.008**
4 讨论
大鼠佐剂性关节炎是一种免疫性炎症模型,其发病机制和病理表现与人类风湿关节炎相似,是评价防治类风湿关节炎的常用药物模型之一[11~13]。佐剂性关节炎分原发性反应期和继发性反应期,原发性病变表现为致炎局部的炎症反应,继发性病变一般出现于致炎后10d左右,主要表现为多发性关节炎[8]。
该实验中,模型组大鼠足部(右足)皮下注射完全弗氏佐剂后,致炎侧足逐渐肿胀(原发病变),18h肿胀达高峰,3d减轻,8d再度肿胀,表现为急性炎症反应;注射对侧足(左足)的病变(继发病变)发生于10d后,表现为足部发红、肿胀并逐渐加重,个别鼠足部变形,皮肤表面出现溃疡;在致病后,大鼠精神萎靡、毛发失去光泽、多发关节肿胀并伴有活动障碍,体质量增长缓慢,与文献报道相似[8,14]。
泼尼松为肾上腺皮质激素类药物,具有抗炎和免疫抑制作用,临床可用于治疗风湿和类风湿关节炎。实验中观察到,泼尼松使大鼠佐剂性关节炎原发病变和继发病变均有较明显的减轻,临床表现症状缓解,与其非特异性抗炎及免疫抑制作用有关。独一味能抑制大鼠原发病变的足肿胀,减轻炎症反应,与以往的实验结果一致[2]。独一味预防给药对继发病变的形成也有较明显的抑制作用,致炎19d后测得的足容积及炎症综合评分均与模型组差异有统计学意义,与泼尼松的效果相近;独一味治疗性给药(致炎后第19天给药),于致炎后第25天和第30天测得的足容积与模型组比较差异有统计学意义,说明独一味对继发病变有明显治疗效果。独一味对急性炎症和佐剂引起的迟发型超敏反应均有较好的抑制作用,这与独一味胶囊剂、片剂的临床治疗效果相吻合[15~17],实验结果为独一味临床用于治疗风湿和类风湿关节炎提供了理论支撑。
有证据表明,PGE2参与关节炎病变的发生发展。用抗PGE2单克隆抗体中和PGE2能减轻佐剂性关节炎大鼠的足肿胀和痛觉过敏,也能减少IL-6等炎性因子的分泌[18]。非甾体抗炎药布洛芬能显著抑制大鼠佐剂性关节炎炎性组织PGE2的分泌,使关节肿胀减轻,关节疼痛减轻[13]。本实验用角叉菜胶致大鼠足急性炎症,炎性组织中PGE2的含量明显增加。独一味2种提取物均能使大鼠致炎的局部组织中PGE2的含量较模型组显著减少,与模型组间比较差异有统计学意义,表明独一味能抑制炎性组织PGE2的合成(或释放),其对类风湿关节炎的作用机制可能与非甾体抗炎药的作用机制有相似之处,即抑制炎性组织PGE2的合成或释放。独一味的主要化学成分有黄酮、环烯醚萜类和苷类,其抗炎作用可能与其所含黄酮成分有关[19]。而独一味对佐剂性关节炎的作用与哪类化学成分有关,以及其对佐剂性关节炎的确切作用机制还有待进一步的研究。
[1]国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2005:185.
[2]王丽娟,王庆妍,可妍,等.独一味水提取物与醇提取物镇痛抗炎作用的比较研究[J].时珍国医国药.2011,22(8):2037-2038.
[3]王丽娟,王亚丽,李蓓,等.独一味对小鼠学习记忆能力的影响[J].时珍国医国药,2009,20(7):1761-1762.
[4]王丽娟,彭勍,王勇,等.独一味对实验性小鼠胃溃疡的影响[J].时珍国医国药,2009,20(5):1189-1190.
[5]裴计荣.独一味胶囊治疗细菌性阴道病疗效观察[J].临床合理用药,2010,3(9):76-77.
[6]王芳,周绵莉,朱崇云.独一味胶囊治疗月经过多临床研究[J].中国中医药信息杂志,2008,15(1):59-60.
[7]杨漾,何梦婕,萧海容,等.独一味巴布膏镇痛、免疫作用的实验研究[J].中药药理与临床,2011,27(4):60-62.
[8]徐叔云,卞如濂,陈修.药理学实验方法学[M].3版.北京:人民卫生出版社,2003:920.
[9]戴敏,魏伟,汪倪萍,等.木瓜苷对大鼠佐剂性关节炎的治疗作用[J].中国药理学通报,2003,19(3):340-344.
[10]陈奇.中药药理学研究方法学[M].2版.北京:人民卫生出版社,2006:362.
[11]李振彬,杜志峰,杨志霞,等.通心络胶囊对佐剂性关节炎的影响及其作用机制探讨[J].中国中医基础医学杂志,2007,13(6):428-429.
[12]Jacobson PB,Borgan SJ,Wilcox,et al.A new spin on an old model:In vivo evaluation of disease progression by magnetic resonance imaging with respect to standard inflammatory and parameters and histopathology in the adjuvant arthritis rat[J].Arthritis Rheum,1999,42(10):2060.
[13]卢毓雄,于晔,王珏,等.益肾蠲痹丸与布洛芬合用治疗佐剂性关节炎模型大鼠的实验研究[J].中国中医基础医学杂志,2006,12(7):513-514.
[14]胡福良,朱威,陈民利,等.工蜂蛹及其提取物对慢性炎症和免疫性炎症的作用及机理[J].浙江大学学报(农业与生命科学版),2005,31(5):587-592.
[15]谢海连.独一味胶囊治疗风湿性关节炎28例[J].中国中医药信息杂志,2000,7(10):36-37.
[16]王钢.独一味片治疗风湿性关节炎72例[J].中国中医药信息杂志,2001,8(9):72.
[17]叶飞,杨洪彬,徐永旭.独一味胶囊治疗类风湿性关节炎69例的临床研究[J].世界中医药,2007,2(6):339-340.
[18]JP Portanova,Y Zhang,GD Anderson,etal. Selective neutralization of prostaglandin E2blocks inflammation hyperalgesia and interleukin 6 production in vivo[J].J Exp Med,1996,184:883-891.
[19]张毅,王旭光.木犀草素的体外抗炎机制研究[J].广州中医药大学学报,2007,24(3):231-233.

