应用组织芯片研究hCTR1在子宫颈鳞癌、宫颈上皮内瘤样病变中的表达及意义
刘洪博 张清泉 杜红丽 侯素平 李 聪
子宫颈癌是女性生殖系统最常见的恶性肿瘤,其发病率仅次于乳腺癌。研究认为,在一些发展中国家和地区子宫颈癌5年生存率为20%~40%[1]。在对中晚期子宫颈癌患者化疗中,铂类药物不论是在单药还是联合治疗方面,应用均相当广泛且均具有绝对优势[2]。癌细胞产生抗药性和肾脏毒性是导致子宫颈癌患者治疗失败的主要原因之一,而人类铜转运蛋白 1(human copper transporter 1,hCTR1)可调节肿瘤细胞中顺铂(cisplatin,cDDP)的含量。本研究旨在应用组织芯片技术探讨hCTR1在子宫颈鳞癌中的表达情况及辅助治疗作用。
1 资料与方法
1.1 一般资料 收集2009年6月—2011年5月于河北省人民医院和哈励逊国际和平医院妇科门诊活检、锥切或住院手术患者的子宫颈组织标本共189例,患者年龄27~59岁,中位年龄46.7岁。子宫颈鳞状细胞癌组52例,其中子宫颈鳞癌原发组40例,除3例术前进行放疗外,其余术前均未进行放化疗;复发组12例,第2次手术前均进行了3~8个疗程的放化疗。宫颈上皮内瘤样病变(CIN)106例,其中CINⅠ组34例,CINⅡ~Ⅲ组72例。正常宫颈组31例,取自同期子宫良性病变行子宫切除术的宫颈。各组标本均由2位有经验的病理医师对所有切片进行复查。同时收集患者临床病理资料包括肿瘤大小、组织学分级按照《外科病理学》第2版的标准、临床分期参照2008年FIGURE O/IGCS妇科恶性肿瘤分期及临床实践指南、淋巴结转移情况等。
1.2 方法
1.2.1 组织芯片的制作 根据实验需要,共设计为8×8点阵组织芯片3张。自制组织取样器和受体蜡模 ,制备取样与组织蜡芯后进行切片及裱片,完成组织芯片制作,见图1。
1.2.2 免疫组织化学染色(IHC) hCTR1兔抗多克隆抗体购自英国NOVUS生物技术公司;即用型SP通用试剂盒 (SP-9001)和DAB显色剂均购自北京中杉生物技术公司。应用SP法进行免疫组织化学染色,其中3张切片作hCTR1免疫组化染色,均设立阳性对照和阴性对照,用预实验中已知的阳性组织切片作为阳性对照;用0.1 mol/L PBS代替一抗,作为阴性对照。
1.3 结果判定 (1)组织芯片染色结果判定。组织芯片中研究样本充足的位点为有效患者;因供体组织太少或缺失,判断为无效或无意义患者,该患者在研究样本中剔除。(2)免疫组织化学结果判定。参照文献[3],hCTR1定位于细胞质或(和)细胞膜,对组织芯片上每个位点的免疫组化染色进行评价,随机观察5个高倍视野(×200)下综合染色强度和阳性细胞所占比例进行半定量测定。
1.4 统计学方法 采用SPSS17.0统计软件进行处理。计数资料以例(%)表示,组间比较采用χ2检验或确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 组织芯片及HE染色质量评价 制备完成的组织芯片蜡块完整,切片组织点阵排列整齐,定位明确;组织芯片各有意义位点的病变组织结构完整,见图2。正常宫颈组31例中镜下有意义组织23例;CINⅠ组34例中有意义者27例;CINⅡ~Ⅲ 组72例,有意义者67例;子宫颈鳞癌组52例,均为有意义组织。
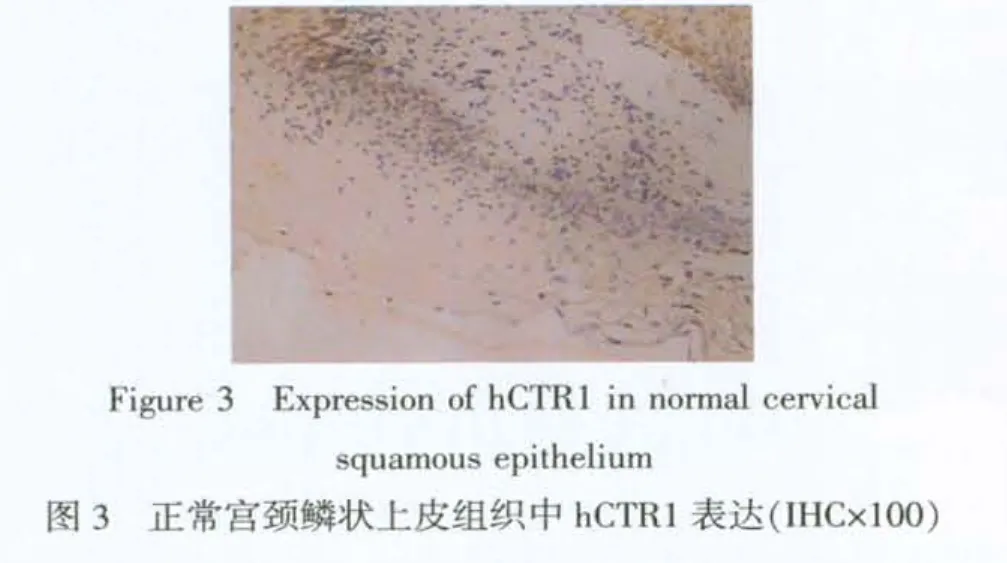
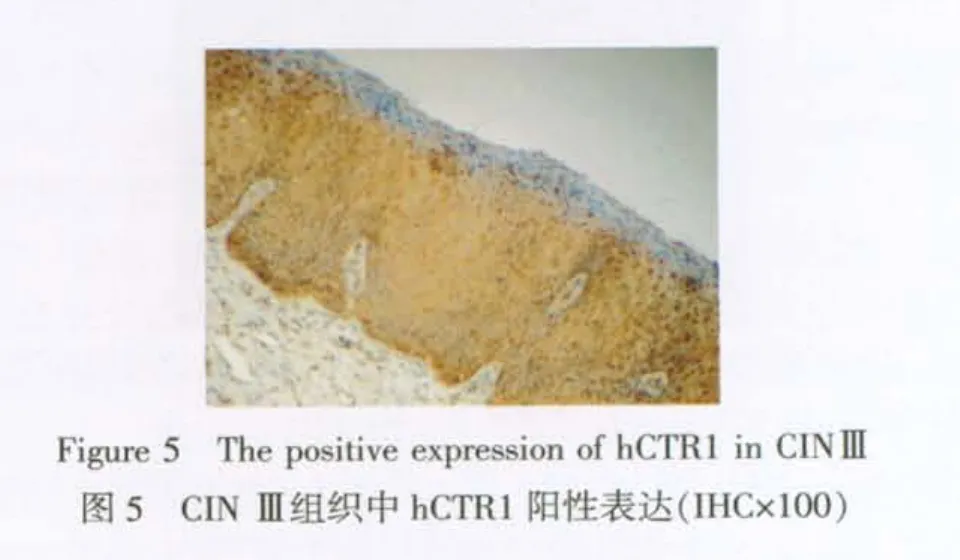
2.2 免疫组织化学染色结果 31例正常宫颈鳞状上皮hCTR1表达较低,仅在基底层一些细胞中表达,见图3。CIN组及子宫颈癌组患者hCTR1阳性表达显著增加,见图4~6。CINⅡ~Ⅲ组较正常宫颈组及CINⅠ组中hCTR1的阳性表达增加 (P<0.01),宫颈鳞癌组较正常宫颈组及CINⅠ组中hCTR1表达增加(P<0.01),但CINⅠ组与正常宫颈组,CINⅡ~Ⅲ组与宫颈鳞癌组比较,差异无统计学意义(P>0.05),见表1。

Table 1 The protein expression of hCTR1 in various lesions of cervical squamous epithelium表1 不同级别宫颈组织中hCTR1蛋白的表达 例(%)
2.3 hCTR1蛋白表达与子宫颈鳞癌患者临床病理特征的关系 hCTR1蛋白的表达在不同年龄、临床分期、肿瘤大小、病理分级及有无淋巴结转移子宫颈鳞癌患者间差异均无统计学意义(P>0.05),见表2。
2.4 hCTR1原发子宫颈鳞癌和复发子宫颈鳞癌中的表达情况 hCTR1在子宫颈原位癌的阳性率高于子宫颈早期浸润癌;hCTR1蛋白在原发子宫颈鳞癌和复发子宫颈鳞癌中表达差异无统计学意义(P>0.05),见表3。术后1年随访,原发组宫颈癌患者共39例,1例转院,其中临床分期Ⅰb期患者2例,术后仅进行了放疗,其余37例患者术后进行放、化疗,通过对hCTR1蛋白的检测,化疗采取博来霉素+顺铂方案(PF),患者情况良好,无局部复发。另12例复发癌患者,通过对hCTR1的检测,妇科临床调整了cDDP使用剂量,情况良好,目前无二次复发。

Table 3 The protein expression of hCTR1 in primary cervical squamous carcinoma,recurrent cervical squamous carcinoma and early invasive carcinoma表3 hCTR1蛋白在原发子宫颈鳞癌、复发子宫颈鳞癌和早期浸润癌中表达 例(%)
3 讨论
3.1 hCTR1负责转运抗肿瘤的铂类化合物 目前比较认同子宫颈癌化疗最有效的药物是铂类药物,cDDP是比较常用的化疗药物,以cDDP为基础的联合化疗的有效率可达80%以上[4]。hCTR1蛋白被认为是人体内具有高亲和力的铜摄入蛋白,可调节肿瘤细胞中cDDP的含量。该基因位于染色体9q31/32上,编码蛋白存在于真核生物细胞膜和细胞质中高尔基体上[5]。Holzer等[6]研究显示,细胞膜上主要负责铜进入的载体——CTR1,也是负责cDDP进入酵母体和哺乳动物细胞的不可缺少的部分。近来研究发现,很多类型的肿瘤患者血清中含有异常高水平的铜;且铜与化疗药物cDDP关系密切,并且认为铜可能影响化疗效果[7-8]。铜转运蛋白家族不仅参与铜离子的代谢,也参与铂类抗肿瘤药物入胞和出胞的调节[5],铜和cDDP是相反的的两极,但它们的吸收受相似的细胞外因子影响,如K+离子的浓度和pH值等。Holzer等[6]将人类卵巢恶性肿瘤细胞暴露于2μmol/L的 cDDP中15 min,结果显示肿瘤细胞上的hCTR1完全消失,认为cDDP引起hCTR1丢失,可能与细胞膜和细胞间桥的重新分布有关,但当移去cDDP 30 min后,肿瘤细胞的hCTR1蛋白水平又恢复正常,表明hCTR1的合成是快速的。Petris等[9]研究认为,利用化学抑制剂β-甲基环糊精可阻止cDDP诱导的哺乳动物的hCTR1丢失。于海林等[10]通过构建重组反转录病毒载体pBABEpuro-hCTRI,转染包装细胞后感染人卵巢癌细胞株SKOV-3,结果显示hCTR1参与卵巢癌细胞对cDDP的转运,其高表达可增强SKOV-3细胞对cDDP摄入能力和敏感性。
3.2 hCTR1蛋白的表达与子宫颈鳞癌患者临床病理关系 Holzer等[11]报道hCTR1在多种组织中表达,尤其在胰腺的α细胞、胃黏膜及细支气管黏膜的内分泌细胞、甲状腺的C细胞等。但hCTR1在正常子宫颈组织、CIN及子宫颈鳞癌组织中的表达情况尚少见报道。本研究结果显示,hCTR1在子宫颈原位癌中的阳性要高于子宫颈早期浸润癌,提示hCTR1与恶性肿瘤生物学特征侵袭性可能存在负相关性,其确切的生物学功能尚需要进一步研究证实。研究认为,细胞中hCTR1的合成与谷胱甘肽(L-Glutathione,GSH)和 β-甲基环糊精含量有关,增加GSH含量可提高的肿瘤细胞对cDDP的敏感性[7-8]。因此,肿瘤患者在化疗期间可以给予GSH或β-甲基环糊精进行人为干预,减少肿瘤细胞中hCTR1蛋白的流失,促进其合成,提高肿瘤细胞对抗肿瘤药物的敏感性,从而降低肿瘤患者的病死率。本研究术后一年的随访及相应治疗方案证实了hCTR1蛋白在放化疗中的辅助应用。综上所述,通过检测hCTR1蛋白表达,从而对这些转运体活性进行调节,可提高肿瘤细胞对抗肿瘤药物的敏感性,辅助建立铂类抗癌药物耐药的警示系统。



[1]张友忠,姜洁,张贵宇,等.第12届国际妇科癌症学会会议纪要[J].现代妇产科进展,2009,18(1):1-6.
[2]孟丽燕,石娟,周红林.子宫颈癌治疗新进展[J].医学综述,2009,15(20):3089-3091.
[3]王晖,罗春芳,芦玉兰,等.应用组织芯片技术研究MMP-9和PCNA在宫颈癌组织中的表达及其意义[J].中国组织化学与细胞化学杂志,2010,19(5):457-462.
[4]梁跃,叶青山.子宫颈癌的化疗现状 [J].中国医药导报,2009,6(23):7-9.
[5]Maryon EB,Zhang J,Jellison JW,etal.Human copper transporter 1 lacking O-linked glycosylation is proteolytically cleaved in a Rab9-positive endosomal compartment[J].J Biol Chem,2009,284(41):28104-28114.
[6]Holzer AK,Howell SB.The internalization and degradation of human copper transporter 1 following cisplatin exposure[J].Cancer Res,2006,66(22):10944-10952.
[7]Kuo MT,Chen HH,Song IS,etal.The roles of copper transporters in cisplatin resistance[J].Cancer Metastasis Rev,2007,26(1):71-83.
[8]Wu Z,Liu Q,Liang X,etal.Reactivity of platinum-based antitumor drugs towards a Met-and His-rich 20mer peptide corresponding to the N-terminal domain of human copper transporter 1[J].J Biol Inorg Chem,2009,14(8):1313-1323.
[9]Petris MJ,Smith K,Lee J,etal.Copperstimulated endocytosis and degradation of the human copper transporter,hCTR1[J].J Biol Chem,2003,278(11):9639-9646.
[10]于海林,姜燕,赵亮,等.卵巢癌细胞中hCTR1的表达与细胞对顺铂耐药的相关研究[J].肿瘤,2009,10(29):934-939.
[11]Holzer AK,Varki NM,Le QT,etal.Expression of the human copper influx transporter 1 in Normal and malignant human tissues[J].JHistochem Cytochem,2006,54(9):1041-1049.

