IGF-1和COX-2在子宫内膜癌中的表达及其临床意义*
陈红漫 赵振苓 袁 莉 郭景霞 齐美霞
据统计2011年美国有46 470例新发子宫内膜癌(EC),其中 8 120例最终死亡[1]。杨丹等[2]研究认为,我国目前EC发病率及致死率呈逐年增长趋势。但目前有关EC发病机制的研究尚不明确,临床较为认同的观点是“无抵抗雌激素”学说。有研究表明,胰岛素样生长因子(IGF)-1通过刺激雌激素的表达促使无孕激素拮抗的雌激素增多,从而诱导子宫内膜向恶性转变[3]。环氧合酶(COX)-2则通过促进细胞增殖,抑制细胞凋亡,促使子宫内膜癌变[4]。但目前有关IGF-1、COX-2与EC表达的相关性及其与临床病理特征的关系尚未明了。本研究旨在探讨IGF-1及COX-2在EC发生、发展中的作用,以期为临床诊疗提供参考。
1 材料与方法
1.1 一般资料 选取1996年1月—2010年12月于天津市第五中心医院妇科就诊的150例子宫内膜样腺癌患者(EA组),全部患者临床资料完整,活检前均未接受放疗、化疗及生物治疗,年龄 31~80岁,平均(59.2±11.0)岁。根据 2009年国际妇产科联盟FIGO标准,病理Ⅰ期98例,Ⅱ期20例,Ⅲ期和Ⅳ期32例。组织学分级Ⅰ级(高分化,G1)82例,Ⅱ级(中分化,G2)38 例,Ⅲ级(低分化,G3)30 例。同期选取子宫内膜非典型增生患者 (AHE)组54例,年龄32~75岁,平均(56.2±10.6)岁。选取因良性疾患行子宫全切的正常子宫内膜(NE 组)患者 84 例,年龄 28~68 岁,平均(53.2±10.9)岁。获取3组的子宫内膜样本,所有标本均经2位病理医师分别诊断复查核实。
1.2 主要仪器与试剂 浓缩型兔抗人IGF-1多克隆抗体(产品编号:ab9572)、浓缩型兔抗人COX-2多克隆抗体(产品编号:ab15191)购自美国abcam公司,工作浓度分别为1∶200和1∶100。通用型SP染色试剂盒及DAB显色试剂盒均购自北京中杉试剂公司。组织芯片打孔仪(美国Beecher公司)。
1.3 方法 (1)组织芯片制备。取样前对蜡块的HE切片做镜下形态学观察,圈出各组患者标本包含有EC及正常内膜组织形态学特点的位置,并在蜡块确定取样部位,使用组织芯片打孔仪在每个蜡块穿取组织芯片。(2)免疫组化方法。将各组组织芯片蜡块以3μm连续切片,选出组织样本完整的切片先做常规HE染色,再应用SP法对其进行IGF-1和COX-2抗体染色,抗体孵育前均经热修复,操作步骤严格按照试剂盒说明书进行。以芯片内不同类型组织作内对照,以PBS代替一抗为阴性对照。IGF-1以乳腺癌组织为阳性对照、COX-2以结肠癌组织为阳性对照。
1.4 结果判断 采用SP免疫组化法检测,3组内均设阴性及阳性对照。阳性信号为细胞出现棕黄色细小颗粒。COX-2阳性物质定位于细胞浆(膜),IGF-1阳性物质定位于细胞浆。高倍镜下(×400)随机取5个不同的视野,各计数200个细胞,以每高倍镜下阳性细胞数量及染色强度分别对IGF-1和COX-2的细胞浆和(或)细胞膜进行阳性判断,标准如下:根据阳性细胞染色深浅及阳性细胞比例打分,细胞无色为0分,淡黄色1分,深黄色2分,棕褐色3分;阳性细胞比例<25%为0分,25%~50%为1分,51~75%为2分,>75%为3分。根据二者乘积综合评分,累计积分0分为阴性,1分以上为阳性。结果判断均由2名病理医师双盲法判定并统一核准。
1.5 统计学方法 采用SPSS17.0统计软件包进行分析。符合正态分布的计量资料以±s表示。计数资料比较用卡方(χ2)检验,IGF-1和COX-2的相关性用Spearman等级相关进行分析。P<0.05为差异有统计学意义。
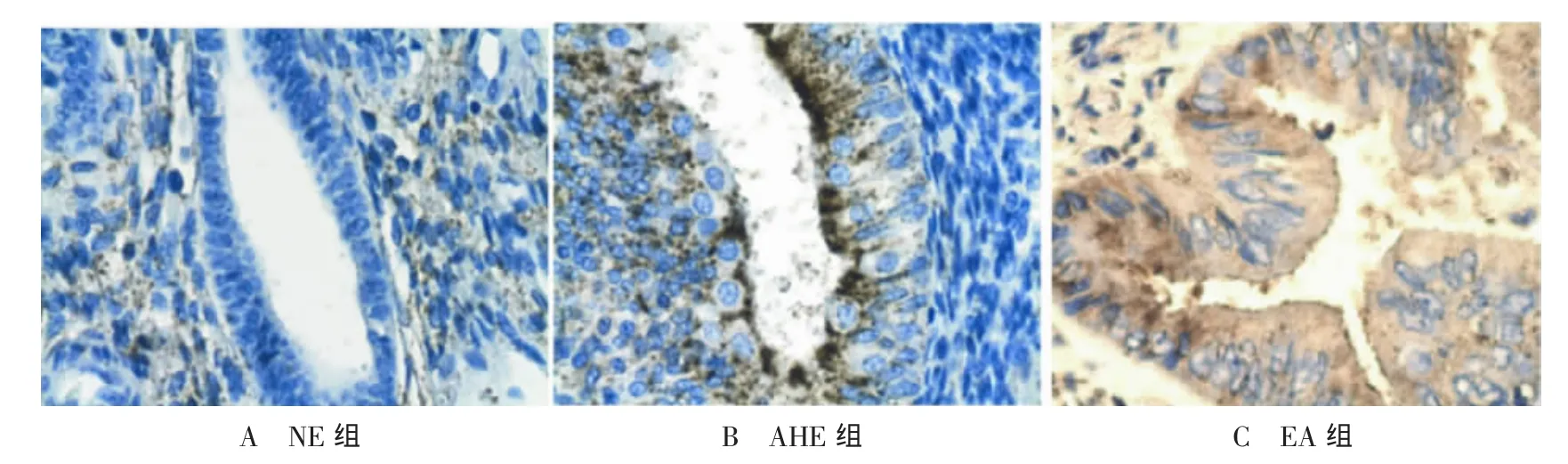
Figure 1 The expression of IGF-1 in different endometrium groups(SP×400)图1 IGF-1在各组中的表达情况(SP×400)

Figure 2 The expression of COX-2 in different endometrium groups(SP×400)图2 COX-2在各组中的表达情况(SP×400)
2 结果
2.1 各组 IGF-1及COX-2病理表达结果 NE组、AHE组及EA组的IGF-1和COX-2均分别呈阴性、弱阳性及强阳性表达,见图1、2。
2.2 各组IGF-1和COX-2基因的表达 NE、AHE及EA组IGF-1和COX-2阳性表达构成差异均有统计学意义(P<0.01)。其中,NE组与AHE组IGF-1和COX-2阳性表达构成差异无统计学意义(P>0.05),EA组 IGF-1阳性表达构成高于 NE组和AHE组 (P<0.05或 P<0.01),EA 组 COX-2阳性表达构成高于NE组(P<0.01),见表1。
2.2 IGF-1及COX-2基因表达与临床病理特征的关系 EA组IGF-1阳性表达率在不同子宫肌层浸润间差异有统计学意义(P<0.01);而在不同病理分级、手术分期及有无淋巴结转移间差异无统计学意义(P>0.05)。COX-2阳性表达率在不同病理分级间差异有统计学意义(P<0.01);而在不同子宫肌层浸润深度、手术分期及有无淋巴结转移间差异无统计学意义(P>0.05),见表2。

Table 1 Comparison of IGF-1 and COX-2 expressions between different endometrial tissues表1 各组IGF-1及COX-2蛋白表达的比较例(%)
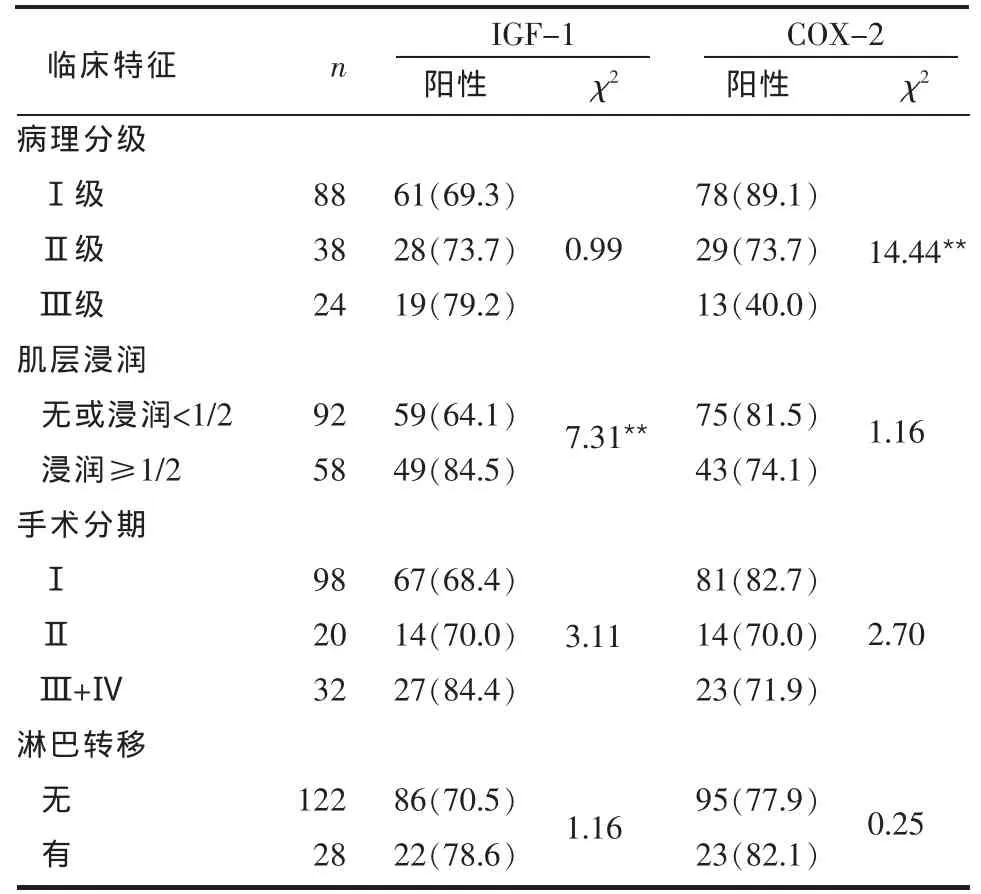
Table 2 Correlation between the expression of IGF-1 or COX-2 and clinicopathological characteristics in EA group表2 EA组IGF-1及COX-2表达与临床病理特征的关系 例(%)
2.3 IGF-1和COX-2在EA组织中表达的相关分析 IGF-1和COX-2的表达呈正相关 (P<0.05),见表3。
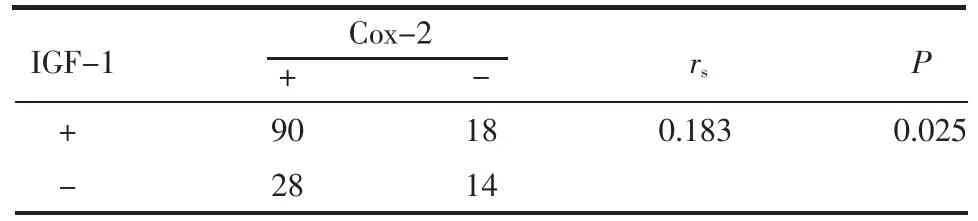
Table 3 Correlation between IGF-1 and COX-2 expressions in EA tissues表3 IGF-1和COX-2在EA中表达的相关性
3 讨论
IGF-1的结构与胰岛素相似,具有促进细胞分裂和抗细胞凋亡的作用,它通过自分泌与旁分泌机制促进组织细胞增殖、抑制其凋亡,并调节肿瘤的发生发展。IGF-1是一种细胞增殖调控因子,能够加速氨基酸及葡萄糖向细胞内运输,从而增加蛋白质的合成,减少蛋白质的降解,向细胞内传递信息产生生物学效应。IGF-1对恶性细胞具有较强的有丝分裂原性和抗凋亡活性,其在刺激细胞增殖的同时,还可切断细胞凋亡的途径。另外,IGF-1与其受体结合启动磷脂酰肌醇3激酶 (PI3K)/Akt信号途径和丝裂原激活蛋白激酶(MAPK)信号途径,可分别抑制肿瘤细胞的凋亡并促进细胞增殖[5]。COX-2是前列腺素(PGs)合成过程中的一个重要限速酶,可催化花生四烯酸产生各种PGs产物,此外其还有诱导蛋白表达功能。COX-2在正常组织的表达量很低,却能很快被炎症因子激活诱导,并经常在人类肿瘤组织中高表达,还可能在丝裂原诱导下导致恶性肿瘤发生发展。近年来,研究已证实COX-2可通过直接或间接的方式促进雌激素的表达,导致恶性肿瘤的发生[6]。但目前有关IGF-1和COX-2促进EC表达的分子机制还不十分清楚。
子宫内膜样腺癌(EA)属于雌激素依赖型(Ⅰ型)的高分化EC,占全部EC的85%以上,由子宫内膜不典型增生症发展而来。多项研究表明,IGF-1和COX-2在多种肿瘤中呈高表达,共同促进肿瘤的发生发展[7-11]。Henriksen等[7]研究显示,IGF-1和COX-2在乳腺癌中高表达且均与肿瘤临床分期和腋窝淋巴结转移呈正相关。本研究结果显示,IGF-1及COX-2在NE组较少表达,而在AHE尤其是EA中有较高水平表达,与上述报道相近。Bustin等[8]研究显示IGF-1和 COX-2在结肠癌中高表达,且IGF-1的高表达同COX-2的mRNA水平相关。目前,COX-2抑制剂对结肠癌的预防和治疗已在临床应用取得较好效果。本研究显示在EA组织中子宫肌层浸润深度≥1/2者的IGF-1阳性表达比例高于无肌层浸润或浸润<1/2者,差异有统计学意义。COX-2在不同病理分级中的表达有差异,分化越差的内膜癌组织中COX-2表达阳性率越低,提示COX-2可能作为判断EA分化的标志,但COX-2在分化差的EA组织中表达下调的具体机制有待进一步研究。本研究显示,虽然AHE组的IGF-1及COX-2阳性表达率与NE组无差异,但AHE的数值均高于NE组,表明AHE可能更易发生癌变。因此,对于IGF-1及COX-2呈阳性表达的AHE者,更应加强随访,制定合理的治疗方案。目前,有关IGF-1和 COX-2在EA表达的相关性研究尚少见报道。本研究显示IGF-1和COX-2在EA中的表达成正相关,这与二者在前列腺癌[9]、乳腺癌[10]和卵巢癌[11]中的相关性报道一致,表明二者在性腺相关腺癌的发生发展中可能发挥了一定的作用,可能是一种激素依赖性的肿瘤分子标志物,提示其在EA发生发展中可能存在着较密切的协同作用。Cao等[11]报道IGF-1诱导COX-2的过表达在卵巢癌的发展及预后中起重要作用,是通过PI3K、MAPK和PKC 3种信号转录途径分别调节COX-2在转录和转录后的表达来完成的;该研究认为,COX-2在卵巢癌中过表达同浸润表型和不良临床预后相关。目前研究认为,COX-2的致癌机制可能与促进细胞增殖,抑制细胞凋亡,使细胞增殖和凋亡之间的平衡失调,以及抑制机体的抗肿瘤免疫等[12]。Mitsutoshi等[13]报道雌激素可通过雌激素受体上调人类子宫微血管内皮细胞系的COX-2表达,其表达调控发生在转录和转录后水平。
综上所述,联合检测IGF-1及COX-2表达有助于早期诊断子宫内膜癌及其癌前病变,有助于综合评估EA的生物学行为,并可作为预测EA分化浸润的生物学指标。但关于IGF-1在不同信号转导通路中作为COX-2的上游基因促进子宫内膜癌发生发展的机制,以及激活调控COX-2基因在EC的高表达还有待进一步深入研究。
[1]Siegel R,Ward E,Brawley O,etal.Cancer statistics 2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer JClin,2011,61(4):212-236.
[2]杨丹,韩立敏.1969-2003年子宫内膜癌发病率及发病因素分析[J].复旦学报(医学版),2005,32(4):479-483.
[3]McGrath M,Lee IM,Buring J,etal.Common genetic variation within IGFⅠ,IGFⅡ,IGFBP-1,and IGFBP-3 and endometrial cancer risk[J].Gynecol Oncol,2011,120(2):174-178.
[4]Munir I,Fukunaga K,Kanasaki H,etal.Expression of cyclooxygenase 2 by prostaglandin E2 in human endometrial adenocarcinoma cell line HEC-1B[J].Biol Reprod,2000,63(3):933-941.
[5]Lin Y,Yang Q,Wang X,etal.The essential role of the death domain kinase receptor-interacting protein in insulin growth factor-1-induced c-Jun N-terminal kinase activation[J].J Biol Chem,2006,281(33):23525-23532.
[6]Fitzpatrick FA.Cyclooxygenase enzymes:regulation and function[J].Curr Pharm Des,2004,10(6):577-588.
[7]Henriksen KL,Rasmussen BB,Lykkesfeldt AE,etal.Semiquantitative scoring of potentially predictive markers for endocrine treatment of breast cancer:a comparison between whole sections and tissue microarrays[J].JClin Pathol,2007,60(4):397-404.
[8]Bustin SA,Dorudi S,Phillips SM,etal.Local expression of insulin-like growth factor-1 affects angiogenesis in colorectal cancer[J].Tumour Biol,2002,23(3):130-138.
[9]Chan JM,Weinberg V,Magbanua MJ,etal.Nutritional supplement,COX-2 and IGF-1 expression in men on active surveillance for prostate cancer[J].Cancer Cause Control,2011,22(1):141-150.
[10]Miglietta A,Toselli M,Ravarino N,etal.COX-2 expression in human breast carcinomas:correlation with clinicopathological features and prognostic molecular[J].Expert Opin Ther Targets,2010,14(7):655-664.
[11]Cao Z,Liu LZ,Dixon DA,etal.Insulin growth factor-1 induces cyclooxygenase-2 expression via PI3K,MAPK and PKC signaling pathway in human ovaian cancer cells[J].Cell Signal,2007,19(7):1542-1553.
[12]Wang F,Sun GP,Zou YF,etal.Expression of COX-2 and Bcl-2 in primary fallopian tube carcinoma:correlations with clinicopathologic features[J].Folia Histochem Cytobiol,2011,49(3):389-397.
[13]Mitsutoshi T,Santanu D,Siby S,etal.Estrogen up-regulates cyclooxygenase-2 via estrogen receptor in human uterine microvascular endometrial cells[J].Fertility Sterility,2004,81(5):1351-1356.

