纳米粒子-siRNA复合物抑制脐血树突状细胞SOCS1基因表达的实验研究①
于 鸿 徐广伟 魏天雪 陈智嘉
(吉林省肿瘤防治研究所,长春130012)
树突状细胞(Dendritic cells,DCs)的特点是捕获和提呈抗原的能力高,可迁移到淋巴器官,并表达抗原特异性淋巴细胞活化所需的各种共刺激分子。近年来随着对树突状细胞及其抗肿瘤作用的深入研究,新的功能靶分子和新技术手段为其临床应用提供了更广阔的前景。已经证明细胞因子信号抑制因子1(Suppressor of cytokine signaling,SOCS1)在调控树突状细胞的功能,抑制炎症性疾病和系统性自身免疫中发挥重要的作用。SOCS1作为一个各种细胞因子如 IFN-γ、IL-2、IL-6、IL-7、IL-12 或 IL-15 负调控的信号,通过抑制Janus激酶(JAKs)在T细胞和其他的免疫细胞中发挥作用[1]。SOCS1基因沉默导致DCs的IL-12信号和下游细胞因子网络不受约束,从而导致宿主水平自身耐受的打破和自身免疫性 病 理 反 应[2]。RNA 干 扰 (RNA interference,RNAi)是对基因的序列特异性抑制的新兴技术之一,对人类疾病治疗有巨大的潜力。本研究采用一种复合纳米粒子作为RNA干扰的载体,沉默脐血DCs的SOCS1基因表达,为以DCs为基础的抗肿瘤疫苗的研究提供新思路和实验依据。
1 材料与方法
1.1 细胞因子、抗体和试剂 HuGM-CSF、IL-4、TNF-α 购自 MGI MegaGene公司。MTT、DMSO、IMDM购自Sigma。胎牛血清购自杭州四季青生物工程材料有限公司。兔抗人SOCS1多克隆抗体(H-93)、兔抗人β-actin单克隆抗体、HRP标记羊抗兔IgG购自Santa Cruz。ECL增强型化学发光显色试剂盒购自碧云天生物技术有限公司,Opti-MEM®I低血清培养基、LipofectamineTM2000转染试剂购自Invitrogen。低分子量蛋白质Marker购自TaKaRa。FITC 标记的抗 CD1a、CD40、CD54、CD8、CD86 和HLA-DR抗体购自BioLegend公司。IL-12 ELISA检测试剂盒为达科为公司产品。
1.2 脐血和细胞株 脐血来源于吉林省妇幼保健院。脐血监测试剂盒均购自北京万泰生物药业有限公司。人宫颈癌细胞HeLa细胞株、人乳腺癌MCF-7细胞株和人肺癌A549细胞株由本实验室常规传代培养。
1.3 SOCS1-siRNA序列的设计合成 针对人类SOCS1基因mRNA序列设计的siRNA寡核苷酸由上海吉玛制药技术有限公司化学合成。并通过Blast筛查,与人类基因外显子没有同源性。共合成了2对siRNA序列,序列1 sense 5'-GACUGAUUCCUAUUAAAUA-3',antisense 5'-UAUU-UAAUAGGAAUCAGUC-3';序列2 sense 5'-GCAUU-AACUGGGAUGCCGUTT-3',antisense 5'-ACGGCAUCCCAGUUAAUGCTG-3';阴性对照序列sense 5'-UUCUCCGAACGUGUCACGU-3',antisense 5'-ACGUGACACGUUCGGAGAA-3',阴性对照用荧光染料FAM标记。
1.4 诱导培养脐血DCs 脐血DCs诱导培养和流式细胞术检测DCs细胞表面标志详见参考文献[3]。
1.5 设计合成复合纳米粒子 复合纳米粒子的构建由东北师范大学化学学院完成,详见参考文献[4]。在Fe3O4纳米粒子表面包覆了一层介孔结构的二氧化硅外壳,然后在纳米粒子表面包覆PEI分子。PEI分子具有正电荷,可以和带有负电荷的siRNA结合,从而成为负载siRNA的一种有效的载体。由于有Fe3O4纳米粒子的存在,在外加磁场存在的情况下,合成的纳米粒子具有磁场导向的作用。
1.6 琼脂糖凝胶阻滞实验 制备的纳米粒子与siRNA序列以不同重量比混合(表1),孵育15或30分钟后,混合物在1%(w/v)琼脂糖凝胶上电泳,溴化乙锭染色。
1.7 细胞摄取实验 荧光显微镜和流式细胞术检测纳米粒子-siRNA-FAM复合物在细胞内的运输。实验分为空白组、LipofectamineTM2000-siRNA-FAM组、纳米粒子-siRNA-FAM组、纳米粒子-siRNA-FAM+磁铁组、单独纳米粒子组、单独siRNA-FAM组。靶细胞为HeLa细胞和脐血DCs。细胞被培养在6孔板中(1.0×106cells/ml),24小时后,培养基更换为不含抗生素和血清的IMDM培养基,继续培养6小时后,转染siRNA,实验方法参考LipofectamineTM2000说明书,稍作修改,每孔加入 siRNA 6 μl,LipofectamineTM2000 3 μl,纳米粒子18 μl。转染12 小时后,PBS洗细胞1次,荧光显微镜观察细胞,Coulter Epics XL-MCL流式细胞仪检测。Expo32 ADC软件获取数据,收集5 000~10 000个细胞,Expo32 V1.2软件分析数据。
1.8 Western blot检测脐血DCs SOCS1基因沉默纳米粒子结合传递的SOCS1-siRNA转染脐血DCs后,Western blot实验检测SOCS1蛋白表达,以β-actin做内参照,实验分为空白组、LipofectamineTM2000-siRNA序列1组、纳米粒子-siRNA序列1组、纳米粒子-siRNA序列1+磁铁组、LipofectamineTM2000-siRNA序列2组、纳米粒子-siRNA序列2组、纳米粒子-siRNA序列2+磁铁组、A549阳性对照组。转染48小时后收集细胞,RIPA全细胞裂解液提取细胞总蛋白,BCA法测定蛋白质浓度。12%SDS-PAGE凝胶电泳,在4℃冰箱中转膜,蛋白被转移至硝酸纤维素膜上,BSA室温封闭2小时,TBST洗3次;加入一抗(1∶250稀释,4℃过夜),TBST洗3次,每次10分钟;加入二抗(1∶2 000稀释,室温孵育1小时),TBST洗3次,每次10分钟;用增强化学发光法显色,X光片曝光显影,凝胶成像分析系统摄像分析。

表1 Fe3O4@SiO2-PEI纳米粒子与siRNA混合在不同重量比Tab.1 Fe3O4@SiO2-PEI nanoparticles mixed with siRNA in different weight ratio
1.9 MTT法评估脐血DCs诱导的抗肿瘤活性 首先制备肿瘤抗原:乳腺癌MCF-7细胞培养于含10%FCS的IMDM培养基中,0.25% 胰酶消化传代。细胞呈指数期生长时,调整细胞浓度为1×107cells/ml,加入无血清IMDM培养基,放入液氮中10分钟,室温融化,反复5次,用紫外分光光度计测蛋白浓度。采用自制的红细胞裂解液分离脐血有核细胞,作为效应细胞。调整细胞浓度为1×106cells/ml,接种于6孔板中,每孔3 ml。2小时后收集板中悬浮的细胞备用。脐血DCs的RNA干扰实验方法同前述,在干扰实验的前一天,加入肿瘤抗原,100 μl/孔。实验分组情况见表2,每组4重样。各组经不同处理后的脐血 DCs,每孔加入100 μl丝裂霉素溶液,作用30分钟后,PBS洗2遍,细胞重新计数,按照DC∶T=1∶10的比例将DCs与效应细胞混合培养,3天后收集细胞备用。采用MCF-7细胞作为靶细胞,待细胞生长到指数期时,胰酶消化并计数,调整细胞浓度为3×104cells/ml,接种于96孔板,每孔100 μl,第2天待细胞贴壁后,加入DCs刺激的效应细胞,设2个效靶比,分别为25∶1和50∶1。继续培养72小时,MTT法检测各组DCs刺激的脐血T细胞对肿瘤细胞的杀伤活性。
表2 抗肿瘤活性实验分组Tab.2 Experiment group of antitumor actinities
1.10 ELISA实验检测SOCS1-siRNA处理的各组脐血DCs培养上清中IL-12含量 实验分为空白组、LipofectamineTM2000-siRNA序列1组、纳米粒子-siRNA序列1组、纳米粒子-siRNA序列1+磁铁组,按照试剂盒说明书操作。
2 结果
2.1 流式细胞术检测诱导培养的脐血DCs的表面标志,结果见图1。人DC成熟的主要标志是CD1a、CD40、CD83和CD86等。CD1a常用于鉴定人外周血与骨髓中的DC,但在实验中也发现CD1a表达存在很大个体差异,有报道CD1a在DC成熟过程中表达有所降低,我们的检测结果与此相符。
2.2 凝胶阻滞实验结果见图2。为证实纳米粒子-siRNA的结合能力,纳米粒子与siRNA混合后用琼脂糖凝胶电泳分析。如图所示,siRNA的迁移被阻滞,证明纳米粒子可以与siRNA结合,这种结合是通过静电作用实现的。
2.3 细胞摄取实验结果,目标基因的敲除活性与siRNA结合、摄入和胞质释放特性相关。为确定纳米粒子-siRNA复合物被细胞摄入的情况,我们检查了细胞摄入和定位通过荧光显微镜和流式细胞术。结果如图3所示,纳米粒子-siRNA复合物被清楚地观察到在细胞质中。流式检测证明,单独的FAM-siRNA能少量进入肿瘤细胞中,但是不能进入DCs中;纳米粒子-siRNA复合物被肿瘤细胞摄入的效率高于 LipofectamineTM2000-siRNA,被 DCs细胞摄入的效率低于LipofectamineTM2000-siRNA;在外加磁场的作用下,纳米粒子-siRNA复合物的细胞摄入效率显著提高。
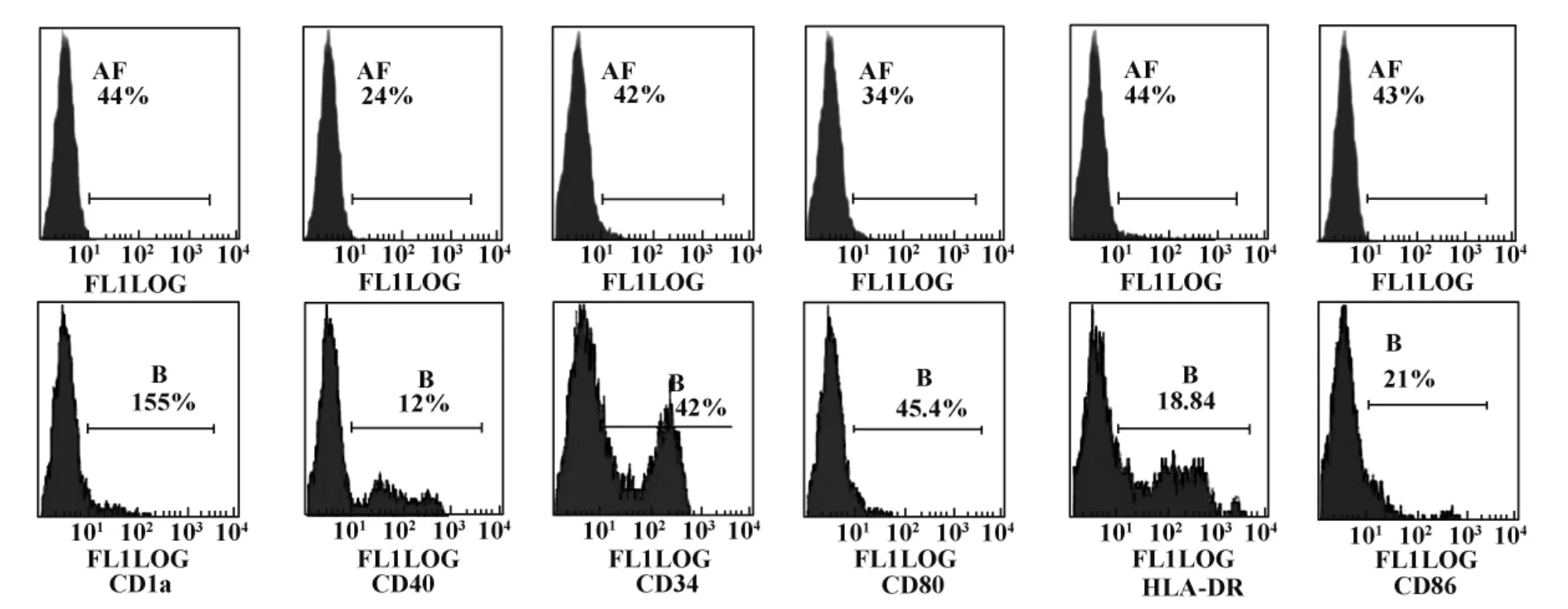
图1 脐血DCs诱导培养11天表型检测结果Fig.1 Phenotype detections on cord blood dendritic cells in 11 d
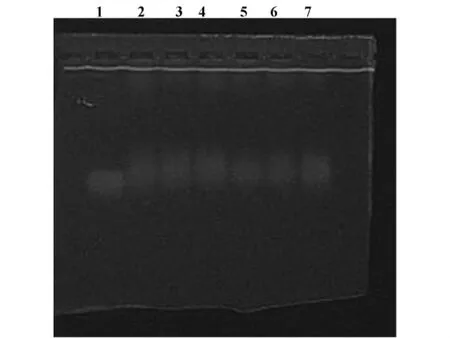
图2 纳米粒子SOCS1-siRNA结合的凝胶阻滞实验Fig.2 Gel retardation assay of nanoparticles SOCS1-siRNA combination
2.4 Western blot实验评估基因沉默效果。为检测RNAi的效率,我们测定了各组siRNA转染后脐血DCs SOCS1蛋白表达的变化。结果见图4,SOCS1蛋白是细胞质蛋白,分子量24 kD,单独的纳米粒子-SOCS1-siRNA序列复合物对SOCS1蛋白表达的抑制效率比LipofectamineTM2000低,在外加磁场的作用下,纳米粒子-SOCS1-siRNA序列复合物显著抑制脐血DCs细胞SOCS1蛋白表达。SOCS1-siRNA序列2与序列1相比没有抑制作用,因此后续实验均使用序列1。

图3 siRNA复合物的细胞摄取实验流式检测直方图Fig.3 Histograms of siRNA complexes cellular uptake experiments
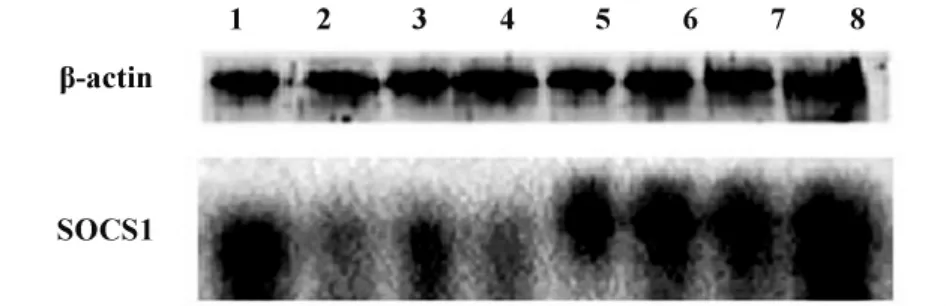
图4 脐血DCs SOCS1蛋白表达Fig.4 SOCS1 protein expression on cord blood dendritic cells
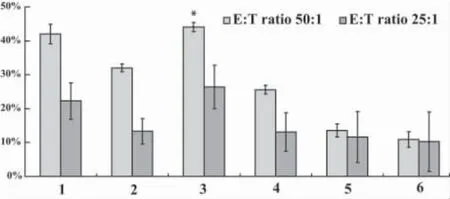
图5 SOCS1-siRNA转染的脐血DCs活化的T细胞对MCF-7细胞的杀伤作用Fig.5 The antitumor activities of T cells activated by SOCS1-siRNA transfected cord blood DCs on MCF-7 cells
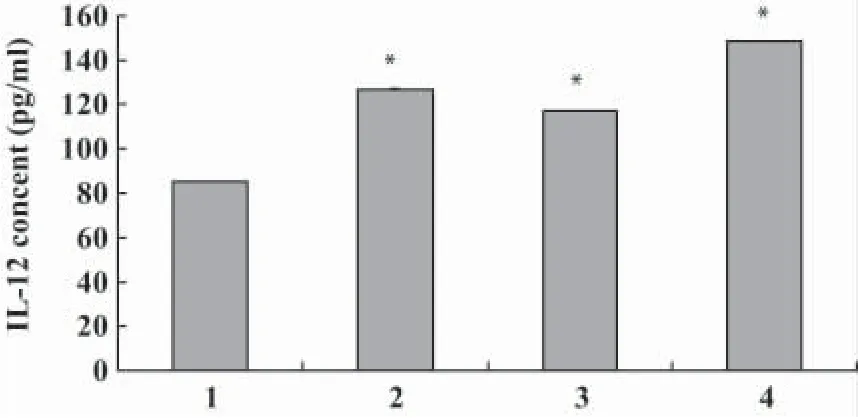
图6 SOCS1-siRNA处理的脐血DCs培养上清IL-12含量Fig.6 IL-12 contents of SOCS1-siRNA transfected cord blood DCs in culture supernatant
2.4 脐血DCs经SOCS1-siRNA处理后抗肿瘤活性实验结果见图5。脐血DCs分别用脂质体转染试剂和纳米粒子传递的siRNA处理后,经丝裂霉素灭活,以1∶10的比例刺激效应细胞。以MCF-7乳腺癌细胞为靶细胞,在效靶比50∶1和25∶1时,对肿瘤细胞的杀伤效率结果如下,与对照组相比统计学上有显著差异。
2.5 ELISA检测SOCS1-siRNA处理的各组脐血DCs培养上清IL-12的含量,结果见图6。脐血DCs经SOCS1-siRNA处理后3个实验组与对照组相比均有显著增强的IL-12细胞因子的分泌(P<0.05,vs空白组),纳米粒子-siRNA序列1+磁铁组的IL-12含量虽然高于LipofectamineTM2000-siRNA序列1组和纳米粒子-siRNA序列1组,但是统计学上没有显著差异。
3 讨论
RNA干扰是由双链RNA介导的序列特异性mRNA降解过程。与常用的反义技术相比,RNA干扰抑制基因的表达不但高效特异,而且效应持久、操作简便。采用RNA干扰技术对癌基因进行选择性的干预已成为肿瘤基因治疗的新手段[5]。但是合成的小干扰RNA(small interference RNA,siRNA)在生理环境中降解比较快,细胞摄入差,缺乏靶向能力,阻碍了它的治疗应用。因此发展有效的传递载体对于siRNA治疗是非常必要的。近年来各种非病毒阳离子脂质、聚合物和肽等已经被利用以形成纳米尺寸的络合物,可以通过静电作用与siRNA结合。这些载体保护siRNA免受核酸酶降解,促进siRNA序列被靶细胞摄入[6]。
本实验中,我们采用东北师范大学化学学院设计合成的复合纳米粒子作为siRNA序列的传递载体。这种复合的纳米材料具有纳米尺寸的Fe3O4核心和介孔结构的二氧化硅外壳,并在纳米粒子表面包覆PEI分子,使粒子具有正电荷,可以和带有负电荷的siRNA结合,结合效率通过琼脂糖凝胶阻滞实验被证实。此外由于有Fe3O4纳米粒子的存在,在外加磁场存在的情况下,合成的纳米粒子具有磁场导向的作用。我们首先用HeLa细胞作为靶细胞,以LipofectamineTM2000为对照,检测了靶细胞摄入纳米粒子-siRNA复合物的能力,证明纳米粒子可以有效传递siRNA序列,其作用优于LipofectamineTM2000;然而脐血DCs摄入纳米粒子-siRNA复合物的能力不同于肿瘤细胞,单独的纳米粒子传递siRNA的能力低于LipofectamineTM2000,只有在外加磁场的作用下,纳米粒子才能有效传递siRNA序列进入靶细胞,并增强DCs刺激的效应细胞的抗肿瘤作用,其效率高于 LipofectamineTM2000。Western blot检测和MTT细胞毒性实验进一步证实了这一结果,这可能是由于诱导培养的脐血DCs的细胞体积比肿瘤细胞小,胞质部分比例比较小的缘故。
2009年,Hong等[7]首次报道了 SOCS1对人类DCs抗原提呈的调节作用,他们发现SOCS1沉默的人PBMC来源的DCs体内外启动自身抗原特异性CTL的能力增强,其机制可能与IL-12相关。与此相符,本研究采用ELISA法检测各组脐血DCs培养上清IL-12的含量,结果表明脐血DCs经SOCS1-siRNA处理后3个实验组与对照组相比均有显著增强的IL-12细胞因子的分泌,而且纳米粒子-siRNA序列1+磁铁组的IL-12含量最高。由于SOCS1负调控多种细胞因子信号,因此尚需进一步研究其他的细胞因子如 IFN-γ、IL-6、IL-1β 等在 SOCS1沉默的脐血DCs中的作用。
复合纳米粒子作为传递siRNA的载体具有很多优点,纳米粒子比表面积大,具有生物亲和性,易于在其表面偶联特异性的靶向分子,使其免遭核酸酶的降解;粒子具有良好的分散性、温和的合成条件、可重复合成,细胞毒性小。已知PEI是有毒的,特别是当用较高剂量时,PEI本身的强正电荷会与细胞表面的负电荷发生强烈的相互作用。而且这种相互作用如果过强,会限制纳米粒子-siRNA复合物在细胞质中释放siRNA,降低siRNA的作用。我们采用MTT实验检测,结果表明,制备的PEI包覆的纳米粒子-siRNA复合物没有明显的细胞毒性。此外,有研究表明PEI结构类似于单体鞭毛蛋白片段,可由 TLR5识别[8]。因此 PEI可作为一种新的TLR5激动剂与多种TLR信号协同作用,激发DCs使之发挥更强的抗肿瘤作用。我们制备的PEI包覆的纳米粒子是否具有这种性质还需要进一步研究。目前我们需要解决的主要问题是保证不同批次制备的纳米粒子的稳定性并深入研究纳米粒子-siRNA复合物处理脐血DCs后,DCs生物学活性和抗肿瘤活性的改变及其机制。
致谢:感谢东北师范大学化学学院王春刚老师、张凌宇同学在实验及文章撰写过程中给予的指导与帮助。
1 Yoshimura A,Naka T,Kubo M.SOCS proteins,cytokine signalling and immune regulation[J].Nat Rev Immunol,2007;7(6):454-465.
2 Evel-Kabler K,Song X T,Aldrich M et al.SOCS1 restricts dendritic cells'ability to break self tolerance and induce antitumor immunity by regulating IL-12 production and signaling[J].J Clin Invest,2006;116(1):90-100.
3 于 鸿,张 健,刘玉侠.RNA干扰抑制SOCS1表达增强树突状细胞抗肿瘤作用[J].中国实验诊断学,2009;13(5):598-601.
4 Zhang L Y,Wang T T,Li L et al.Multifunctional fluorescent-magnetic polyethyleneimine functionalized Fe3O4-mesoporous silica yolkshell nanocapsules for siRNA delivery[J].Chem Commun,2012;48(69):8706-8708.
5 Davis M E,Zuckerman J E,Choi C H et al.Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles[J].Nature,2010;464:1067-1070.
6 Song W J,Du J Z,Sun T M et al.Gold nanoparticles capped with polyethyleneimine for enhanced siRNA delivery[J].Small,2010;6(2):239-246.
7 Hong B,Ren W,Song X T et al.Human suppressor of cytokine signaling 1 controls immunostimulatory activity of monocyte-derived dendritic cells[J].Cancer Res,2009;69(20):8076-7084.
8 Cubillos-Ruiz J R,Engle X,Scarlett U K et al.Polyethyleniminebased siRNA nanocomplexes reprogram tumor-associated dendritic cells via TLR5 to elicit therapeutic antitumor immunity[J].J Clin Invest,2009;119(8):2231-2244.