抗髓过氧化物酶及乳铁蛋白抗体对自身免疫性肝炎检测的临床研究①
谭立明 张玉红 陈冬莲 明 凤 李 华 陈娟娟 王外梅 熊金旺
(南昌大学第二附属医院检验科,南昌330006)
自身免疫性肝炎(Autoimmune hepatitis,AIH)是一组典型组织学表现为界面性肝炎(碎屑样坏死)、血清转氨酶升高、高球蛋白血症、自身抗体检测呈阳性、病毒指标呈阴性的慢性炎症,可合并肝外自身免疫性疾病[1,2]。现多认为由免疫遗传背景加上环境因素刺激引起免疫耐受缺陷和体内免疫微环境平衡紊乱而导致的以自身肝细胞为靶抗原的自身攻击现象[3,4],发病机制尚不明确。本研究通过检测 AIH与非AIH患者血清中抗髓过氧化物酶抗体(Antimyeloperoxidase antibody,AMPA)、抗乳铁蛋白抗体(Anti-lactoferrin antibody,ALA)等自身抗体,探讨AMPA、ALA等自身抗体对AIH检测的临床意义,旨在发现潜在血清学指标,提高AIH的诊断水平以及为进一步研究AIH发病机理提供依据,研究报告分析如下。
1 材料与方法
1.1 材料来源 63例AIH及206例非AIH患者来自南昌大学第二附属医院自2008年7月至2012年6月门诊、住院确诊病例。63例AIH患者中男性9例,女性54例,年龄为4~69岁,平均为43岁;206例非AIH分别为:36例原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC)中男性6例,女性30例,年龄为31~69岁,平均为49岁,25例原发性硬化性胆管炎(Primary sclerosing cholangitis,PSC)中男性19例,女性6例,年龄为21~61岁,平均为39岁;61例乙型肝炎(Hepatitis B,HB)中男性29例,女性32例,年龄为18~60岁,平均为38岁,53例丙型肝炎(Hepatitis C,HC)中男性27例,女性26例,年龄为20~59岁,平均为41岁,31例戊型肝炎(Hepatitis E,HE)中男性11例,女性20例,年龄为18~60岁,平均年龄为47岁;对照组50例均为南昌大学第二附属医院体检中心健康体检者,男性15例,女性35例,年龄为23~57岁,平均年龄为33岁。均获得患者以及证明为无病健康体检者的许可,所有入选者均签署知情同意书。
1.2 诊断依据 ①自身免疫性肝病AIH、PBC、PSC诊断综合参考国际诊断标准[5];②病毒性肝炎诊断参考卫生部2008年更新的病毒性肝炎诊断指南[6]。
1.3 纳入标准 2007年7月至2012年6月在南昌大学第二附属医院确诊的AIH及非AIH患者,自愿成为研究对象且符合以下条件者予以纳入:①临床资料齐全且具有肝组织学病理资料;②自身免疫性肝病患者至少两次检测病毒性标志物为阴性;③对所有自愿参与病人的资料重新评估,无血色病、抗胰蛋白酶缺乏症、Wilson病等其他遗传性肝损疾病;④年龄在4~70岁,均符合本研究参考的诊断指标。
1.4 排除标准 凡有下列情况者予以剔除:①没有完整临床资料或肝组织学病理资料;②发病前有明确服用肝毒性药物史,酒精性脂肪肝病史,大量饮酒史,恶性肿瘤史;③患有血色病、抗胰蛋白酶缺乏症、Wilson病等其他遗传性肝损疾病;④合并糖尿病、痛风、苯丙酮尿症;⑤妊娠或哺乳期妇女;⑥失代偿期肝硬化;⑦不愿成为研究对象。
1.5 试剂和方法
1.5.1 标本的采集 标本均为空腹采集不抗凝血2.0 ~3.0 ml,以2 500 r/min 速度离心15 分钟分离血清,-20℃冷冻待检。
1.5.2 检测方法 AMPA、ALA检测采用德国欧蒙公司生产的ELISA法试剂,操作过程为将样品稀释,按加样方案向相应微孔中分别加稀释血清、阴性、阳性对照和空白对照各100 μl,室温温育30分钟,洗板3次,加酶标抗体100 μl再室温温育30分钟,同前洗板3次。加底物显色,5分钟后加终止液,用450 nm波长比色,计算结果。抗核抗体(Anti-nuclear antibodies,ANA)、抗平滑肌抗体(Antismooth muscle antibodies,ASMA)、抗中性粒细胞胞质抗体(Anti-neutropil cytoplasmic antibodies,ANCA)检测的试剂盒由德国欧蒙公司生产,ANA选择Hep-2细胞和猴肝作为抗原;ASMA抗体采用大鼠胃的冰冻组织切片;ANCA采用在生物薄片马赛克上覆有中性粒细胞(乙醇或甲醛固定)、Hep-2细胞和猴肝四种基质的复合片,4℃保存备用。实验设计采用完全空白对照,操作方法严格按试剂说明及科室作业指导书进行操作。
1.6 统计学分析 应用SPSS16.0软件进行统计分析,计数资料以例数(百分比)描述,组间单因素分析采用χ2检验,P<0.05为差异有显著性统计学意义,P<0.01为差异有非常显著性统计学意义。并对AIH患者各种自身抗体的敏感性、特异性、有效性、阳性预测值、阴性预测值、阳性似然比和阴性似然比等指标进行临床评价,有效性=(真阳性+真阴性)/(病例组+对照组);特异性=真阴性/对照组;敏感性=真阳性/病例组;阳性预测值=真阳性/阳性组;阴性预测值=真阴性/阴性组;阳性似然比=真阳性率/假阳性率;阴性似然比=假阴性率/真阴性率。
2 结果
2.1 AIH与非AIH对AMPA、ALA等自身抗体的检测 63例AIH、206例非AIH及50例健康体检者检测AMPA、ALA、ANCA、ASMA及ANA结果显示,AIH组AMPA阳性率为61.9%(39/63),与非AIH及对照组比较均有统计学差异,P<0.01;AIH组ALA阳性率为19.0%(12/39),非 AIH组阳性率0.5%(1/206),组间比较 P<0.01,PSC 组有1例阳性(4.0%),与 AIH 组比较 P>0.05;ASMA 阳性率最高为68.3%,ANA阳性各组均有检出,与非AIH各组比较均P<0.05,详见表1。
2.2 AIH患者AMPA、ALA等自身抗体检测的各项试验评价指标 AMPA、ALA、ANCA、ASMA及ANA在AIH患者中各项临床试验指标显示ALA、AMPA特异性分别高达99.61%、97.2%,但敏感性ALA最低为19.05%,详见表2。
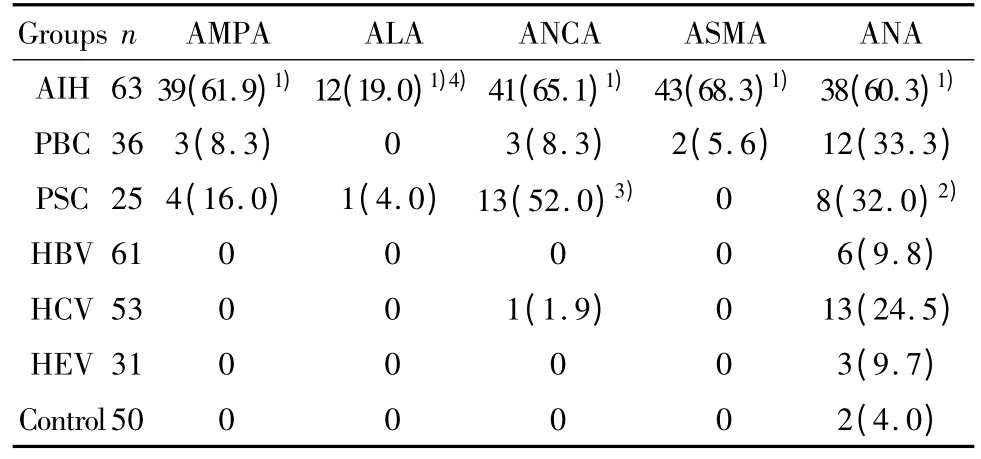
表1 AIH 及非AIH 患者AMPA、ALA、ANCA、ASMA和ANA检测结果[例(%)]Tab.1 AIH and non AIH patient’s results in detected by AMPA,ALA,ANCA,ASMA and ANA[n(%)]
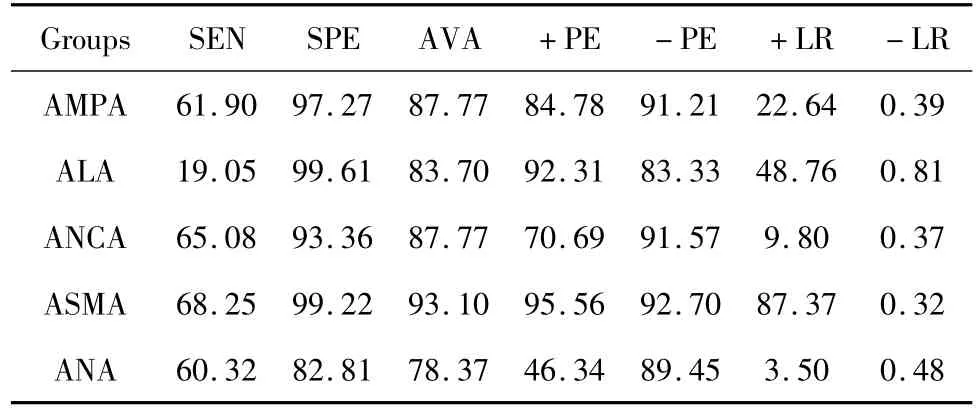
表2 AMPA、ALA、ANCA、ASMA及ANA在AIH患者临床评价指标比较Tab.2 The clinical indexes of AMPA,ALA,ANCA,ASMA and ANA in AIH
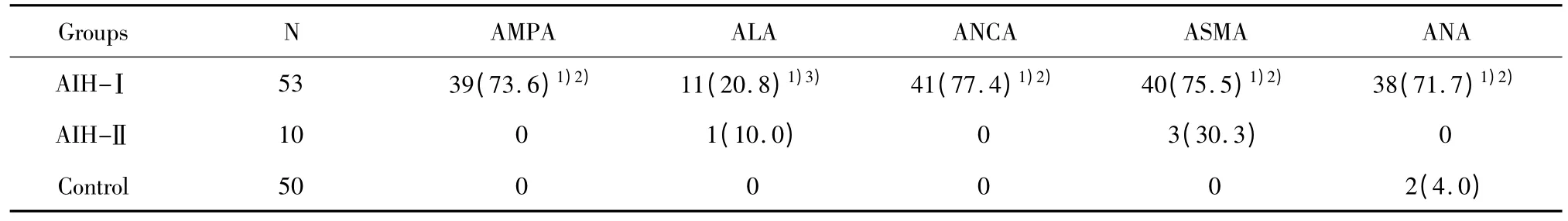
表3 AIH各亚型患者AMPA、ALA、ANCA、ASMA和ANA阳性结果[例(%)]Tab.3 Different subtypes of AIH patient’s results in detection of AMPA,ALA,ANCA,ASMA and ANA positive results[n(%)]
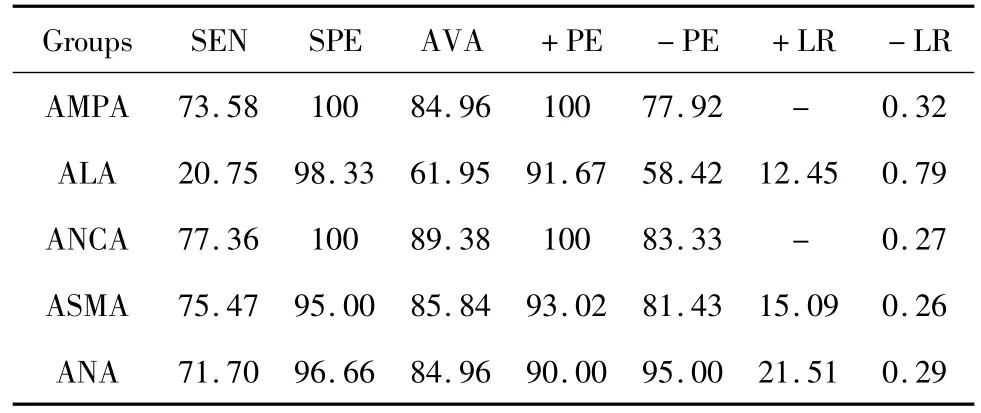
表4 AMPA、ALA、ANCA、ASMA 及 ANA 在 AIH-Ⅰ患者临床评价指标比较Tab.4 The clinical indexes of AMPA,ALA,ANCA,ASMA and ANA in AIH-Ⅰ
2.3 AIH各亚型患者AMPA、ALA等自身抗体的检测 AIH患者AIH-Ⅰ组AMPA阳性率73.6%(39/53),AIH-Ⅱ组AMPA阳性为零,组间比较P<0.01;AIH-Ⅰ组 ALA 阳性率 20.8%(11/53),AIH-Ⅱ组ALA阳性率 10.0%(1/10),组间比较 P>0.05;AIH-Ⅰ组检测ANCA阳性率77.4%(41/53),ASMA阳性率75.5%(40/53),ANA阳性率71.7%(38/53),与AIH-Ⅱ组间比较均P<0.01。相关性分析,经 χ2检验,AIH-Ⅰ型中 AMPA 与 ANCA、ASMA、ANA比较,均为P<0.01,ALA与各抗体比较均P>0.05;AIH-Ⅱ组 ALA 与 AMPA、ANCA、ANA 比较均为 P <0.05,与 ASMA 比较 P >0.05,详见表3。
2.4 AIH-Ⅰ中AMPA、ALA等自身抗体检测的各项试验评价指标 AMPA、ALA、ANCA、ASMA及ANA在AIH-Ⅰ患者中各项临床试验指标显示特异性AMPA、ANCA均最高为100%,ALA为98.33%,但ALA敏感性最低为20.75%,阳性预测值 AMPA、ANCA均最高为100%,ALA为91.67%,阳性似然比AMPA、ANCA均最大,详见表4。
3 讨论
随着免疫学、病毒学、分子生物学等临床诊断水平的不断提高,AIH的诊断已不再罕见,该病多发于女性[3],免疫抑制剂治疗通常有一定疗效,但严重病例若不及时治疗六个月死亡率将高达40%。与其他肝病相比AIH无明显特异性而常导致误诊[7],等确诊接受正确治疗时已发展为肝硬化。AIH患者体内产生各种自身抗体,ANCA就是其中一种,髓过氧化物酶 (Myeloperoxidase,MPO)、乳铁蛋白 (Lactoferrin,LF)均为ANCA的靶抗原。MPO是血管中活化的中性粒细胞、单核细胞、巨噬细胞分泌的血红素蛋白酶,近年来研究发现MPO基因的多态性与多种疾病的易感性有关[8],表明中性粒细胞活化后聚集至肾脏并大量释放 MPO[9,10],认为 AMPA 与肾脏损伤改变密切相关,AMPA是否同样与AIH患者肝脏受损密切相关呢?在急性炎症疾病时,ALA水平会增高。研究发现中性粒细胞中的一些颗粒蛋白(除蛋白酶-3和MPO)相应的自身抗体可作为潜在的血清自身抗体指标,如ALA[11]。自身抗体的产生是AIH的特点之一,因此,找到更多具有高敏感性或疾病特异性的血清自身抗体对AIH的诊断与鉴别有重要意义。
笔者对63例AIH患者检测血清AMPA、ANCA、ASMA及ANA等自身抗体,阳性率分别为61.9%、65.1%、68.3%、60.3%,结果与报道相符[12,13],与非 AIH相比,P<0.01;AIH中 ALA阳性率为19.05%,与非AIH比较P<0.01,且非AIH组中仅发现PSC中有1例ALA阳性,其余均为阴性,并且AIH各项评价指标显示特异性为ALA最高99.6%,AMPA为97.27%,ASMA除特异性与阴性似然比均最高,ANA检测在AIH组阳性率60.3%,PBC组阳性率33.3%,PSC组阳性率32.0%,HCV组阳性率为24.5%,HBV阳性率为 9.8%,HEV阳性率为9.7%;ASMA检测在AIH组阳性率为68.3%,PBC组阳性率为5.6%,其余组为零,与王爱莉等人的报道基本一致[14-16]。抗体间相关性分析,经χ2检验:AIH组,AMPA与ANCA、ASMA比较均为P<0.05,ALA与其余抗体比较为P>0.05;AIH-Ⅰ组,AMPA与ANCA、ASMA、ANA 比较均为P <0.01,ALA 与各抗体比较P>0.05。说明AMPA诊断AIH的价值优于ANCA、ASMA,ALA的诊断价值与NCA、ASMA及ANA相当,AMPA鉴别AIH-Ⅰ有非常显著性意义,AMPA、ALA联合 ANCA、ASMA及 ANA抗体检测对AIH的鉴别诊断有重要意义,AMPA及ALA等自身抗体与AIH的发生发展密切相关。
ANCA是以中性粒细胞胞质为靶抗原的自身抗体,分为核周型抗中性粒细胞胞质抗体(p-ANCA)和核质型抗中性粒细胞胞质抗体(c-ANCA)。p-ANCA的靶抗原主要是MPO,MPO为中性粒细胞功能与活化的标志,MPO不但能杀灭细胞内的微生物还能释放到细胞外,破坏多种靶物质,在机体调节和产生炎症反应等诸多方面发挥作用。研究发现,p-ANCA与MPO结合后,MPO功能受到抑制,导致中性粒细胞大量活化,呼吸爆炸,脱颗粒,产生大量过氧化物和超氧化物,致使炎症组织细胞损害;p-ANCA也可通过刺激血管内皮细胞使E-选择素、血管黏附分子-1及细胞间黏附分子-1等黏附分子的表达增加,从而干扰MPO抑制物血浆铜蓝蛋白的灭活,引起组织损伤。AIH发病机制尚不明确,AMPA是否与AIH存在相关性呢?笔者检测63例AIH患者血清AMPA抗体阳性率为69.1%,与非AIH各组比较,P<0.01,差异有非常显著性意义;AIH亚型AIH-Ⅰ AMPA阳性率为73.6%,而 AIH-Ⅱ及健康组AMPA均无1例阳性,与文献[17]报道基本一致,说明AMPA与AIH特别是与AIH-Ⅰ有密切关系,其具体机制有待进一步研究。
LF是由中性粒细胞颗粒释放的一种铁结合糖蛋白[18],存在鼻腔分泌物、唾液、眼泪、初乳、阴道分泌物、精液等体液中,是人体免疫系统第一道战线上的勇士[19],研究发现 LF有特异的免疫调节功能[16-20],主要与其靶细胞表面的特异性受体有关,单核细胞、淋巴细胞、血小板、肝细胞、乳腺表皮细胞及肠上皮细胞的表面均发现有LF受体[21],LF能与细胞表面受体结合从而发挥免疫功能;LF与脂多糖(LPS)有很高的亲和力[22],可以和LPS-结合蛋白竞争性结合LPS,从而阻止LPS向单核细胞表面的补体CD14传递,发挥免疫调节功能,LF还能抑制炎症区血管内皮细胞内IL-8的转录和表达,调节白细胞在炎症区的聚集,抑制毒血症的发生。总之,LF具有促进中性粒细胞吸附聚集于炎症部位、增加粒细胞黏附作用、抗氧化、调节免疫球蛋白分泌、抑制补体系统的激活或激活已有的补体、参与调节机体免疫耐受能力以及促进细胞间相互作用等一系列功能[23,24]。笔者假设中性粒细胞被激活,脱颗粒从而释放LF,与肝细胞表面的LF受体结合,同时大量中性粒细胞聚集,机体免疫耐受能力下降,导致ALA攻击肝细胞从而导致肝损伤。笔者检测63例AIH与206例非AIH患者血清中ALA阳性率分别为19.0%,0.5%,经 χ2检验,P <0.01,差异有非常显著性统计学意义,而非AIH中仅仅PSC组中检出1例ALA阳性,其余组ALA检测均为阴性,AIH各项临床评价指标显示ALA特异性为最高达99.61%,有效性为83.70%,阳性预测值为92.31%,阴性预测值为83.33%,但在其他指标评价均很高的情况下,ALA的敏感性却最低仅为19.05%,充分证明ALA的检测对诊断AIH有非常高的特异性,优于在其他自身免疫性肝病。
最新研究表明根据血清自身抗体可以将AIH分为两种亚型,AIH-Ⅰ最常见,以ANA和(或)ASMA阳性为主要特征;AIH-Ⅱ多见于儿童,也可伴ANA和(或)ASMA阳性[3]。本研究结果显示AM-PA检测在 AIH-Ⅰ患者中阳性率73.6%,和文献[25]报道相符,与AIH-Ⅰ和健康对照组比较P<0.01,差异有非常显著性统计学意义;AIH-Ⅰ组经检测ALA阳性率20.8%,与健康组比较P<0.05,差异有显著性意义;AIH-Ⅰ各项评价指标显示特异性为AMPA、ANCA最高100%,ALA为98.33%,阳性预测值AMPA、ANCA最高100%,同样ALA敏感性最低为20.75%,AIH各项评价指标显示除特异性和阴性似然比外均为ASMA最高,敏感性68.25%,有效性93.10%,阳性预测值95.5%,阴性预测值92.70%,阳性似然比 87.37。所以 AMPA、ALA 联合ANCA、ASMA及ANA等自身抗体检测对AIH亚型的鉴别诊断有一定价值。
某些药物引起的肝损害患者常能检测到自身抗体阳性,如抗ANA、ASMA等抗体,临床表现为慢性肝炎症状、发热、高球蛋白血症、关节疼痛等慢性肝病体征,同样主要为女性患者,与AIH很难鉴别,近年来极受国内外学者关注。Bjornsson等[26]发现药物诱导的AIH与经典AIH在自身抗体、肝功能指标、免疫球蛋白、组织学、性别以及年龄上差异无统计学意义,导致误诊误疗。也有研究表示病毒感染也会诱导产生自身免疫现象,与自身免疫性肝炎可出现类型相似的自身抗体[27,28],常导致误诊。本研究显示,ALA检测AIH组阳性率19.0%,非AIH组阳性率 0.5%,经 χ2检验,P <0.05,差异有显著性意义,非AIH组中仅仅PSC组发现1例阳性,这表明ALA联合原始血清自身抗体检测对鉴别诊断AIH与非AIH有非常重要的价值,可能是鉴别AIH和药物性自身免疫性肝炎(DIAIH)或者其它自身免疫性疾病以及病毒性肝炎的潜在武器。
综上所述,AMPA、ALA与 AIH有一定的相关性,是诊断AIH的有效血清学自身抗体检测指标,联合ANCA、ASMA及ANA等自身抗体的检测对AIH的诊断与鉴别诊断有重要意义。AMPA、ALA与AIH有密切关联,内在机制有待进一步研究。
1 Czaja A J,Manns M P.Advances in the diagnosis,pathogenesis,and management of autoimmune hepatitis[J].Gastroenterology,2010;139(1):58-72.
2 Muratori L,Muratori P,Granito A et al.Current topics in autoimmune hepatitis[J].Dig Liver Dis,2010;42(11):757-764.
3 Vgani D,Longhi M S,Bogdanos D P et al.Autoimmune hepatitis[J].Semin Immunopathol,2009;31(3):421-435.
4 Manns M P,Czaja A J,Gorham J D et al.Diagnosis and management of autoimmune hepatitis[J].Hepatology,2010;51(6):2193-2213.
5 De-kai Qiu,Qi-xia Wang.Validation of the simplified criteria for diagnosis of autoimmune hepatitis in Chinese[J].J Hepatol,2011;54(2):340-347.
6 中华人民共和国卫生行业标准.中华人民共和国卫生部.传染病诊断标准[S].2008;(WS):298-301.
7 Lohse A W,Wiegard C.Diagnostic criteria for autoimmune hepatitis[J].Best Pract Res Clin Gastroenterol,2011;25(6):665-671.
8 Polonikov A V,Solodilova M A,Ivanov V P.Genetic variation of myeloperoxidase gene contributes to atopic asthma susceptibility:a preliminary association study in Russian population[J].J Asthma,2009;46(5):523-528.
9 Liu C G,Gao H K.Changes and significance of neutrophils in the experimental mice toxic in renal injury[J].J Dalian Med University,2011;32(2):111-115.
10 LIAO Y Q,PENG K J,LIU J R et al.Clinical significance of antineutrophilcytoplasmic antibody monitoring in patients with concurrent rheumatoid arthritis and crescentic glomerulonphritis[J].Int J PATHOL Clin Med,2012;32(2):104-109.
11 Deniziaut G,Ballot E.Antineutrophil cytoplasmic auto-antibodies(ANCA)in autoimmune hepatitis and primary sclerosing cholangitis[J].Clin Res Hepatol Gastroenterol,2013;37(1):105-107.
12 TAN L M,WANG Y Y,Li H et al.A survey of auto-antibodies in 161 patient with autoimmune liver diseases[J].Immunol J,2012;28(12):1061-1064.
13 WONG K G,CAO W K,ZHANG Y M et al.Significance of detection of autoantibodies in autoimmune liver disease in patients with hepatic dysfunction[J].J Practical Med,2012;28(11):1885-1887.
14 Wang Ai-li.Analyse the results of test autoantibody in 92 cases of autoimmune hepatitis Clinical[J].Int J Lab Med,2011;32(11):1240-1241.
15 Wang Rong,Geng Xiu - rong,Tan Sha et al.The feature of autoan tibodies in hepatitis C and autimmune hepatitis[J].Sichuan Med J,2011;32(2):253-255.
16 Dong Min,Zou Hou-qin,Wu Jing-bin.Detection and clinical significance of serum anti-nuclear antibodyes in patients B virus infection[J].Lab Med,2012;27(5):374-375.
17 Tan Li-ming,Peng Wei-hua,Dong Ye et al.Clinical value of antimyeloperoxidase antibody on diagnosis of autoimmune hepatitis[J].J Immunol,2009;25(6):697-704.
18 Legrand D,Elass E,Carpentier M et al.A modulator of immune and inflammatory responses[J].Cell Mol Life Sci,2005;62(22):2549-2559.
19 Farnaud S,R.EvansLactoferrin-a multifunctional protein with antimicrobial properties[J].Mol Immunol,2003;40(7):395-405.
20 H Wakabayashi,N Takakura,K Yamauchi et al.Modulation of immunity related gene expression in small intestines of mice by oral administration of lactoferrin[J].Clin Vaccine Immunol,2006;13(2):239-245.
21 Suzuki Y A,Lonnerdal B.Characterization of mammalian receptors for lactoferrin[J].Biochem Cell Biol,2002;80(1):75-80.
22 Haversen L,Ohlsson B G,Hahn-Zoric M et al.Lactoferrin downregulates the LPS-induced cytokine production in monocytic cells via NF-kappa B[J].Cell Immunol,2002;220(2):83-95.
23 García-Montoya I A,Cendón T S,Arévalo-Gallegos et al.Lactoferrin a multiple bioactive protein:An overview[J].Biochimica et Biophysica Acta,2012;1820(3):226-236.
24 Ann M.Muldera,Paul A.Connellana,Christopher J.Oliver et al.Bovine lactoferrin supplementation supports immune and antioxidant status in healthy human males[J].Nutr Res,2008;28(9):583-589.
25 Zhang L F,Zheng S G,Yan Y G.Significances of anti-antibodies in autoimmune and virus hepatic disease[J].Chin J Lab Diag,2008;12(6):745-748.
26 Bjornsson E,Talwalkar J,Treeprasertsuk S et al.Drug-inducedautoimmune hepatitis:clinical characteristics and prognosis[J].Hepatology,2010;51(6):2040-2048.
27 Chrétiena P,Choustermanb M ,Abd Alsamad I et al.Non-organspecific autoantibodies in chronic hepatitis C patients:Association with histological activity and fibrosis[J].J Autoimmun,2009;32(3-4):201-205.
28 Carlo Palazzia,Dan Buskilab,Salvatore D'Angelo et al.Autoantibodies in patients with chronic hepatitis C virus infection:pitfalls for the diagnosis of rheumatic diseases[J].Autoimmun Rev,2012;11(9):659-663.