Lactobacillus casei胞外多糖对BALB/c小鼠肠相关淋巴细胞调控的初步研究①
包 鹏 唐彦君 刘 宁 (东北农业大学食品学院乳品科学教育部重点实验室,哈尔滨150030)
小肠作为机体消化吸收营养物质的重要器官,同时具有黏膜免疫功能。由小肠的结构特性决定了病原微生物在体内停留时间长,作用面积大,因而极易引起肠道疾病,进而影响机体健康。肠道相关淋巴组织,包括上皮内淋巴细胞、固有层淋巴细胞、派氏集合淋巴结和肠系膜淋巴结,在抵御肠道病原微生物过程中起重要作用,是肠道免疫的重要参与者[1]。这些肠道相关淋巴组织中的免疫细胞或直接作用于入侵病原微生物,或通过释放各类细胞因子等方式对病原微生物发挥免疫作用[2]。肠道相关淋巴组织中的淋巴细胞主要由T淋巴细胞和B淋巴细胞组成。其中,上皮内淋巴细胞、固有层淋巴细胞及肠系膜淋巴结均含有较高比例的T淋巴细胞,而派氏集合淋巴结则是B淋巴细胞的含量较高[3,4]。其分泌产生的诸多细胞因子在维持肠道免疫平衡及对抗入侵病原中发挥的重要作用。其中的IFN-γ、TNF-α、IL-17 更是参与肠道细胞免疫和黏膜屏障的主要细胞因子。IFN-γ参与由肠组织损伤等引起的免疫调节并具有活化巨噬细胞等免疫能力;TNF-α则拥有直接改变上皮层完整性进而改善肠损伤等生理功能;而IL-17是通过诱导炎症趋化因子及抑菌蛋白的分泌的方式协助黏膜免疫屏障对抗胃肠道的病原微生物[5,6]。因此,上述部位淋巴细胞的数量及其分泌IFN-γ、TNF-α、IL-17的水平与肠道免疫能力密切相关。近年来研究证实,乳酸菌及其所产生的胞外多糖具有调节机体免疫力的生理功能[7]。其中广泛应用于发酵食品中的干酪乳杆菌能够通过调节淋巴细胞数量、调控相关细胞因子分泌等方式改善正常或疾病状态下的肠道免疫能力[8,9]。但作为发酵食品中天然成分—由干酪乳杆菌分泌的重要免疫活性物质胞外多糖(exopolysaccharide,EPS)对肠道淋巴细胞的调节尚未见报道,对不同肠相关淋巴组织淋巴细胞的调节也未见报道。本研究采用WST-1法和ELISA法分别检测经干酪乳杆菌EPS处理后BALB/c小鼠小肠四部位肠相关淋巴组织中的淋巴细胞增殖能力及细胞因子TNF-α、IL-17及 IFN-γ 分泌水平,旨在初步探讨干酪乳杆菌胞外多糖对不同肠相关淋巴组织淋巴细胞的调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及菌种 BALB/c小鼠,6周龄,雌性,由北京维通利华公司提供(批号:2012-021316)。无特殊病原的环境饲养(SPF级),正常供食供水;干酪乳杆菌(购自于美国的ATCC,编号:ATCC393TM)。
1.1.2 试剂及试剂盒 本实验所用试剂及试剂盒包括:Percoll原液(Sigma公司),胶原蛋白酶 IV(Sigma公司),RPMI1640培养液,胎牛血清,小鼠TNF-α、IL-17 及 IFN-γ ELISA 检测试剂盒(ebioscience公司)及WST-1细胞增殖及细胞毒性检测试剂盒(碧云天生物技术有限公司),其他常规试剂均为分析纯。
1.1.3 仪器 酶标仪,电热恒温培养箱,CO2恒温培养箱,无菌超净工作台,真空冷冻干燥机,高速冷冻离心机,倒置显微镜。
1.2 方法
1.2.1 干酪乳杆菌胞外多糖的提取[10]将干酪乳杆菌按5%体积分数接种于脱脂乳培养基中,32℃培养24小时,后对其依次进行离心、三氯乙酸除蛋白、乙醇沉淀、透析和冻干处理,得到纯化的干酪乳杆菌胞外多糖,即EPS。
1.2.2 肠相关淋巴细胞的制备[11,12]颈椎脱位法处死小鼠,取幽门至盲肠的全部小肠,浸泡于预冷的D-Hank's液中,仔细剥离肠系膜,小心剪下派氏集合淋巴结。用含有5%胎牛血清的D-Hank's液反复冲洗肠腔,将冲洗干净的小肠延纵轴剪开,置于含有EDTA-DTT消化液的离心管中,37℃下180 r/min水平振荡40分钟,细胞悬液过400目不锈钢滤网,离心收集,将细胞重悬于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min离心30分钟,收集交界面处细胞,即为上皮内淋巴细胞(Intraepithelial lymphocytes,IEL);将经 EDTA-DTT消化液消化后的小肠,置于含胶原蛋白酶消化液的离心管中,37℃下180 r/min水平振荡30分钟,细胞悬液过400目不锈钢滤网,离心收集,将细胞重悬于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min离心30分钟,收集交界面处细胞,分离得到固有层淋巴细胞(Lamina propria lymphocytes,LPL);将剥离的肠系膜及收集的派氏集合淋巴结进行研磨,400目不锈钢网过滤,离心收集,将细胞重悬于5 ml 40%Percoll液中,小心加在4 ml 70%Percoll液面上,1 000 r/min离心30分钟,收集交界面处细胞,分别得到肠系膜淋巴结淋巴细胞(Mesenteric lymph nodes lymphocytes,MLNL)和派氏集合淋巴结淋巴细胞(Peyer's Patches lymphocytes,PPL)。
1.2.3 细胞增殖实验 将无菌制备的IEL、LPL、PPL及MLNL调整细胞浓度为2×106ml-1,以100 μl/孔接种于96孔培养板中。实验组每孔加入100 μl不同浓度的干酪乳杆菌胞外多糖,使终浓度分别为 10、25、50、100 和200 μg/ml,另设等量 RPMI1640培养基为空白对照组。将96孔板置于37℃ 5%CO2培养箱中培养48小时。培养结束后,按照WST-1细胞增殖及细胞毒性检测试剂盒步骤说明进行操作,分别检测 IEL、LPL、PPL及 MLNL增殖情况,并计算半数有效剂量(ED50)。
表1 不同浓度EPS对GALT淋巴细胞增殖能力的影响(A450,±s,n=5)Tab.1 Effect of different conentration EPS on GALT lymphocytes proliferation(A450,±s,n=5)

表1 不同浓度EPS对GALT淋巴细胞增殖能力的影响(A450,±s,n=5)Tab.1 Effect of different conentration EPS on GALT lymphocytes proliferation(A450,±s,n=5)
Note:Vs control group,1)P <0.05,2)P <0.01.
EPS(μg/ml)IEL LPL PPL MLNL Control 0.225±0.013 0.250±0.011 0.215±0.00 20±0.011 7 0.242±0.010 10 0.237±0.007 0.254±0.012 0.216±0.003 0.253±0.008 25 0.275±0.018 0.274±0.007 0.228±0.005 0.268±0.007 50 0.283±0.019 0.284±0.007 0.252±0.007 0.297±0.019 100 0.295±0.021 0.292±0.013 0.272±0.009 0.314±0.015 200 0.290±0.024 0.284±0.009 0.262±0.008 0.3
1.2.4 细胞因子的检测 将无菌制备的IEL、LPL、PPL及 MLNL调整细胞浓度为 2×106ml-1,以100 μl/孔接种于96孔培养板中。实验组每孔加入100 μl不同浓度的干酪乳杆菌胞外多糖,使终浓度分别为 10、25、50、100 和 200 μg/ml,另设等量 RPMI1640培养基为空白对照组。将96孔板置于37℃5%CO2培养箱中培养48小时。培养结束后,按照小鼠TNF-α、IL-17、IFN-γ检测试剂盒步骤说明进行操作,分别检测IEL、LPL、PPL及MLNL上清液中细胞因子 TNF-α、IL-17、IFN-γ 分泌量,并计算 EPS 的半数有效剂量(EP50)。
1.3 统计学分析 每个独立实验均重复三次,每次设置五个平行。各组实验数据用(±s)表示,应用SPSS 17软件进行统计学处理,以One-way ANOVA方法分析各组数据之间的差异。P<0.05表示差异显著,P<0.01表示差异极显著,以Probit回归分析方法统计分析EPS的半数有效剂量(EP50)。
2 结果
2.1 EPS对小鼠小肠IEL、LPL、PPL及MLNL增殖的影响 EPS对BALB/c小鼠小肠IEL、LPL、PPL及MLNL增殖有一定的促进作用,结果见表1。其对MLNL增殖能力的影响最强,在50~200 μg/ml浓度时与对照组相比均存在显著差异(P<0.05),且呈剂量依赖性,ED50约为42.85 μg/ml;对于 IEL、LPL及PPL增殖能力在50~200 μg/ml浓度时的影响与对照组相比差异显著(P<0.05)或极显著(P<0.01),但并不呈剂量依赖性,而是在100 μg/ml浓度时达到最大值,ED50 分别约为24.75、28.76 和41.25 μg/ml。
2.2 EPS对小鼠IEL、LPL、PPL及MLNL分泌TNF-α调控 如图1所示,EPS能够明显地抑制BALB/c小鼠小肠 IEL、LPL及 PPL分泌细胞因子 TNF-α。在50~200 μg/ml浓度时,IEL、LPL 上清液中 TNF-α的含量与对照组相比有极显著性的降低(P<0.01),呈剂量依赖性,ED50约为 44.12和50.59 μg/ml;PPL上清液中的细胞因子TNF-α则在50 μg/ml后无法测出,ED50 约为 17.92 μg/ml。但是EPS对MLNL分泌TNF-α并无明显的抑制作用,且在200 μg/ml时有显著提高(P<0.01),ED50约为 123.56 μg/ml。
2.3 EPS对小鼠IEL、LPL、PPL及MLNL分泌IL-17调控 如图2所示,EPS能够明显地促进BALB/c小鼠小肠IEL、LPL、PPL及MLNL分泌细胞因子IL-17。IEL上清液中IL-17的含量在浓度25~200 μg/ml时与对照组相比有显著性(P<0.05)或极显著性的升高(P<0.01),呈剂量依赖性,ED50约为29.16 μg/ml;LPL、PPL上清液中的细胞因子IL-17则在50 μg/ml时达到最大值,且差异极显著(P<0.01),ED50约为33.12和27.15 μg/ml;MLNL上清液中的IL-17在200 μg/ml时达到最大值,且差异极显著(P <0.01),ED50 约为88.86 μg/ml。
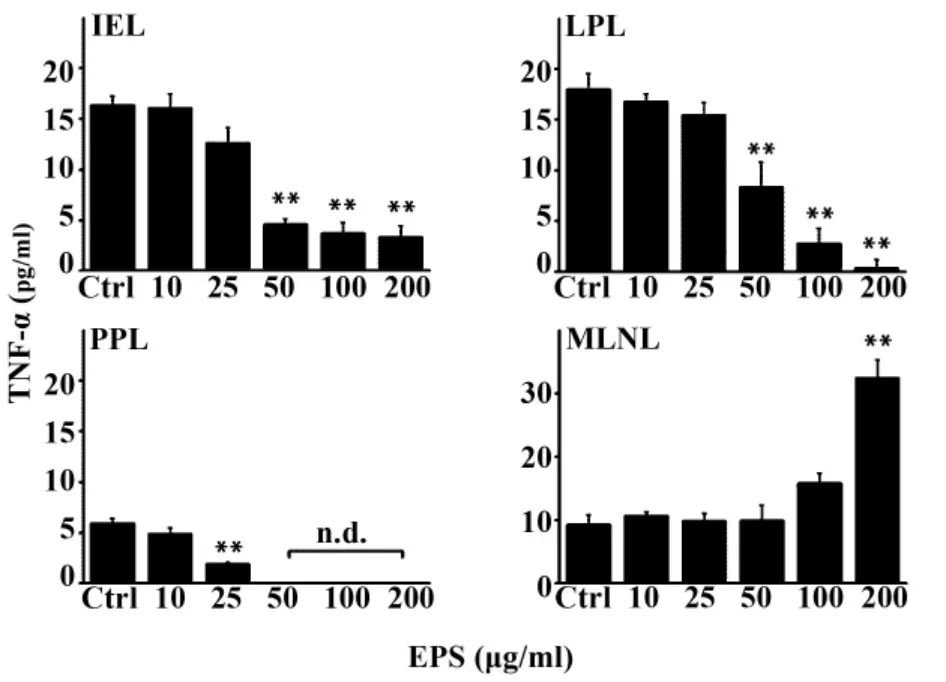
图1 ELISA法检测EPS对GALT淋巴细胞分泌TNF-α的影响Fig.1 Effect of EPS on TNF-α induction of GALT lymphocytes by ELISA assay
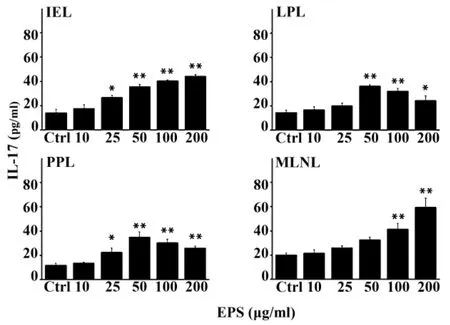
图2 ELISA法检测EPS对GALT淋巴细胞分泌IL-17的影响Fig.2 Effect of EPS on IL-17 in duction of GALT lymphocytes by ELISA assay

图3 ELISA法检测EPS对GALT淋巴细胞分泌IFN-γ的影响Fig.3 Effect of EPS on IFN-γ induction of GALT lymphocytes by ELISA assay
2.4 EPS对小鼠IEL、LPL、PPL及MLNL分泌IFN-γ调控 如图 3所示,EPS对 IEL、LPL、PPL及MLNL上清液中IFN-γ含量无明显影响,与对照组之间的差异不显著(P>0.05)。
3 讨论
早在1988年,Gómez等[13]证明了青春双歧杆菌所合成的EPS可以促进T淋巴细胞的增殖。随后,Kitazawa等[14]发现一种德式乳杆菌所分泌的EPS同样具有促进淋巴细胞增殖的能力。与青春双歧杆菌和德式乳杆菌一样,干酪乳杆菌作为一种益生菌被广泛应用于乳制品生产等食品领域当中。作为食源物质,其产生的EPS对肠道相关淋巴组织中淋巴细胞免疫活性的调控,是干酪乳杆菌EPS对肠道黏膜免疫系统发挥调节作用的关键点之一。因为肠相关淋巴组织中的淋巴细胞参与黏膜免疫系统对入侵抗原做出的一系列免疫调节反应,而其较高的免疫活性则能够保证黏膜免疫调节的快速和准确。肠道淋巴细胞的免疫活性主要体现在增殖能力、分泌各类细胞因子能力和其细胞表面功能分子的表达等方面。本研究利用非常成熟并广泛应用的Percoll不连续密度梯度分离法严格操作分离BALB/c小鼠IEL、LPL、PPL及 MLNL细胞,并加以 EPS处理。WST-1增殖实验结果表明,干酪乳杆菌EPS可以显著提高体外培养的IEL、LPL、PPL及MLNL的增殖能力。其中EPS对IEL、LPL和PPL增殖的影响趋势相似。而MLNL的增殖则呈剂量依赖性,且增殖效果最为明显。由此可见,干酪乳杆菌EPS能够不同程度地促进BALB/c小鼠四种主要肠相关淋巴组织中淋巴细胞的增殖,并可能通过此效应初步增强肠道黏膜免疫中由淋巴细胞介导或参与的免疫应答。
已有报道证实,一些多糖类物质具有调控肠道淋巴细胞和脾淋巴等分泌细胞因子的能力[15,16]。本研究在淋巴细胞分泌的诸多细胞因子中选择了TNF-α、IL-17及 IFN-γ 作为研究对象,以检测干酪乳杆菌EPS对肠相关淋巴细胞分泌典型细胞因子的调控。IFN-γ主要由活化的Th1型 CD4+T淋巴细胞分泌,γδT淋巴细胞、NK细胞等也可分泌;TNF-α则主要由巨噬细胞分泌,Th1型CD4+T淋巴细胞、γδT淋巴细胞等也是其分泌细胞;IL-17的主要分泌细胞为Th17细胞、γδT淋巴细胞等。本研究结果表明,干酪乳杆菌EPS可以抑制体外培养的IEL、LPL和 PPL分泌 TNF-α,原因可能是干酪乳杆菌EPS直接抑制主要分泌细胞TNF-α或者促进了相关抑制因子的分泌间接地抑制TNF-α水平。但干酪乳杆菌EPS对MLNL中TNF-α的分泌无明显抑制作用,相反TNF-α的分泌量在高浓度时有显著提高,这样的结果可能与MLNL含有不同类型、不同含量的淋巴细胞亚群有关。MLNL中CD4+T淋巴细胞的含量较高,IEL、LPL和PPL中CD4+T淋巴细胞含量较低,而 Th1型 CD4+T淋巴细胞具有分泌TNF-α的能力。因此MLNL中TNF-α水平的增加可能揭示了EPS具有调控Th1型CD4+T淋巴细胞分泌TNF-α的能力,但具体分子学机制仍需进一步确定。与调控TNF-α不同,干酪乳杆菌EPS对四种肠相关淋巴细胞IL-17的分泌呈现促进作用,其中IEL及MLNL最为显著,且呈剂量依赖。在四种淋巴组织中均含有一定的IL-17分泌细胞,如Th17细胞、γδT淋巴细胞等,因此推断干酪乳杆菌EPS可能具有调控IL-17主要分泌细胞的能力。
研究结果初步表明,干酪乳杆菌EPS可体外促进肠相关组织中淋巴细胞增殖和调节相关细胞因子TNF-α、IL-17的分泌,初步推断干酪乳杆菌EPS具有调节肠相关淋巴组织淋巴细胞免疫活性的能力,能够改善肠黏膜免疫系统。但EPS通过口服途径到达肠道,以大分子形式接触肠相关淋巴细胞后,是否仍具有与体外实验相符的功能仍需进一步证实。
1 Maria Luisa ForcShielli,Allan Walker.The role of gut-associated lymphoid tissues and mucosal defence[J].Br J Nutr,2005;93(1):S41-48.
2 Brigitte Sonier,Christopher Patrick.Intestinal immune regulation as a potential diet-modifiable feature of gut inflammation and autoimmunity[J].Int Rev Immunol,2009;28(6):414-445.
3 Rodney D Newberry,Robin G Lorenz.Organizing a mucosal defense[J].Immunol Rev,2005;206:6-21.
4 Allan McI Mowat.Anatomical basis of tolerance and immunity to intestinal angtigens[J].Nat Rev Immunol,2003;3(4):331-341.
5 Monteleone I,Vavassori P,Biancone L et al.Immunoregulation in gut:success and failures in human disease[J].Gut,2002;50(3):Ⅲ60-Ⅲ64.
6 Christoph Blaschitz,Manuela Raffatellu.Th17 cytokines and the gut mucosal barrier[J].J Clin Immunol,2010;30(2):196-203.
7 Badel S,Bernardi T,Michaud P.New perspectives for Lactobacilli exopolysaccharides[J].Biotechnol Adv,2011;29(1):54-66.
8 Perdigon G,Maldonado Galdeano C,Valdez J C et al.Interaction of lactic acid bacteria with the gut immune system[J].Eur J Clin Nutr,2002;56(4):S21-S26.
9 Monica Carol,Natalia Borruel,Maria Antolin et al.Modulation of apoptosis in intestinal lymphocytes by a probiotic bacter in Crohn's disease[J].J Leukoc Biol,2006;79(5):917-922.
10 Kimmel S A,Robert R F.Development of a growth medium suitable for exopolysaccharide production by Lactobacillus delbrueckii ssp bulgaricus RR[J].Int J Food Microbiol,1998;40(1/2):87-92.11 Aldo Arturo Resendiz-Albor,Rita Esquivel,Ruben Lopez-Revilla et al.Striking phenotypic and functional differences in lamina propria lymphocytes from the large and small intestine of mice [J].Life Sci,2005;76(24):2783-2803.
12 Dina Montufar-Solis,John R Klein.An improved method for isolating intraepithelial lymphocytes(IELs)from the murine small intestine with consistently high purity[J].J Immunol Methods,2006;308(1-2):251-254.
13 Gómez E,Melgar M M,Perez Silva G et al.Exocellular products from Bifidobacteriunm adolescentis as immunomodifiers in the lymphoproliferative responses of mouse splenocytes[J].FEMS Microbiology Letters,1988;56(1):47-52.
14 Kitazawa H,Harata T,Uemura J et al.Phosphate group requirement for mitogenic activation of lymphocytes by an extracellular phosphopolsaccharide from Lactobacillus delbrueckii ssp.Bulgaricus[J].Int J Food Microbiol,1998;40(3):169-175.
15 金丽琴,薛胜霞,吕建新et al.牛膝多糖衍生物对小鼠脾淋巴细胞增殖及诱生IL-2和TNF-α的影响[J].中国生化药物杂志,2008;29(5):312-314.
16 张皖东,吕 诚,刘振丽et al.人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能的影响[J].中草药,2007;38(2):221-224.