siRNA干扰沉默HOXA9基因对急性白血病K562细胞凋亡的影响
熊茂来 (湖北民族学院医学院,恩施445000)
白血病是一种发生于造血组织的恶性疾病,其特点是某一类型白血病细胞在骨髓组织或其他造血组织中呈肿瘤性增生。白血病发病率占儿童恶性肿瘤的第一位。在我国白血病的患者30%是儿童。急性髓系白血病 (Acute myeloid leukemia,AML)约占儿童急性白血病的20%,过去20年,5年生存率已上升至60%[1]。目前,化疗是治疗儿童白血病的主要方式,但复发、耐药等问题还有待解决,如何从分子水平进行靶向治疗提高疗效是近年来研究的热点。
HOXA9(Homo sapiens homeobox A9)基因属于高度保守同源盒基因家族的一员,广泛存在于果蝇、老鼠和人体内,与胚胎体节发育和形态发生密切相关。据报道,HOXA9基因在80%AML患者中表达上调,是导致传统治疗失败的独立影响因素[2]。在白血病模型中,HOXA9基因的过表达,对抑制骨髓细胞的分化起了重要作用,使骨髓细胞停留在原始状态[3]。因此,HOXA9基因有可能成为AML的分子治疗靶点。本实验通过siRNA靶向沉默HOXA9基因表达,探讨其对白血病K562细胞系的生物学影响,为进一步研究其基因治疗价值,提供实验依据。
1 材料与方法
1.1 试剂 K562细胞(购自中科院上海生化与细胞研究所);RPMI1640培养液和胎牛血清购自美国HyClone公司;2×SYBER GREEN Mix购自TOYOBO公司;Annexin V-FITC/PI凋亡试剂盒购自碧云天;Lipofectamine 2000、TRIZOL购自 Invitrogen公司;Anti-HOXA9购自博士德公司;HOXA9-siRNA由上海吉玛公司设计合成。
1.2 试验方法
1.2.1 实验分组和细胞培养 实验分未处理组、siRNA阴性对照组、HOXA9-siRNA组。K562细胞采用 RPMI1640培养基,含10%胎牛血清,置于37℃、5%CO2培养箱中培养。
1.2.2 设计合成HOXA9-siRNA 根据HOXA9在GeneBank中的序列,设计靶向HOXA9的siRNA序列5'-CCACGCACTGTGTTTCCTT-3',阴性 siRNA 序列5'-GGACCTGTATGCGTACATT-3',由上海吉玛公司合成。
1.2.3 细胞转染 参照Lipofectamine 2000说明书操作,12孔板中每孔K562细胞密度约为4×105个细胞,每孔转2 μg质粒。
1.2.4 细胞总RNA提取、逆转录 收集转染后48小时细胞,用 TRIZOL一步法提取细胞总RNA,逆转录参照Fermentas逆转录试剂盒说明书操作。
1.2.5 Real time PCR SYBER Green法检测各组HOXA9 mRNA水平 以 GAPDH为内参,以2-△△CT法分析各样本CT值。HOXA9上游引物5'-GTCCCACGCTTGACACTC-3',下游引物 5'-GTTGGCTGCTGGGTTATT-3';GAPDH上游引物5'-GGTATCGTGGAAGGACCATGAC-3',下游引物 5'-ATGCCAGTGAGCTTCCCGTTCAGC-3';引物由上海生工合成。
1.2.6 Western blot 收集转染后72小时细胞,用RIPA裂解液裂解,于 12%SDS-PAGE电泳,按1∶1 000比例稀释一抗,4℃孵育过夜,HRP标记二抗室温孵育1小时,ECL法显色。
1.2.7 细胞凋亡检测 分别收集转染后24、48、72小时细胞,PBS冲洗两次,每份样本加 200 μl Annexin V-FITC 结合液、5 μl Annexin V、5 μl PI避光孵育15分钟后进行流式细胞学检测。
1.3 统计学分析 使用SPSS10.0统计软件,t检验统计学处理,数据以±s表示,组间比较采用单因素方差分析(ANOVA),检验水准:α=0.05。
2 结果
2.1 HOXA9-siRNA对K562细胞HOXA9 mRNA水平的影响 Real time PCR法检测K562细胞转染后HOXA9基因mRNA水平改变,结果见图1。
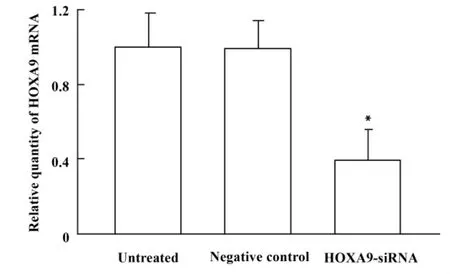
图1 HOXA9-siRNA对K562细胞HOXA9 mRNA表达的影响Fig.1 Effect of HOXA9-siRNA on HOXA9 mRNA level in K562 cells

图2 HOXA9-siRNA对K562细胞HOXA9蛋白表达的影响Fig.2 Effect of HOXA9-siRNA on HOXA9 protein level in K562 cells
2.2 HOXA9-siRNA对K562细胞HOXA9蛋白水平影响 Western blot检测转染后HOXA9蛋白水平变化,结果见图2。
2.3 HOXA9-siRNA对K562细胞凋亡率的影响流式细胞学检测细胞凋亡,结果见图3、表1。
3 讨论
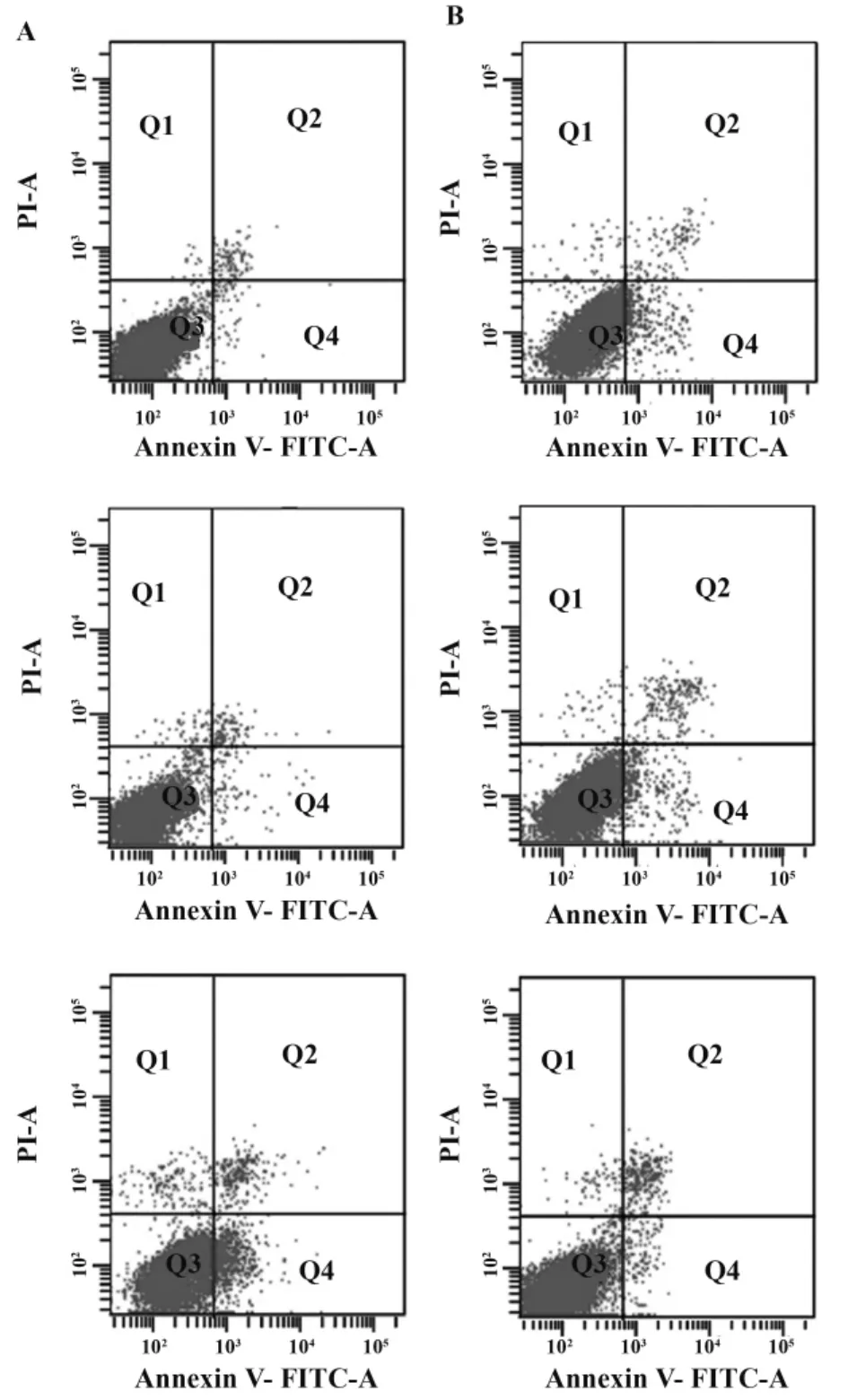
图3 HOXA9-siRNA对K562细胞凋亡的影响Fig.3 Effect of HOXA9-siRNA on K562 cells apoptosis

表1 各组凋亡率变化Tab.1 Apoptosis of three groups
越来越多的证据表明Hox基因家族在造血生长调控中起到重要作用[4]。在老鼠骨髓细胞中,HOXA9的过表达在3~8个月内导致AML,表明其是先于AML发生,HOXA9的过表达成为与预后不良相关的独立因素[2]。转进HOXA9的转基因小鼠,与对照组相比,移植入的淋巴髓系细胞长期存活数量增加了15倍,表明HOXA9在促进造血干细胞生长中的作用[5]。HOXA9在混合系白血病中表达胞、γδT淋巴细胞等,因此推断干酪乳杆菌EPS可能具有调控IL-17主要分泌细胞的能力。
研究结果初步表明,干酪乳杆菌EPS可体外促进肠相关组织中淋巴细胞增殖和调节相关细胞因子TNF-α、IL-17的分泌,初步推断干酪乳杆菌EPS具有调节肠相关淋巴组织淋巴细胞免疫活性的能力,能够改善肠黏膜免疫系统。但EPS通过口服途径到达肠道,以大分子形式接触肠相关淋巴细胞后,是否仍具有与体外实验相符的功能仍需进一步证实。
1 Maria Luisa ForcShielli,Allan Walker.The role of gut-associated lymphoid tissues and mucosal defence[J].Br J Nutr,2005;93(1):S41-48.
2 Brigitte Sonier,Christopher Patrick.Intestinal immune regulation as a potential diet-modifiable feature of gut inflammation and autoimmunity[J].Int Rev Immunol,2009;28(6):414-445.
3 Rodney D Newberry,Robin G Lorenz.Organizing a mucosal defense[J].Immunol Rev,2005;206:6-21.
4 Allan McI Mowat.Anatomical basis of tolerance and immunity to intestinal angtigens[J].Nat Rev Immunol,2003;3(4):331-341.
5 Monteleone I,Vavassori P,Biancone L et al.Immunoregulation in gut:success and failures in human disease[J].Gut,2002;50(3):Ⅲ60-Ⅲ64.
6 Christoph Blaschitz,Manuela Raffatellu.Th17 cytokines and the gut mucosal barrier[J].J Clin Immunol,2010;30(2):196-203.
7 Badel S,Bernardi T,Michaud P.New perspectives for Lactobacilli exopolysaccharides[J].Biotechnol Adv,2011;29(1):54-66.
8 Perdigon G,Maldonado Galdeano C,Valdez J C et al.Interaction of lactic acid bacteria with the gut immune system[J].Eur J Clin Nutr,2002;56(4):S21-S26.
9 Monica Carol,Natalia Borruel,Maria Antolin et al.Modulation of apoptosis in intestinal lymphocytes by a probiotic bacter in Crohn's disease[J].J Leukoc Biol,2006;79(5):917-922.
10 Kimmel S A,Robert R F.Development of a growth medium suitable for exopolysaccharide production by Lactobacillus delbrueckii ssp bulgaricus RR[J].Int J Food Microbiol,1998;40(1/2):87-92.11 Aldo Arturo Resendiz-Albor,Rita Esquivel,Ruben Lopez-Revilla et al.Striking phenotypic and functional differences in lamina propria lymphocytes from the large and small intestine of mice [J].Life Sci,2005;76(24):2783-2803.
12 Dina Montufar-Solis,John R Klein.An improved method for isolating intraepithelial lymphocytes(IELs)from the murine small intestine with consistently high purity[J].J Immunol Methods,2006;308(1-2):251-254.
13 Gómez E,Melgar M M,Perez Silva G et al.Exocellular products from Bifidobacteriunm adolescentis as immunomodifiers in the lymphoproliferative responses of mouse splenocytes[J].FEMS Microbiology Letters,1988;56(1):47-52.
14 Kitazawa H,Harata T,Uemura J et al.Phosphate group requirement for mitogenic activation of lymphocytes by an extracellular phosphopolsaccharide from Lactobacillus delbrueckii ssp.Bulgaricus[J].Int J Food Microbiol,1998;40(3):169-175.
15 金丽琴,薛胜霞,吕建新et al.牛膝多糖衍生物对小鼠脾淋巴细胞增殖及诱生IL-2和TNF-α的影响[J].中国生化药物杂志,2008;29(5):312-314.
16 张皖东,吕 诚,刘振丽et al.人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能的影响[J].中草药,2007;38(2):221-224.